布鲁氏菌4种高通量抗体检测方法的比较研究
2021-11-24李筱英范学政彭小薇丁家波
蒋 卉,冯 宇,李筱英,范学政,彭小薇,丁家波
(中国兽医药品监察所,国家/OIE布鲁氏菌病参考实验室,北京 100081)
布鲁氏菌病(简称“布病”)是一种由布鲁氏菌引起的慢性多器官损伤性人畜共患传染病,WHO 将布鲁氏菌病视为“世界范围内流行最广泛的人畜共患病,但也是最易被人们所忽视的7种重要传染病之一”[1]。布病主要是通过直接或间接接触染病动物或动物产品而感染[2]。人患布病后,会引起发热、肌肉和关节疼痛等,严重者完全丧失劳动能力;家畜感染布病则引起流产和不育,给养殖业造成巨大的经济损失[3],严重威胁人类食品安全和公共卫生安全。
准确诊断是布病防控极为重要的环节[4],我国对二、三类地区的动物布病防控政策主要采取“检验-淘汰”策略。在布病防控实践中,因检测方法或试剂选择问题常常会导致“假阳性”和“假阴性”结果,并进而引起误杀或传染源不能及时剔除出群,这一现象严重阻碍了布病的有效防控。血清学方法是布病实验室诊断常用方法[5],主要包括虎红平板凝集试验(RBT)、试管凝集试验(SAT)、全乳环状反应(MRT)、补体结合试验(CFT)、荧光偏振试验(FPA)以及酶联免疫吸附试验(间接ELISA或竞争ELISA)[6]等。RBT、SAT、MRT等传统凝集类试验,以灭活的菌体作为诊断抗原,其特异性和敏感性低于FPA、ELISA方法,其中SAT已不作为国际贸易的法定方法[7-8]。对于大量样品的检测,OIE推荐的方法包括荧光偏振法(FPA)、竞争ELISA(cELISA)、间接ELISA(iELISA)和微量法补体结合试验(mCFT),以上方法也是我国国家/OIE布病参考实验室常用检测方法。目前市售商品化布病抗体检测试剂盒种类繁多,但是在临床检测中,各类试剂盒因检测灵敏度的差异,导致同一份血清样品用不同方法检测,结果不一,给检验人员带来了较大困惑。
本研究对国家/OIE布病参考实验室开发的4种布病高通量诊断方法(FPA、cELISA、iELISA抗体检测试剂盒和改进的mCFT)进行灵敏度、敏感性、特异性分析,并分别用4种诊断方法对临床315份牛血清样品进行了检测,比较各方法之间的符合率,为布病诊断试剂的标准化提供了依据。
1 材料与方法
1.1 血清样品
布病抗体阳性牛血清70份,经RBT、SAT、CFT检测均为阳性;布病抗体阴性牛血清82份,经RBT、SAT、CFT检测均为阴性;由本实验室保存。临床牛血清共计315份,由本实验室从非免疫牛场采集、保存。
1.2 主要试剂
牛布病间接ELISA抗体检测试剂盒,批号20082602;动物布病竞争ELISA抗体检测试剂盒,批号20061901;布鲁氏菌荧光偏振抗体检测试剂盒,批号20200809;mCFT用补体、溶血素、抗原等均由中国兽医药品监察所国家/OIE布病参考实验室提供。布病阳性血清标准品(牛源)购自英国NIBSC,经试管凝集试验和补体结合试验(CFT)标定为1 000 IU,批号2BADS。mCFT所用红细胞按参考文献[9-10]方法制备。
1.3 布病阳性血清标准品的稀释
用1 mL生理盐水将布病阳性血清标准品复溶。再用生理盐水将血清进行1∶5、1∶10、1∶20、1∶40、1∶80等5个不同稀释度备用,即血清抗体含量为200、100、50、25、12.5 IU·mL-1。
1.4 4种检测方法灵敏度的测定
采用FPA、cELISA、iELISA和mCFT分别检测5个不同稀释度布病阳性血清标准品,每个稀释度重复3次,结果取其平均值,比较各方法之间的检测灵敏度。FPA、cELISA、iELISA按试剂盒说明书操作。mCFT按照参考文献[11-12]进行,在血清样品稀释时使用与常量法CFT相同稀释度,即1∶10倍稀释,使mCFT与常量法CFT灵敏度一致。各检测方法的判定标准:FPA判定标准为△mP值≥20 mP时,为布病抗体阳性(+);△mP值<20 mP时,为布病抗体阴性(-)。牛布病iELISA判定标准为P%值≥20%时,为牛布病抗体阳性(+);P%值<20%时,为牛布病抗体阴性(-)。动物布病cELISA判定标准为PI%值≥30%时,为布病抗体阳性(+);PI%值<30%时,为布病抗体阴性(-)。mCFT判定标准为100%溶血为布病抗体阴性(-);50%~90%溶血为布病抗体可疑(±);0~40%溶血为布病抗体阳性(+)。
1.5 对已知阴、阳性血清的特异性和敏感性检测
采用FPA、cELISA、iELISA和mCFT分别检测70份已知布病抗体阳性牛血清和82份已知布病抗体阴性牛血清,比较4种不同检测方法的敏感性和特异性。
1.6 4种检测方法检测临床样品的符合率比较
将315份血清样本分别采用FPA、cELISA、iELISA抗体检测试剂盒和mCFT进行检测,依据OIE陆生动物手册和《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)推荐的确诊方法,以mCFT检测结果进行最终定性检测,比较4种不同检测方法之间的符合率。
2 结 果
2.1 4种检测方法灵敏度的测定
将布病阳性血清标准品(牛源)稀释成5个不同稀释度,用FPA、cELISA、iELISA和mCFT进行检测,确定4种检测方法的灵敏度,结果见表1。4种检测方法检测灵敏度结果一致,即布病阳性血清标准品稀释1∶20(即50 IU·mL-1)均检测为阳性;布病阳性血清标准品稀释1∶40(即25 IU·mL-1)均检测为阴性。

表1 4种布病抗体检测方法灵敏度检测结果
2.2 对已知阴、阳性血清的特异性和敏感性的检测
用FPA、cELISA、iELISA和mCFT分别检测70份已知布病抗体阳性牛血清和82份已知布病抗体阴性牛血清,结果见表2。FPA、cELISA、iELISA和mCFT方法的敏感性分别为97.14%、100.00%、100.00%、98.57%;特异性分别为96.34%、95.12%、97.56%、100.00%。
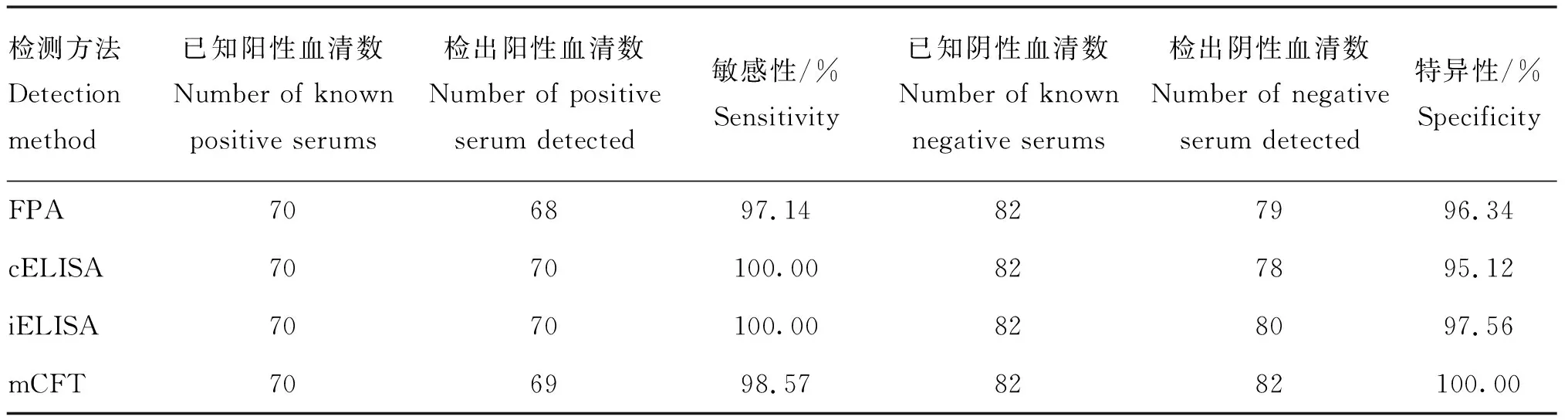
表2 对已知阴、阳性血清的特异性和敏感性检测结果
2.3 4种检测方法检测临床样品的符合率
用不同检测方法对315份临床牛血清样品进行检测,各方法之间的符合率见表3~5。表3结果表明,以mCFT检测结果为最终判定标准,FPA、cELISA、iELISA与mCFT的结果符合率分别为96.83%、92.7%、97.14%,其中iELISA与mCFT符合率最高,cELISA与mCFT符合率最低。表4、5结果表明,FPA、cELISA与iELISA检测结果的符合率分别为95.24%和93.65%,FPA与cELISA检测结果的符合率为91.43%。
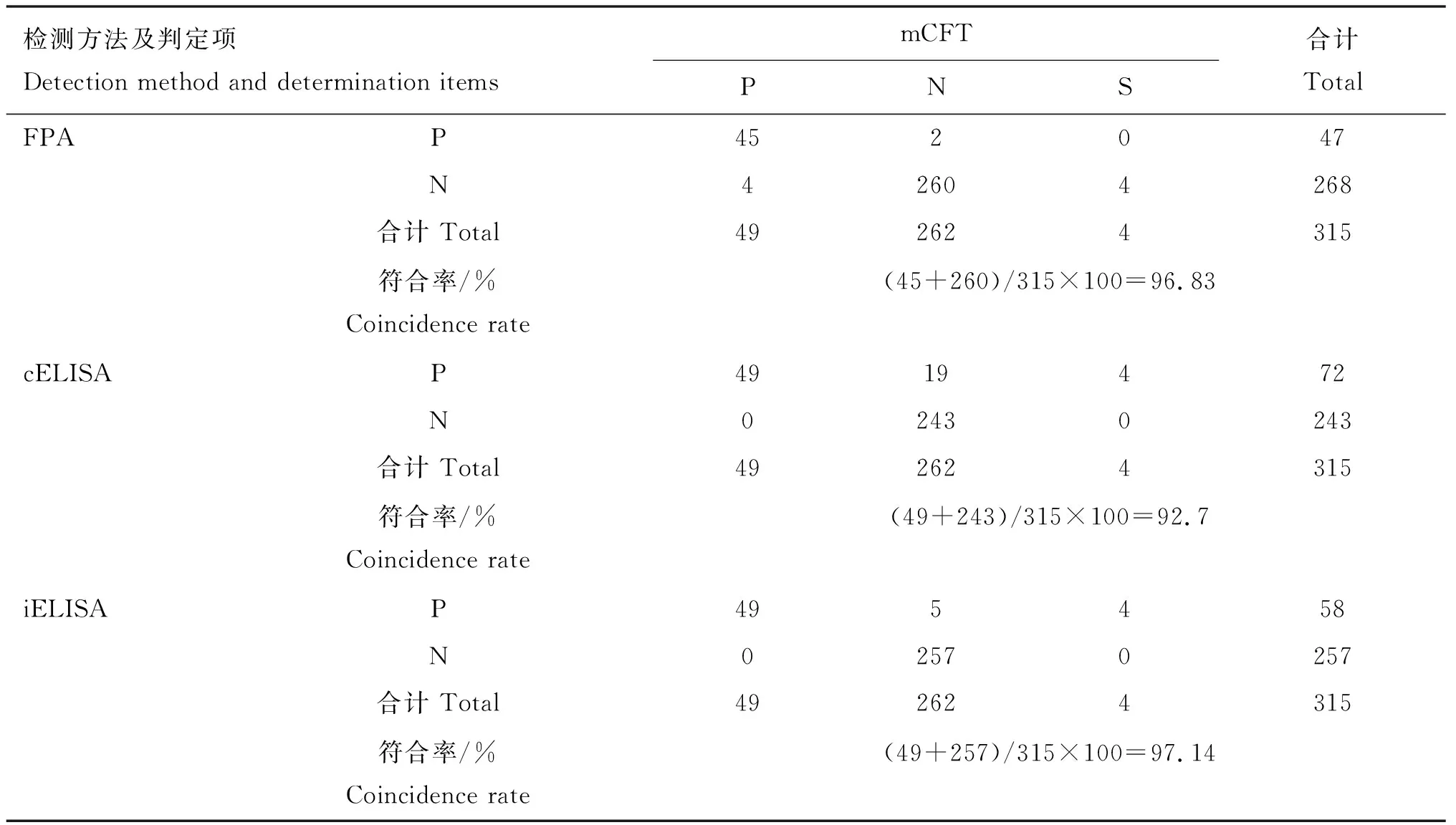
表3 FPA、cELISA、iELISA与mCFT检测结果的符合率
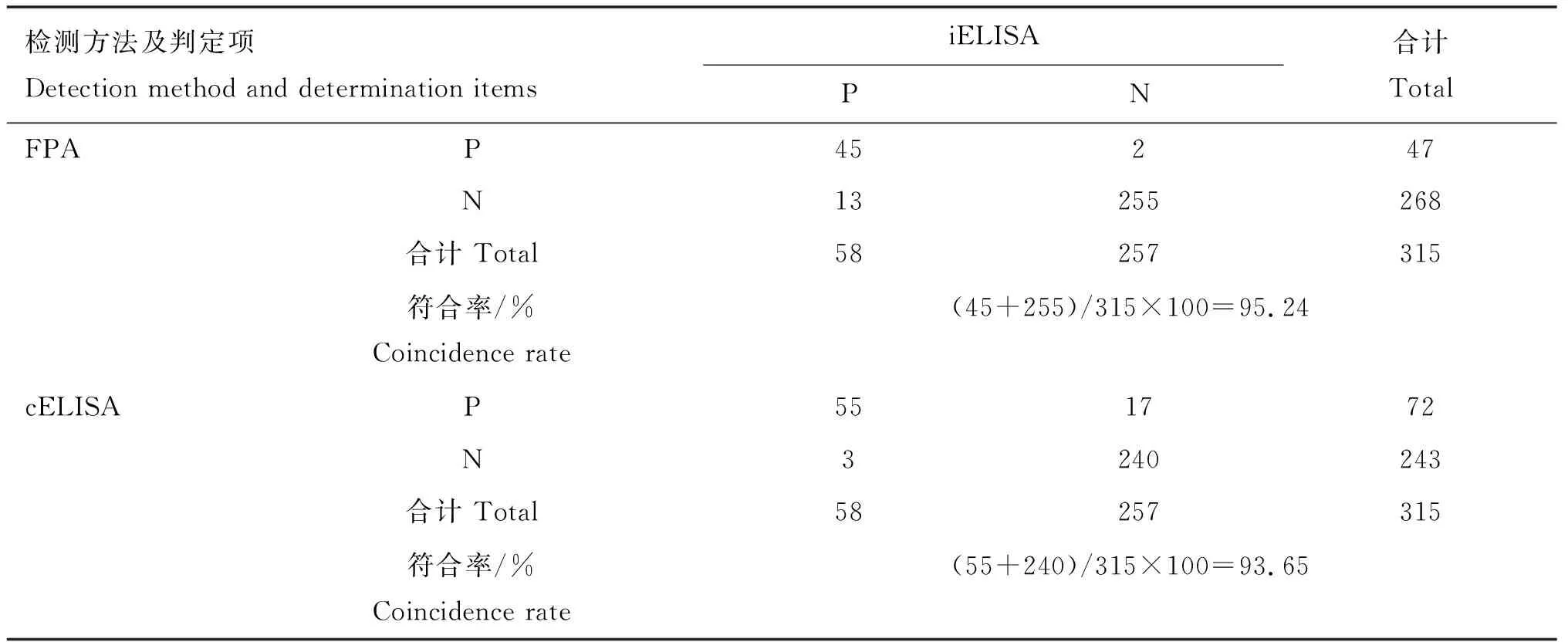
表4 FPA、cELISA与iELISA检测结果的符合率
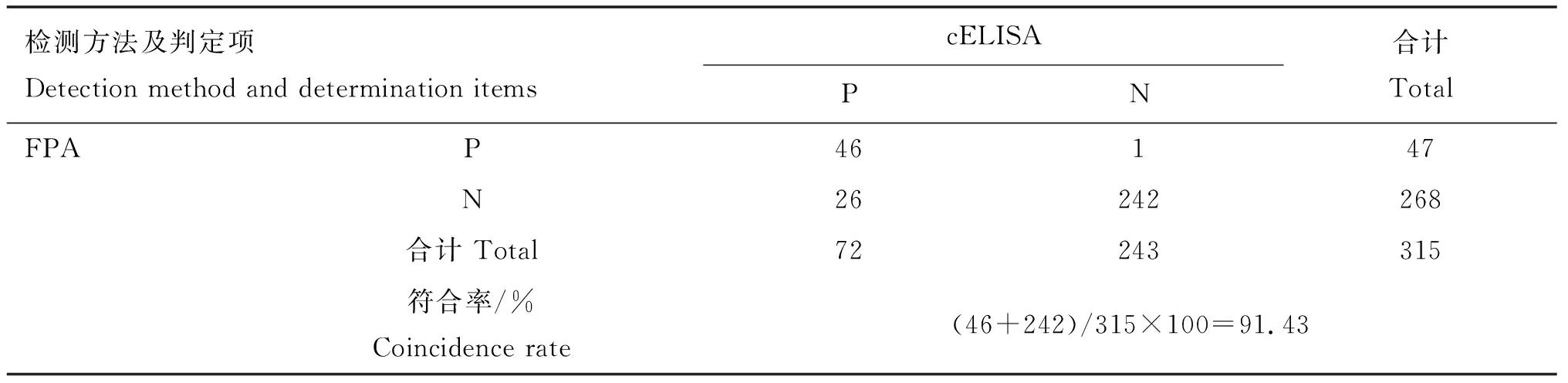
表5 FPA与cELISA检测结果的符合率
3 讨 论
布鲁氏菌病是一种重要的人畜共患病,患病动物是人感染布病的主要传染源[13],因此做好动物布病的防控对公共卫生意义重大。目前布病防控面临的主要问题之一就是如何实现科学准确的诊断。解决这一难题的关键在于两个方面,一是检测方法及诊断试剂的标准化,二是使用敏感性和特异性更高的检测方法替代传统凝集类试验[14-15],如FPA、cELISA、iELISA、mCFT等。现行《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)国家标准中虽已纳入cELISA和iELISA方法,但与OIE手册存在差异[11],标准中未对两种ELISA方法的检测灵敏度进行标准化,因而在临床诊断中使用不同商品化试剂盒或同一公司不同批次的试剂盒检测同一批血清样品时,往往会出现检测结果的显著差异。因检测结果不准确导致阳性动物不能及时隔离出群以及阴性动物被误杀常常阻碍了布病的净化工作。
研究发现,试验选用的FPA、cELISA、iELISA抗体检测试剂盒和改进的mCFT,其检测灵敏度被有效控制在同一水平,即布病阳性血清标准品稀释1∶20(即50 IU·mL-1)均检测为阳性;布病阳性血清标准品稀释1∶40(即25 IU·mL-1)均检测为阴性。由于不同方法检测的临界值与常量法补体结合试验一致,不仅确保了不同方法之间检测结果的彼此吻合性,而且也有效确保了诊断的准确性。对70份已知布病抗体阳性牛血清和82份已知布病抗体阴性牛血清的检测结果显示,4种检测方法的敏感性均高于97%,特异性均高于95%。
对临床315份牛血清样品进行检测,结果4种方法之间的符合率均高于90%,证实了统一诊断标准的重要性。4种方法中iELISA与mCFT符合率最高,达97.14%,cELISA与mCFT符合率最低,仅为91.43%。这主要是由于不同方法检测的抗体类型差异所致,iELISA与mCFT均主要检测IgG类抗体[16-17],而cELISA可同时检测血清中特异性IgM和IgG抗体。由于布病阳性血清标准品在制备过程中只保留了IgG类特异性抗体,其定值依据IgG的含量确定,在此基础上统一的各种诊断方法灵敏度(50 IU·mL-1)对于只检测IgG类抗体的方法(如iELISA和CFT)是精确的,而对能同时检测IgM类抗体的cELISA则是相对的。对于一份感染早期的血清,只需要IgM和IgG的总量达到50 IU·mL-1,在cELISA中就表现为阳性,因此cELISA相对于其他方法,其敏感性更高,可能会检测出更多的阳性样品。以上研究结果与董浩等[18]开展的研究结果一致,其采用国家/OIE布病参考实验室开发的cELISA、iELISA抗体检测试剂盒等对300份临床样品进行检测,对63份检测结果不一致的样品用CFT复核,结果iELISA与CFT的符合率最高,为98.41%[18]。因此,在布病血清学诊断中因cELISA可检测更多的抗体类型,具有更好的敏感性,适合于动物布病的初筛;iELISA与CFT均检测IgG类抗体,适合于动物布病的确诊。但前提是各检测方法应具有相同的灵敏度,这就要求试验人员在试验前对不同试剂盒进行灵敏度测定,灵敏度过高的试剂盒容易导致高比例的假阳性,造成误杀。反之就有高比例的假阴性,导致阳性动物不能被及时发现,造成群体的持续感染。
除了cELISA和iELISA,FPA也是OIE推荐的国际贸易指定方法,已被用于北美和欧洲的布病根除计划[19-20],但现行《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)国家标准中未收录该方法,目前我国仅部分大型养殖集团采用该方法进行布病血清学监测。FPA利用了生物物理学原理对布鲁氏菌特异性抗体进行检测,当荧光素标记的布鲁氏菌特异性抗原与相应抗体结合后,导致其对激发光的旋光能力发生变化,根据旋光偏振的角度大小,判定是否含有特定的抗体。该方法与同样适用于血清学监测的RBT相比,最大优点是检测效率高,检测一块96孔板的时间仅为20 min,但是需要专有设备,检测成本较高。本研究结果表明,FPA抗体检测试剂盒同样具有较高的准确性,与mCFT、iELISA方法符合率分别为96.83%、95.24%,高于与cELISA的符合率(91.43%),提示FPA方法对IgM类抗体敏感性低,这可能与IgM抗体的分子对称性结构有关。FPA准确快捷的特点非常适用于大量样本的血清学监测。
总之,当统一了诊断标准后,不同布病血清学方法之间存在较高的符合率。根据各方法检测的抗体类型差异,cELISA适合于动物布病的初筛,FPA适用于常规血清学监测,mCFT和iELISA适用于布病确诊。但实践中,由于各试剂盒生产企业对于诊断试剂标准化的认识不足,往往导致各检测方法的灵敏度各异,出现cELISA的敏感性低于iELISA的结果。因此急需尽快启动《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)的修订,对各检测方法检测灵敏度进行标准化规定,提高我国布病诊断试剂的质量,为布病防控提供可靠的技术支撑。
4 结 论
比较了国家/OIE布病参考实验室开发的FPA、cELISA、iELISA抗体检测试剂盒和改进的mCFT的灵敏度、敏感性、特异性和检测临床样品的符合率。当4种方法的检测灵敏度一致时,不同布病血清学方法的敏感性、特异性以及对临床样品检测结果的符合率均高于90%。本研究为科学选择和使用布鲁氏菌抗体检测方法,推动布病诊断试剂标准化提供了参考。
