禽致病性大肠杆菌clpV2基因缺失株的构建及生物学特性分析
2021-11-24钟昊然王培莉朱国强李建基崔璐莹董俊升
钟昊然,王培莉,郭 佳,王 亨,朱国强,李建基,崔璐莹,董俊升,孟 霞*
(1.扬州大学兽医学院,江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;2.教育部农业与农产品安全国际合作联合实验室,扬州 225009)
在1/4的革兰阴性菌中都能发现六型分泌系统(Type VI secretion system, T6SS)的存在[1-2]。ClpV作为T6SS的必需组分,能在ATP的驱动下完成T6SS的回收,为T6SS分泌效应因子提供能量[3]。大肠杆菌(Escherichiacoli,Ecoli)被证实含有3套T6SS,有研究表明T6SS2在侵袭脑微血管内皮细胞的过程中发挥重要作用,且T6SS2也含有核心组分ClpV2[4]。但目前关于ClpV2的生物学特性研究却鲜有报道[5]。
本研究利用Red同源重组,成功构建了TW-XM菌株T6SS2中的clpV2基因突变株,并比较各突变株部分生物学特性的差异,为深入研究ClpV2在APEC致病性的过程中发挥何种作用提供参考。
1 材料与方法
1.1 菌株与质粒
菌株APEC TW-XM、DH5α;质粒pKD46、pKD3、pCP20均由扬州大学朱国强教授馈赠。
1.2 主要试剂、仪器
Marker Ⅲ购自北京天根生化科技有限公司;Mueller-Hinton琼脂购自青岛高科园海博生物技术有限公司;常用药敏片购自杭州微生物生物试剂有限公司。
1.3 引物设计与合成
根据APEC TW-XM菌株已知的clpV2基因序列,设计缺失引物ΔclpV2-Cm-F/ΔclpV2-Cm-R、缺失鉴定引物clpV2-F/clpV2-R及回补引物pBR-clpV2-F/pBR-clpV2-R。引物均由南京擎科生物技术公司合成,序列见表1。

表1 构建clpV2基因突变株的引物序列
1.4 clpV2基因突变株的构建与遗传稳定性试验
按照丁雪燕等[6]的方法,通过Red同源重组构建clpV2基因缺失株。筛选clpV2线性片段与含有pKD46的TW-XM感受态细胞的阳性转化子,以clpV2-F/clpV2-R为引物进行PCR鉴定。随后将pCP20质粒导入一次重组菌中,再次以clpV2-F/clpV2-R为引物进行PCR鉴定。鉴定正确后命名为TW-XM△clpV2。以pBR-clpV2-F/pBR-clpV2-R为引物,TW-XM为模板,扩增得到clpV2基因。经测序验证正确后克隆至表达载体pBR322中,将重组质粒pBR322-clpV2转化至TW-XM△clpV2,得到回补株TW-XMC△clpV2。
将上述得到的突变株连续传代,取第1、10、20、30代进行遗传稳定性分析。
1.5 生长曲线及运动性测定
将各菌株菌液按1∶100转接至30 mL新鲜的LB培养基中,于37 ℃ 180 r·min-1震荡培养,每小时取100 μL测定培养物的OD630 nm值,绘制生长曲线。将1 μL培养至OD630 nm=1.0的菌液滴加于半固体平皿中心,37 ℃培养18 h后测定细菌运动环直径。
1.6 生物被膜形成能力测定
采用96孔微孔板法测定生物被膜形成能力。将浓度为OD630 nm=1.0的各菌株菌液,按1∶100接种至96孔板中培养24 h。在蒸馏水洗涤后加入2%结晶紫染色20 min,洗涤后加入95%乙醇,检测OD630 nm值。
1.7 药物敏感性试验
用K-B法药敏试验检测药物敏感性。将新鲜菌液配成0.5麦氏单位菌液后,在M-H琼脂表面均匀涂布,将药敏片贴于琼脂表面,37 ℃培养18 h,测量抑菌圈直径大小。
1.8 统计学分析
数据处理采用SPSS 17.0软件,使用单因素方差分析(One-way ANOVA),*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结 果
2.1 clpV2基因突变株的构建与遗传稳定性试验
如图1所示:野生菌clpV2扩增片段为2 688 bp,二次重组体为921 bp。回补株显示有两个特异性条带,921 bp处为缺失株的二次重组条带,2 688 bp处为回补质粒pBR322-clpV2的clpV2片段,表明各突变株构建成功。且连续传30代后均未发生突变,表明突变株具有良好的遗传稳定性。

M.Marker Ⅲ相对分子质量标准;1.野生株TW-XM;2~5.缺失株TW-XM△clpV2;6~8.回补株TW-XMC△clpV2
2.2 clpV2基因对生长曲线及药物敏感性的影响
生长曲线结果显示,各菌株在生长对数期、平台期、迟缓期的生长情况均无明显差异,表明clpV2基因不影响TW-XM的生长;药敏试验结果显示各菌株对上述9种药物的敏感性无明显差异(结果未展示)。
2.3 clpV2基因对运动性及生物被膜形成的影响
TW-XM△clpV2的运动环显著小于野生株(P<0.05),提示clpV2基因的缺失影响了运动性(图2);TW-XM△clpV2的生物被膜形成能力与野生株相比显著下降,提示clpV2基因的缺失会影响生物被膜形成能力(图3)。

*.P<0.05;ns.P>0.05
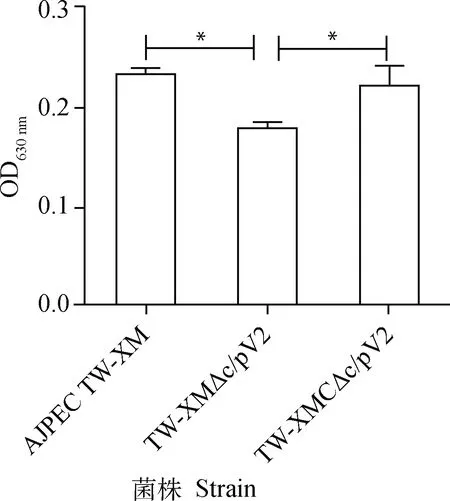
*.P<0.05
3 讨 论
2000年,Datsenko和Wanner[7]利用两步同源重组法对大肠杆菌K-12进行了基因敲除,该方法简单易行,相比传统方法重组率也更高[8]。如今,该方法在大肠杆菌的基因敲除中被广泛应用。
国内外已有关于clpV的报道,Liu等[9]在敲除迟缓爱德华菌(Citrobacterfreundii)中的clpV后发现细菌鞭毛蛋白的表达下调,同时Tang等[10]发现假单胞菌(Pseudomonasplecoglossicida)clpV基因的沉默会下调鞭毛合成相关基因的表达,而本试验利用Red同源重组敲除clpV2基因后细菌运动能力减弱,则证明其与大肠杆菌的运动能力存在关联。除clpV2基因外,对T6SS2其余核心组分的研究也有了一定进展。Ding等[11]先前已成功敲除APEC CE129中T6SS2的另一核心组分hcp2基因,并对相应突变株进行了生物学特性分析。结果显示细菌的生物被膜形成能力显著降低、对鸡胚成纤维细胞的黏附能力显著减弱、Ⅰ型菌毛主要亚单位基因fimA以及fimC的mRNA相对表达量显著降低。在本研究中,clpV2的缺失也导致生物被膜形成能力减弱,证明T6SS2可能参与调控Ⅰ型菌毛的合成,从而影响生物被膜形成能力和黏附能力,进而影响致病力。但具体哪些黏附素表达受到影响还有待进一步探索。与此同时,clpV2基因的缺失不影响细菌的药物敏感性,说明T6SS2可能不参与耐药性调控。
而本试验中TW-XMclpV2基因的成功敲除,有助于深入了解 T6SS2的功能,同时也为研究APEC TW-XM致脑膜炎的机制奠定基础。
4 结 论
利用Red同源重组成功构建TW-XM的clpV2基因缺失株,并构建相应的回补株。各突变株均能稳定遗传,发现clpV2基因的缺失不影响TW-XM菌株的生长速度以及对多种抗生素的敏感性,但会导致其运动能力和生物被膜形成能力显著下降。
