幼年牦牛不同部位皮肤毛囊的组织学结构及TGF-β2与HIF-1α差异性表达分析
2021-11-24余四九邹胜南白雪峰SethYawAfedo赵鹏飞
张 虔,崔 燕,2*,余四九,2,廖 博,邹胜南,白雪峰,Seth Yaw Afedo,赵鹏飞,龙 敏
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
牦牛(Bosgrunniens)是我国青藏高原的特有牛种,长期生活于海拔3 000 m以上高寒、低氧的极度恶劣环境,拥有“高原之舟”的美誉[1]。皮肤作为保护机体免受外界干扰的第一道防线,在应对紫外线照射、物理或化学损伤及微生物感染等外界挑战时发挥着重要作用[2]。皮肤由表皮、真皮及皮下组织构成,在真皮层中含有大量的皮肤附属物,如毛囊、皮脂腺、汗腺等。毛囊是皮肤中控制毛发生长的微型器官,毛囊由内向外依次由内根鞘、外根鞘及结缔组织鞘三部分构成。它拥有独特的生长周期,在维持体温等方面发挥重要的作用[3]。
Findlay和Yang[4]对艾尔郡奶牛颈侧部和背部毛细血管的组织学结构进行了观察和测量,发现毛细血管的周围围绕着两个或多个毛囊群,测得背部毛囊直径[(0.086±0.030)mm]显著高于颈侧部[(0.040±0.005)mm]。胡倩倩等[5]对皖东黄牛的毛囊组织学结构观察发现,毛球主要呈球形,构成毛球的细胞深染,毛球末端为凹陷的毛乳头。毛囊由表皮向真皮下陷而成,在真皮层内倾斜排布。皖东黄牛毛囊与表皮的倾斜角度约70°,毛囊底部位于乳头层深部和网状层内。王富金等[6]对延边黄牛的毛囊结构观察并进行相关统计发现,延边黄牛的毛干呈浅黄色,每根毛有一个毛囊,毛囊密度为1 614.630 2 根·cm-2,且公畜的毛囊密度大于母畜的毛囊密度。牦牛的皮肤结构特性已有大量报道,岳静[7]、于川等[8]通过对不同年龄牦牛皮肤23个部位测量发现,牦牛皮肤的厚度随年龄的增加而逐渐增厚。杨雪等[9]对牦牛皮肤毛囊周期性结构变化规律进行研究,运用Sacpic染色更加具体的展现了生长期、退行期及休止期毛囊的结构特点。曹迷霞[10]对成年牦牛的皮脂腺和汗腺结构特点进行研究,发现成年牦牛的皮肤从背部到腹部存在渐变趋势,与其他牛类相比,牦牛汗腺和皮脂腺的密度高,但前者的分泌功能不发达而后者发达,这可能与其为了适应高原高寒环境有关。
TGF-β2是TGF-β(transforming growth factor-β)超家族中的一员,它存在于哺乳动物体内[11]。据报道,TGF-β家族在细胞增殖[12]、凋亡[13]、分化[14]等方面拥有着重要的作用,且与肿瘤的发生发展[15]和纤维化[16]密切相关。而在毛囊的相关研究中发现,TGF-β家族成员能够使毛囊退行期延迟,从而使毛囊周期发生改变[17]。然而在不同的物种中,TGF-β家族成员中行使动能的成员却不尽相同。在小鼠中TGF-β1发挥着主要作用[11],TGF-β2则是影响人类毛囊发生上皮细胞凋亡[13]。宋亮丽等[18]对TGF-β1、TGF-β2及TGF-β3在牦牛毛囊周期的调控研究发现,TGF-β2 mRNA在毛囊生长中期、生长晚期和退行期皮肤内的转录水平,显著高于同时期皮肤内TGF-β1、TGF-β3 mRNA,说明TGF-β2在毛囊周期转换中发挥重要的作用。
低氧诱导因子(hypoxia-inducible factors,HIFs)家族中的HIF-1α是机体适应低氧环境的关键调控因子[19]。1992年,Semenza和Wang[20]在Hep3B细胞株中发现HIF-1α是专一调节氧气的HIF-1亚单位,它能够与靶基因结合,促进其转录,使机体产生一系列缺氧适应反应。在低氧条件下,HIF-1α通过激活许多基因的转录,如参与能量代谢、血管生成、凋亡等,合成相应的蛋白质以增加氧的释放,使机体适应低氧环境[21]。李勇坚等[22]对HIF-1α与 iNOS在银屑病皮损中的表达及其与血管生成的关系研究中发现,银屑病皮损组织存在HIF-1α和iNOS蛋白的过表达, 可能通过促进银屑病新生血管的生成, 对银屑病的发生发展起重要作用。另有戴叶芹等[23]研究发现,HIF-1α在体外具有促进人毛囊生长和增加毛囊成纤维细胞及真皮鞘细胞活性。
牦牛作为季节性发情动物,于7~8月为发情高峰,在4~5月为繁殖旺季[24]。半岁幼年牦牛多处于高原的冬季,此时牦牛皮肤的结构完整性是冬季正常生存的重要保障,而关于幼年牦牛皮肤的组织结构特性鲜见报道。为探寻幼年牦牛皮肤毛囊结构特点及毛囊生长的分子调控机制,本试验首先采用HE和Sacpic染色法对幼年牦牛皮肤毛囊结构进行观察并对毛囊数量进行计数,筛选出多毛皮肤和少毛皮肤,其次采用免疫组化、Western blot及qRT-PCR法,对TGF-β2及HIF-1α在幼年牦牛皮肤多毛部位和少毛部位进行定位和定量研究。以探究TGF-β2及HIF-1α对幼年牦牛毛囊生长发育的影响,并为后期探究牦牛皮肤高海拔适应性分子调控机制提供资料。
1 材料与方法
1.1 试验动物
从青海西宁乐家湾选取10头健康幼年牦牛(5~6月龄)。采用颈部放血的方法处死试验动物后,采集牦牛颈部、背部、胸部、腹部、小腿部、腋下和阴囊皮肤,一部分组织样放置于4%的多聚甲醛溶液中固定2周,用于毛囊计数和免疫组化;另一部分分子样迅速放置于液氮中,运输至实验室放置于-80 ℃ 冰箱中,用于后期qRT-PCR和Western blot试验。
1.2 试验方法
从4%的多聚甲醛固定液中取出皮肤组织,切成0.4 cm×0.4 cm×0.5 cm大小的组织块,采用常规石蜡切片包埋,制作4~5 μm厚的连续切片,采用HE和Sacpic染色法进行染色,利用Olympus DP71显微照相系统进行观察并摄片。
1.2.1 Sacpic染色法 切片脱蜡至水,自来水润洗后天青石蓝B染液染色5 min,经自来水润洗后,Weigert’s 苏木精染液染色5 min,自来水润洗后返蓝水(0.5 g碳酸氢钠、5 g硫酸镁和500 mL蒸馏水充分混匀)返蓝3 min,自来水润洗后置于沙黄染液中5 min,分别用70%酒精和95%酒精分化,苦味酸乙醇饱和溶液3 min,再用95%酒精和70%酒精分化,自来水润洗后靛蓝胭脂红染色1 min,自来水润洗,最后梯度酒精脱水,二甲苯透明及中性树胶封片。
1.2.2 实时荧光定量PCR 取不同部位皮肤,研磨后置于冰盒上,用TriQuick Reagent法提取总RNA,按照反转录试剂盒说明书步骤将其反转为cDNA后,进行PCR及实时荧光定量PCR试验。反应体系20 μL。根据GenBank中黄牛(Bostaurus)TGF-β2、HIF-1α、β-actin基因序列,采用 Primer Premier6.0软件设计,并由华大基因合成,qRT-PCR 引物序列和基因序列号如表1所示。
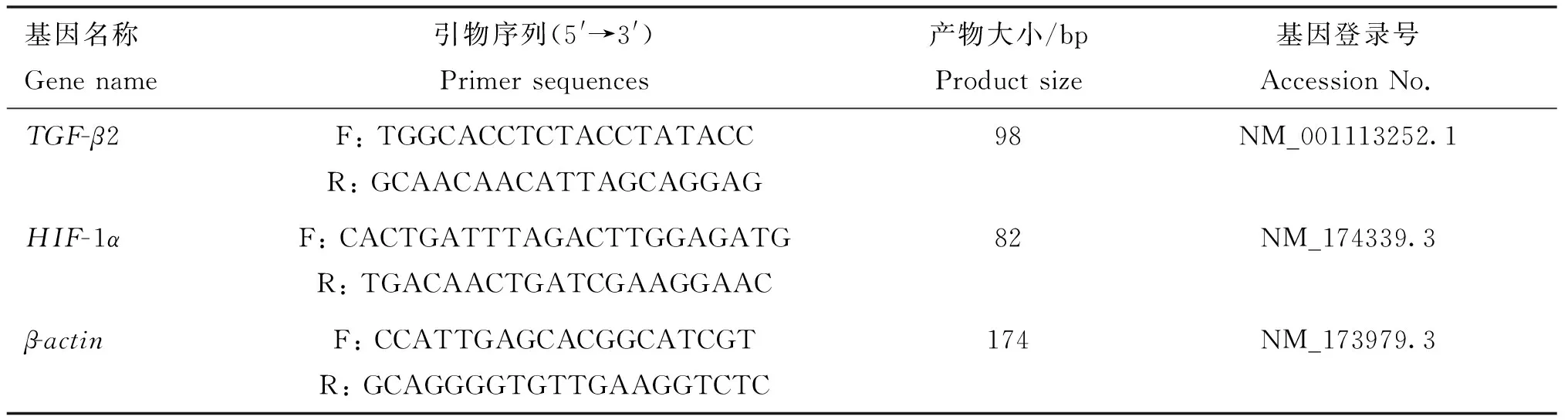
表1 目的基因和内参基因引物序列
1.2.3 Western blot 将采取的幼年牦牛背部、腋下、腹部及阴囊皮肤分别研磨后,各称取0.1 g于离心管中,每管加入1 mL的RIPA和10 μL PMSF,匀浆1.5 h,4 ℃,12 000×g离心5 min,吸取上清液至新的离心管,用ND-1000(Nano Drop Technologies)测定蛋白浓度后并进行调整。将蛋白与4×SDS-PAGE loading buffer 3∶1的比例混合,沸水浴10 min,将蛋白变性。用等量变性的蛋白上样并进行10%SDS-PAGE电泳,转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h,一抗孵育(Mouse Anti-TGF-β2,ab-36495,1∶1 000稀释;Mouse Anti-HIF-1α,ab-16066,1∶1 000稀释;β-actin,1∶1 000稀释),4 ℃过夜。用PBST清洗PVDF膜后,二抗孵育(HRP标记的鼠二抗,1∶2 500),室温1 h,用PBST清洗PVDF膜后,ECL化学发光液显色并观察结果。条带结果用Image J软件测定各条带灰度值,从而得出TGF-β2及HIF-1α在幼年牦牛不同皮肤中的相对表达量。
1.2.4 免疫组织化学染色 切片脱蜡至水后,放入pH6.0的柠檬酸盐缓冲液进行微波加热修复,待溶液冷却至室温后,用PBS洗3 min×3,3%过氧化氢溶液(来自SP试剂盒)37 ℃ 15 min, 用PBS洗3 min×3,正常山羊血清(来自SP试剂盒),室温封闭10 min,倾去勿洗,一抗孵育(TGF-β2,ab-36495,1∶1 000稀释;HIF-1α,ab-16066,1∶1 000稀释),4 ℃,过夜。复温20 min,用PBS洗3 min×3,二抗孵育(SP试剂盒B液),37 ℃ 15 min,用PBS洗3 min×3,三抗孵育(SP试剂盒C液),37 ℃ 15 min,用PBS洗3 min×3,DAB显色,在显微镜下观察并控制显色,自来水终止反应。苏木精复染2 min,盐酸酒精分化,自来水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.3 数据测量及统计分析
毛囊计数:组织蜡块横切,连续切片隔3取1,各部位各取40张切片,对毛囊进行计数。
2 结 果
2.1 不同部位皮肤毛囊的组织结构及数量
2.1.1 不同部位皮肤毛囊的结构 幼年牦牛的毛囊主要分布在真皮层,由内向外依次由内根鞘、外根鞘和结缔组织鞘组成,不同部位的毛囊组织学结构基本相似,毛囊底部膨大形成毛球(图1B),颈部(图1D)、背部(图1G)、小腿部(图1H)、腋下(图1I)和阴囊(图1 J)皮肤中,大多数毛干的毛髓质及毛囊内根鞘结构不完整;腹部(图1E)和胸部(图1F)皮肤依然清晰可见毛囊三层结构,毛囊处于退行期。Sacpic染色可见毛囊内根鞘为红色,外根鞘为苍绿色,结缔组织鞘为蓝绿色(图1C)。
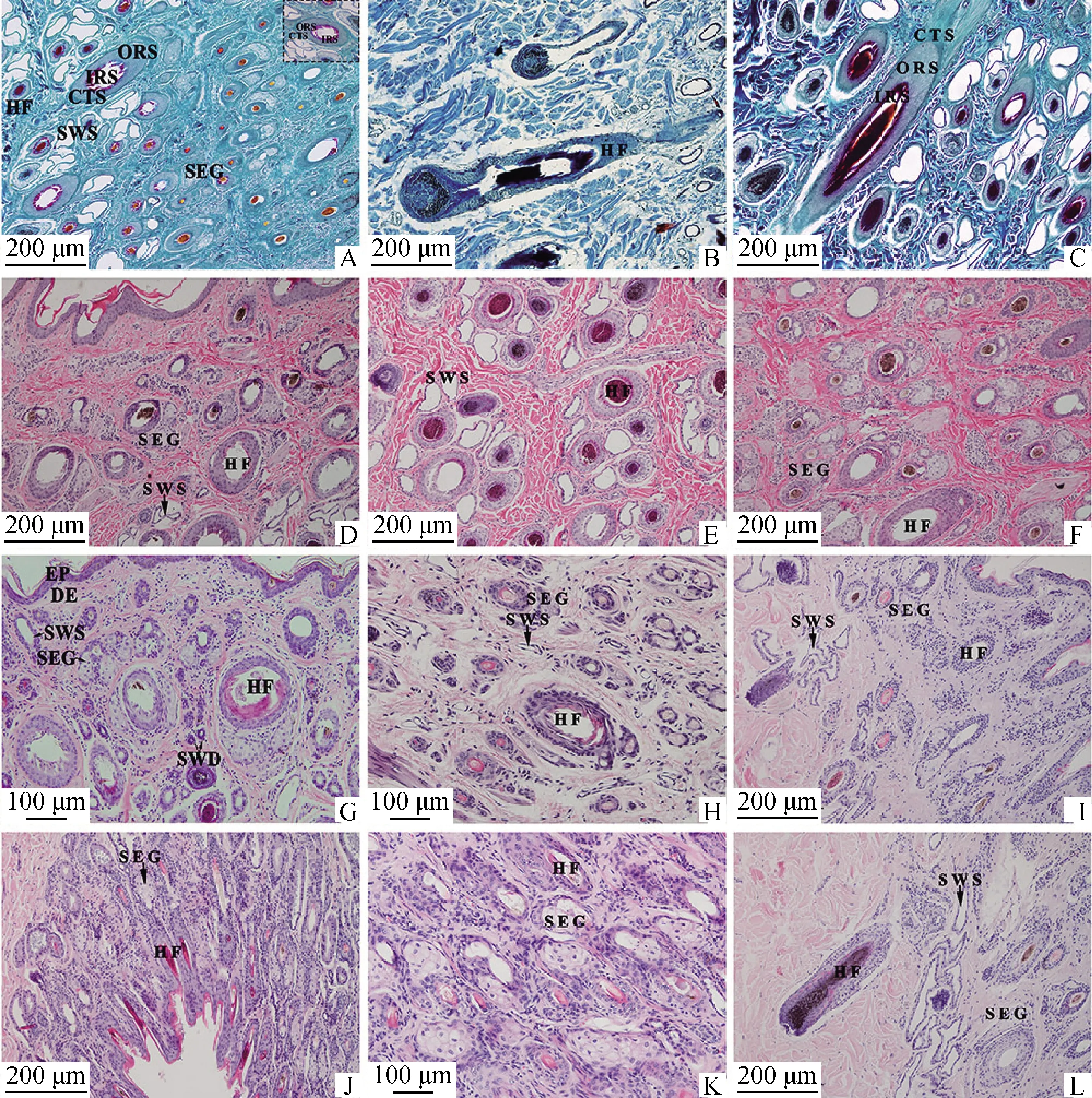
A.腹部皮肤纵切,Sacpic染色,100×;B.背部皮肤纵切,Sacpic染色,100×;C.胸部皮肤纵切,Sacpic染色,100×;D.颈部皮肤纵切,HE染色,100×;E.腹部皮肤横切,HE染色,100×;F.胸部皮肤纵切,HE染色,100×;G.背部皮肤纵切,HE染色,200×;H.小腿部皮肤横切,HE染色,200×;I.腋下皮肤纵切,HE染色,100×;J.阴囊皮肤纵切,HE染色,100×;K.阴囊皮肤纵切,HE染色,200×;L.腋下皮肤纵切,HE染色,100×。EP.表皮;DE.真皮;HF.毛囊;IRS.内根鞘;ORS.外根鞘;CTS.结缔组织鞘;SWS.汗腺的分泌部;SWD.汗腺的导管部;SEG.皮脂腺
2.1.2 不同部位皮肤毛囊的数量 幼年牦牛毛囊的数量从腹部、背部、胸部、小腿部、颈部、腋下及阴囊依次递减,且部位间差异显著(P<0.05)(表2)。
表2 幼年牦牛不同部位皮肤毛囊的数量
2.2 qRT-PCR检测TGF-β2及HIF-1α基因的表达
采用qRT-PCR对TGF-β2及HIF-1α基因的表达进行定量研究,β-actin(图2A)、TGF-β2(图2B)及HIF-1α(图2C)基因扩增产物大小分别为174、98和82 bp,各个基因的扩增产物大小与预期片段大小相符,引物特异性强,可用于后续qRT-PCR试验。实时荧光定量结果显示,TGF-β2在阴囊皮肤和腋下皮肤的基因转录水平显著高于背部皮肤和腹部皮肤(P<0.05)(图2D)。HIF-1α在腹部皮肤的基因转录水平显著高于其他三个部位(P<0.05)(图2E)。
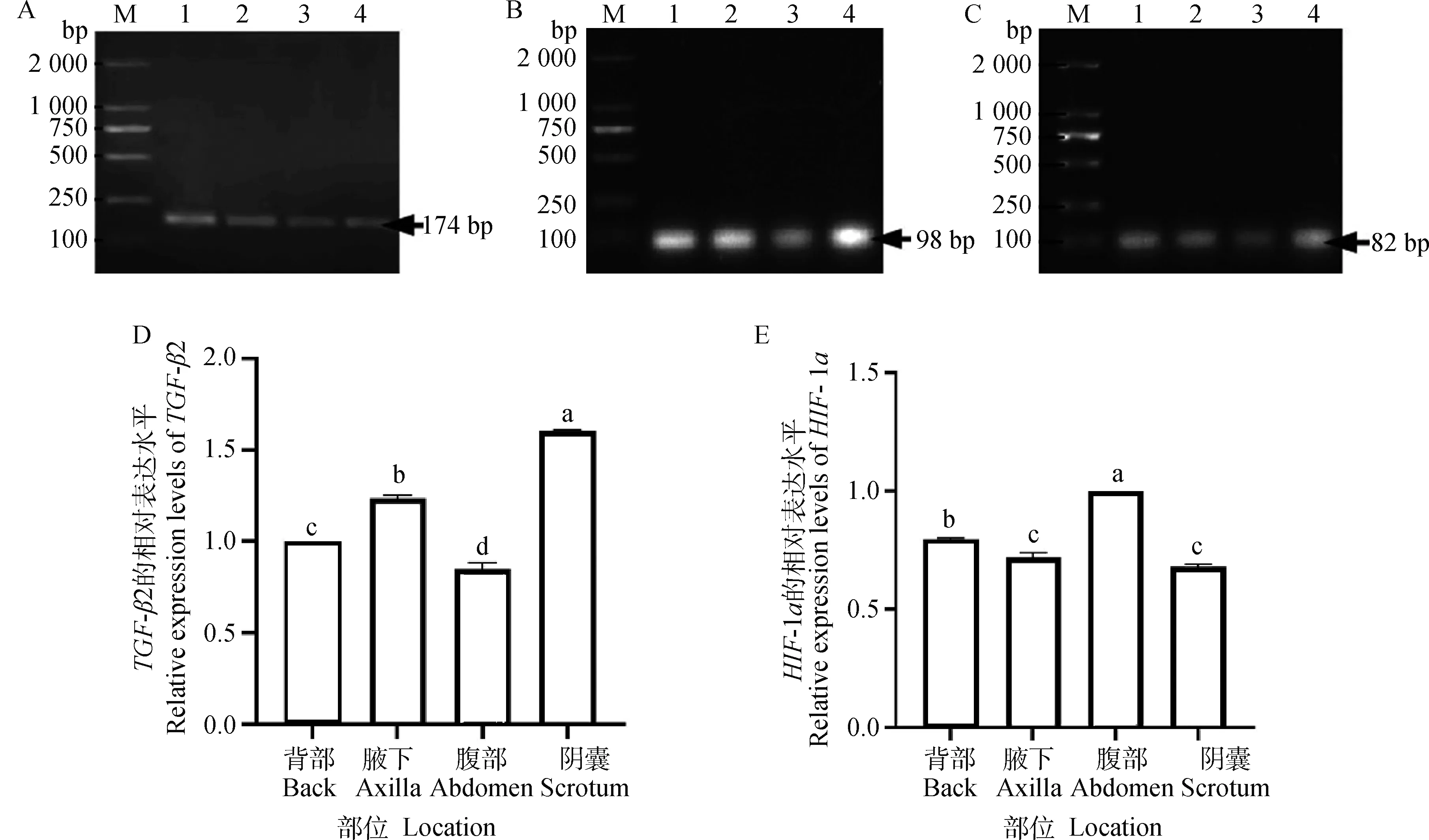
A~C.β-actin、TGF-β2及HIF-1α基因扩增产物;D~E:TGF-β2及HIF-1α基因在幼年牦牛不同部位中的表达;M.DNA 相对分子质量标准;1.背部;2.腋下;3.腹部;4.阴囊;不同字母表示差异显著(P<0.05)
2.3 Western blot检测TGF-β2及HIF-1α蛋白的表达
2.3.1 TGF-β2在幼年牦牛多毛皮肤和少毛皮肤内的蛋白表达检测 Western blot结果显示,TGF-β2在幼年牦牛多毛皮肤(背部和腹部)及少毛皮肤(腋下和阴囊)中均有表达,在阴囊、腋下、腹部及背部中的表达依次呈递减趋势,且各部位之间差异显著(P<0.05)(图3B)。

A.Western blot结果;B.TGF-β2蛋白的相对表达;不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)
2.3.2 HIF-1α在幼年牦牛多毛皮肤和少毛皮肤内的蛋白表达检测 Western blot结果显示,TGF-β2在幼年牦牛多毛皮肤(背部和腹部)及少毛皮肤(腋下和阴囊)中均有表达,腹部表达量显著高于其他三个部位(P<0.05)(图4B)。
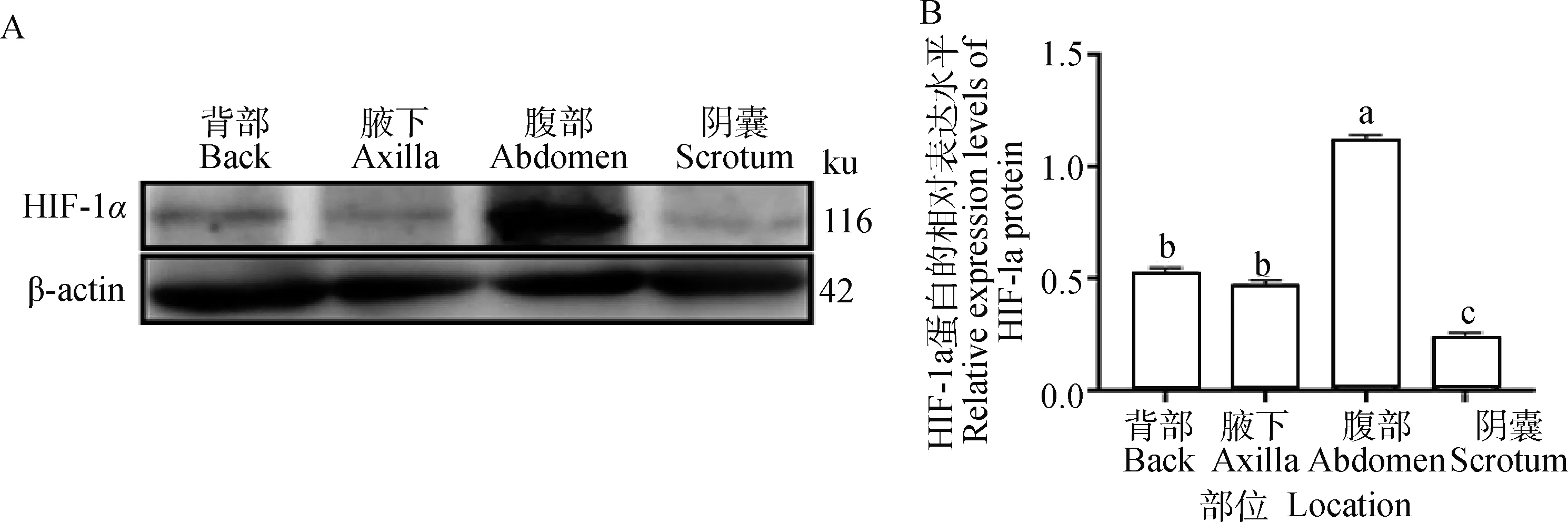
A.Western blot结果;B.HIF-1α蛋白的相对表达;不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)
2.4 免疫组织化学法对TGF-β2及HIF-1α表达部位进行定位
免疫组织化学结果显示,TGF-β2在背部皮肤和腋下皮肤呈强阳性表达,而在腹部皮肤和阴囊皮肤呈弱阳性表达。TGF-β2在皮肤的不同部位表达相似,主要表达在表皮层、毛囊外根鞘、皮脂腺及汗腺(图5A1~D2)。HIF-1α表达部位基本相似,主要表达在表皮层、毛囊内根鞘、毛囊外根鞘、皮脂腺及汗腺(图5A3~D4)。
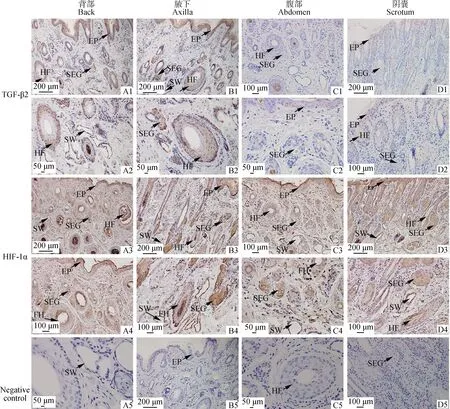
A1.背部皮肤纵切,100×;A2.背部皮肤纵切,400×;A3.背部皮肤纵切,100×;A4.背部皮肤纵切,200×;A5.背部皮肤纵切,阴性对照,400×;B1.腋下皮肤纵切,100×;B2.腋下皮肤纵切,400×;B3.腋下皮肤纵切,100×;B4.腋下皮肤纵切,200×;B5.腋下皮肤纵切,阴性对照,100×;C1.腹部皮肤纵切,200×;C2.腹部皮肤纵切,400×;C3.腹部皮肤纵切,200×;C4.腹部皮肤纵切,400×;C5.腹部皮肤纵切,阴性对照,400×;D1.阴囊皮肤纵切,100×;D2.阴囊皮肤纵切,200×;D3.阴囊皮肤纵切,100×;D4.阴囊皮肤纵切,200×;D5.阴囊皮肤纵切,阴性对照,200×。EP.表皮;HF.毛囊;SW.汗腺;SEG.皮脂腺
3 讨 论
3.1 不同部位皮肤毛囊的组织结构及数量
本研究发现,幼年牦牛的皮肤毛囊结构松散,毛髓质及内根鞘结构不完整,毛囊处于退行期,成年牦牛毛囊结构完整,结缔组织鞘和外根鞘较厚[10]。HE染色可以分析皮肤整体组织学结构,但毛囊细微结构的内根鞘、外根鞘和结缔组织鞘难以辨析,而Sacpic染色可以清晰地将牦牛毛囊组织学结构展现出来。通过对半岁牦牛的各部位皮肤毛囊计数,幼年牦牛腹部的毛囊数量最多,这与成年牦牛颈部毛囊数量较多的结果不一致,这可能是由于两个部位间皮肤厚度而引起的环境适应性规律变化。研究发现幼年时牦牛的腹部皮肤比颈部皮肤薄,为了抵御严寒的高原环境,腹部需要有更多的毛发来减少热量的散失,当发育为成年牦牛时,牦牛腹部皮肤比颈部皮肤厚,随着对环境的适应,动物机体对自身作出调整,毛囊数目减少[8]。本研究也发现了幼年牦牛的腋下及阴囊部位皮肤中毛囊较为稀疏,导致的原因可能有两种,一是由于腋下部位深,向内凹陷,相对其他部位封闭,容易积聚热量。二是由于腋下部位是大血管和淋巴管流经地,离皮肤近,其内热量易散于此处。阴囊部位毛囊稀疏可能由于体内温度过高,不利于精子发育,睾丸需脱出体外,导致阴囊部位皮薄毛少[25]。
3.2 TGF-β2及HIF-1α在幼年牦牛多毛皮肤和少毛皮肤定位和定量研究
哺乳动物的毛发周期包括3个时期,即生长期、退行期和休止期。脱发是由于多种原因导致毛囊过早进入退行期的结果,比如雄激素[26]、抗癌药物[27]和炎症反应[28]等。退行期细胞凋亡主要发生在毛乳头周围的毛基质细胞和外根鞘的外层细胞[29]。TGF-β超家族能够促进这些细胞的凋亡,从而使得毛囊的退行期提前发生。而TGF-β2可能是TGF-β超家族成员中在牦牛的体内主要发挥作用的因子,且该过程可能通过 TGF-βRⅡ介导途径诱导牦牛毛囊上皮细胞发生凋亡来实现[17]。半岁的幼年牦牛腋下皮肤和阴囊皮肤毛囊数量少,腹部皮肤和背部皮肤毛囊数量多。通过对这4个部位的TGF-β2蛋白和基因检测,作者发现TGF-β2在腋下皮肤和阴囊皮肤的表达量高,在背部和腹部的表达量低。在毛囊较少的部位表达量高,这可能表示,TGF-β2亦可以抑制毛囊生长。
牦牛长期生活在高寒低氧的环境中,低氧诱导因子是牦牛适应低氧环境的重要转录因子。低氧诱导因子作为一种转录因子, 低氧时广泛表达在各组织细胞中, 如肾、肝、肺、脑、心等和许多细胞系, 它和低氧反应有关的基因中的低氧反应元件(HRE)上的HIF-1结合位点结合, 介导低氧反应[30]。在恶性肿瘤增长的过程中,其内部容易形成缺氧的状态,肿瘤细胞适应缺氧环境的策略有两种,一种是提高糖酵解速率;另一种是血管的再生,增加输氧能力。HIF-lα可以通过增强靶基因如促红细胞生成素(EPO)、血管内皮生长因子(VEGF)及糖酵解酶等基因转录来刺激血管新生[31]。在用去铁草酰胺(DFO)处理的真皮乳头细胞中,HIF-1α的稳定性增加,去铁氧胺是一种促进HIF-1α稳定的化学羟化酶抑制剂[32]。通过促进糖酵解来稳定HIF-1α可以减少氧化应激并促进毛发生长。在对成年牦牛皮肤中HIF-lα进行研究的基础上[33],本试验对背部、腋下、腹部及阴囊皮肤的HIF-1α蛋白和基因的表达量检测发现,HIF-1α在腹部表达量比其他三个部位高,而腹部属于多毛皮肤,这和预期试验结果相一致。说明HIF-1α可能具有促进毛囊生长的作用。
4 结 论
幼年牦牛各部位皮肤组织学结构基本相似,毛囊处于退行期。腹部毛囊数量最多,背部次之,阴囊最少。TGF-β2和HIF-1α在不同部位皮肤中的表达水平存在显著差异,TGF-β2在少毛皮肤中相对表达量较高,而HIF-1α在多毛皮肤中相对表达量较高,推测TGF-β2和HIF-1α在毛囊生长中发挥重要作用。
