18F-FDG PET/MRI评估宫颈癌大小、分化程度、肌层浸润深度和周围组织受累
2021-11-24刘红红刘家金王瑞民徐白萱姚树林
刘红红,刘家金,王瑞民,徐白萱,姚树林
(中国人民解放军总医院第一医学中心核医学科,北京 100853)
宫颈癌是女性生殖系统常见恶性肿瘤,每年全球新增约530 000例[1],常于40~60岁发病,近年呈年轻化趋势;病理类型多为鳞癌[2]。宫颈癌预后及患者生存率与年龄、国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)分期、病灶大小、分化程度及淋巴结转移情况均明显相关[3]。MRI可显示宫颈癌病灶大小及范围,评估宫颈癌分期;MRI最小表观弥散系数(the minimum apparent diffusion coefficient, ADCmin)和PET最大标准摄取值(the maximum standard uptake value, SUVmax)可预测肿瘤分级及危险分层[4-6]。本研究观察18F-FDG PET/MRI所示病灶SUVmax和ADCmin评估宫颈癌病灶大小、分化程度及周围组织受累的价值。
1 资料与方法
1.1 研究对象 回顾性分析2016年4月—2019年12月45例于中国人民解放军总医院第一医学中心接受PET/MR检查的宫颈癌患者,年龄29~71岁,平均(50.0±11.2)岁;36例鳞癌,9例腺癌;根据术后病理结果分为中-高分化组和低分化组,病灶分化程度不一时,以最低分化程度为准:中-高分化组20例,年龄30~71岁,平均(48.9±10.1)岁;低分化组25例,年龄29~71岁,平均(51.0±12.1)岁。纳入标准:①经术后病理证实宫颈癌;②术前未接受抗肿瘤治疗;③无其他恶性肿瘤病史;④于PET/MR检查后2周内接受手术治疗;⑤图像清晰。检查前患者均签署知情同意书。
1.2 仪器与方法 检查前嘱患者空腹>6 h,使其空腹血糖<11.1 mmol/L;经静脉注射18F-FDG(Sumitomo HM-20 Cyclotron)2.22~4.44 MBq/kg(放射化学纯度>95%)后,嘱其静卧50~60 min。采用Siemens Biograph mMR PET/MR扫描仪,同时行PET和MR扫描,范围为颅顶至股骨上段水平;PET每床位采集4 min,采用迭代算法加点扩散函数校正重建,3次迭代,21个子集,高斯滤波半高宽4 mm,散射校正。MR参数:用于PET衰减校正的Dixon序列,TR 3.6 ms, TE1 1.23 ms, TE2 2.46 ms,FA 10°,层数128,FOV 500 mm×400 mm,体素大小4.1 mm×2.6 mm×3.1 mm,采集时间19 s;轴位3D容积呼吸保持T1W,TR 4.82 ms,TE 2.46 ms,FA 10°,层数64,FOV 420 mm×315 mm,体素大小1.8 mm×1.3 mm×3.0 mm,采集时间17 s;轴位脂肪抑制T2W快速自旋回波序列,TR 3 000 ms,TE 102 ms,FA 80°,层数30,FOV 400 mm×300 mm,体素大小1.3 mm×1.3 mm×5.5 mm,NEX 2,采集时间1 min 48 s;轴位弥散加权成像,TR 3 800 ms,TE 87 ms,层数32,FOV 400 mm×300 mm,体素大小3.1 mm×3.1 mm×5.5 mm,NEX 4,b值为50、800 s/mm2,采集时间1 min 42 s;盆腔矢状位脂肪抑制T2W快速自旋回波序列,TR 4 000 ms,TE 84 ms,FA 140°,层数25,FOV 250 mm×250 mm,体素大小1.0 mm×0.8 mm×3.0 mm,NEX 2,采集时间1 min 18 s。
1.3 图像分析 由分别具有3年和5年以上工作经验的核医学科医师分析图像。于轴位T2WI显示宫颈癌最大层面测量病灶长径及短径,并计算平均径:平均径=(长经+短径)/2。于Siemens SyngoMMWP Software(VE40A)工作站融合PET图与ADC图,并于宫颈癌病灶显像剂最浓和/或ADC信号最低处勾画直径1 cm ROI,自动计算得出SUVmax及ADCmin。以T2WI评估宫颈癌肌层浸润深度及子宫体、子宫旁脂肪组织、阴道、附件、膀胱和直肠受累情况。
1.4 统计学分析 采用SPSS 21.0统计分析软件。以±s表示符合正态分布的计量资料,采用独立样本t检验进行组间比较。以线性回归行相关分析,|r|>0.8为高度相关,0.5<|r|≤0.8为中度相关,0.3<|r|≤0.5为低度相关,|r|≤0.3为无明显相关性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 45例宫颈癌平均径7.00~62.10 mm,平均(27.67±11.53)mm;中-高分化组病灶平均径与低分化组差异无统计学意义(P>0.05),见表1。
病理结果显示13例宫颈癌肌层浸润深度≤1/2肌层、32例浸润>1/2肌层。MRI显示15例宫颈癌肌层浸润深度≤1/2肌层、其中11例与病理结果一致,30例浸润>1/2肌层、其中28例与病理结果一致;MRI与病理符合率为86.67%(39/45)。
病理结果显示宫颈癌累及子宫体10例、累及子宫旁脂肪组织3例、累及阴道8例、累及附件3例;MRI检出率分别为80.00%(8/10)、66.67%(2/3)、75.00%(6/8)和66.67%(2/3)。
2.2 SUVmax线性回归分析显示宫颈癌SUVmax与病灶平均径呈中度正相关(r=0.536,P<0.01,图1)。45例宫颈癌SUVmax为3.29~25.62,平均(10.56±5.12);中-高分化组为(10.61±5.43),低分化组SUVmax为(10.53±5.10),二者差异无统计学意义(P>0.05)。见表1、图2A、2B、3A和3B。
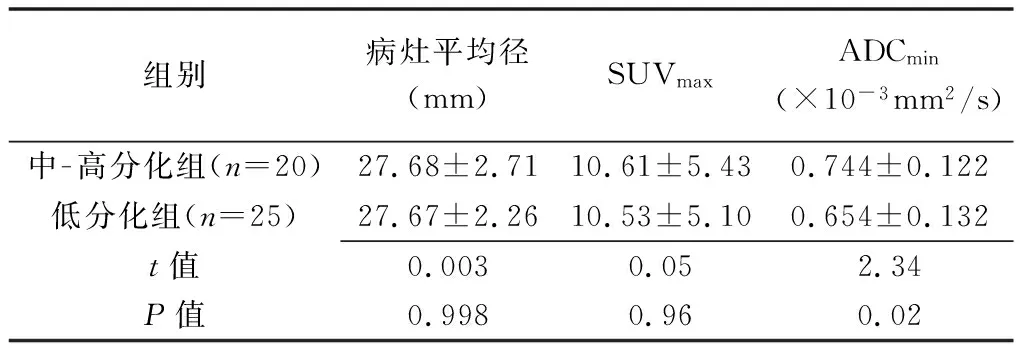
表1 中-高分化组与低分化组宫颈癌SUVmax、ADCmin及病灶平均径比较
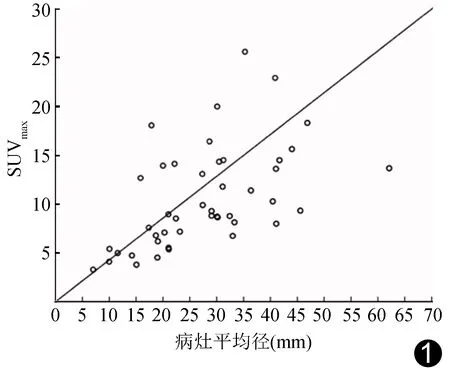
图1 宫颈癌SUVmax与病灶平均径的线性回归分析图
2.3 ADCmin线性回归分析显示宫颈癌ADCmin与病灶平均径呈中度负相关(r=-0.525,P<0.01,图4)。45例宫颈癌ADCmin为0.370~0.980×10-3mm2/s,平均(0.694±0.134)×10-3mm2/s;中-高分化组为(0.744±0.122)×10-3mm2/s,明显大于低分化组的(0.654±0.132)×10-3mm2/s(P<0.05)。见表1、图2C、3C。
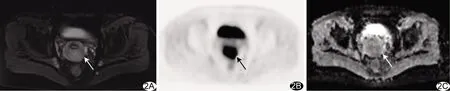
图2 患者女,57岁,中分化宫颈癌 A.T2WI示宫颈病灶呈稍高信号,平均径28.65 mm;B.PET图示病灶SUVmax为16.42;C.ADC图示病灶ADCmin为0.815×10-3 mm2/s
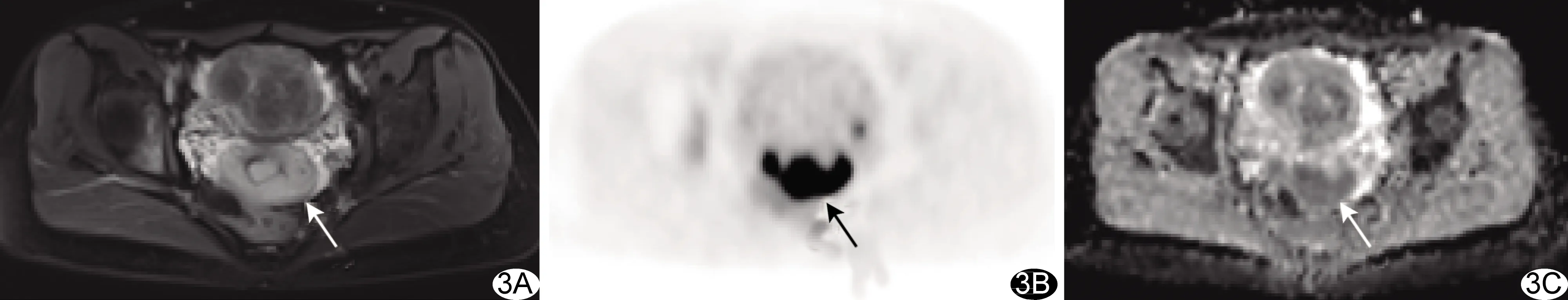
图3 患者女,49岁,低分化宫颈癌 A.T2WI示宫颈病灶呈稍高信号,平均径为41.02 mm;B.PET图示病灶SUVmax为13.62;C.ADC图示病灶ADCmin为0.563×10-3 mm2/s
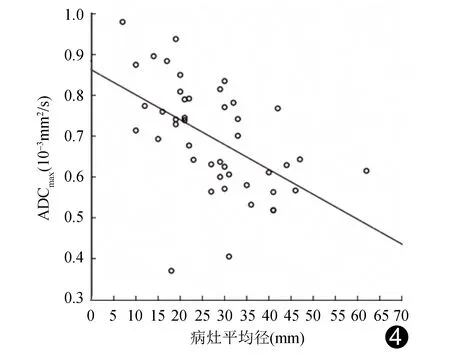
图4 宫颈癌ADCmin与病灶平均径的线性回归分析图
3 讨论
宫颈癌是女性常见生殖系统恶性肿瘤,术前多采用阴道镜活检评估肿瘤分级,但对部分患者难以实施。MRI软组织对比度高,且无辐射,其中DWI可评估细胞密度,而动态增强MRI可评估组织灌注情况;基于DWI的ADC有助于评估肿瘤范围、病理类型、分化程度及预测预后等[5,7]。近年来,18F-FDG PET逐渐用于检查女性生殖系统恶性肿瘤,可获取肿瘤的多种信息,包括原发灶位置、大小及范围等,具有良好的诊断价值[5]。
有学者[8]发现FDG摄取程度与肿瘤细胞数量及密度、肿瘤大小及分化程度有关。鲁雪红等[9]认为宫颈癌病灶大小与ADC呈负相关。本研究结果显示宫颈癌病灶平均径与SUVmax呈中度正相关,与ADCmin呈中度负相关。然而,亦有学者[10]认为SUVmax和ADCmin均与宫颈癌病灶大小无明显相关性。
肖金海等[11]认为宫颈癌SUVmax与其分化程度呈负相关,即分化程度越高则SUVmax越低,主要原因在于肿瘤细胞分化程度越高,与其来源的组织细胞生物学特征越接近,则恶性程度越低,对葡萄糖需求量越少,故SUVmax越小。同时,有学者[5,12]发现宫颈癌分化程度与ADC呈显著正相关,可能由于肿瘤细胞分化程度越低,细胞增殖速度越快,导致细胞密度增大而细胞外间隙减小,使水分子运动受限,故ADC降低,反之则ADC越高。然而本研究结果显示中-高分化组与低分化组SUVmax差异无统计学意义,但中-高分化组ADCmin显著高于低分化组。
本研究存在的局限性:①样本量小;②中-高分化组20例中,仅2例高分化宫颈癌,样本分布不均;③纳入病例包括9例宫颈腺癌,可能对结果产生影响。
综上所述,采用18F-FDG PET/MRI观察宫颈癌SUVmax和ADCmin有助于评估病灶大小、分化程度、肌层浸润深度及周围组织受累,尤以ADCmin价值较高。
