关于比较离子浓度的解题方法
2021-11-24管爱国
管爱国
(江苏省大丰高级中学 224100)
一、同一离子在不同溶液中的比较

A.NH4Cl B.NH4HCO3
C.NH4HSO4D.NH4NO3

二、不同离子在同一种溶液里的比较
例2 草酸(H2C2O4)是一种二元弱酸,已知草酸氢钾KHC2O4溶液是酸性的,那么在0.1mol·L-1的草酸氢钾溶液KHC2O4里面,下列说法哪一项是正确的( ).
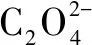
评析解答这类型的题目需要的基础知识1:守恒关系,在解答“比较离子浓度”这类型题目中,电荷守恒和物料守恒是必需的基础知识之一.
电荷守恒也叫电性守恒:以溶液的电中性原则为解题依据,溶液里面所含的阴离子所带的负电荷总数一定等于溶液中阳离子所带的正电荷的总数,借此就可以列出一个关于溶液里所含的阴、阳离子浓度之间的数学关系式.
物料守恒也叫原子守恒:指的是某一个分子或者离子在溶液中的各种存在形式的浓度的和与这一分子或者离子的初始浓度相等.
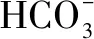
三、比较在混合溶液里面的各种离子
例3 在常温常压下,把物质的量浓度都等于0.01mol·L-1的盐酸溶液和氨水等体积混合在一起,下列选项中溶液里面的离子浓度大小的关系表达正确的是( ).
剖析首先分析这道题给出的信息,通过分析可知这道题目是2种溶液相混合的溶液,因此需要先判断这两种溶液是否会发生反应,该反应的目的是弄明白溶液的组成有哪些.假如2种溶液混合以后会发生反应,那么就需要依据题目给出的信息判断会如何发生反应、反应以后会产生什么物质、溶液是否过量,然后确定发生反应以后的溶液的组成是什么,再进一步分析比较离子的浓度大小.

评析上面的混合溶液发生反应以后会得到由NH3·H2O以及NH4Cl组成的混合溶液,也就是盐和碱,需要确定一个主次才能知道为什么混合液显碱性.
一般的情况下,若是由弱碱及其强酸盐、弱酸及其强碱盐组成的混合的体系,都遵循水解程度小于电离程度的原则思考.如果有特别的说明不遵循此原则,那么就采用另外的方法探究.
总而言之,在解答这类题目的过程中,如果选项中有“=”,那么就需要从2个守恒关系的方面思考;如果守恒的关系式里面只出现了离子,那么就需要考虑电荷守恒的关系;如果守恒的关系式里面既出现了分子又出现了离子,那么就需要从物料守恒或者电子守恒和物料守恒思考.
