守恒法是高中化学计算的“利器”
——以硝酸和金属反应的计算为例
2021-11-24沈绍波
沈绍波
(福建省浦城第一中学 353400)
守恒,现代汉语词典中解释为(数值)保持恒定.化学中的守恒指事物在运动变化过程中,物质和能量总是守恒的.具体表现在反应前后元素原子的种类和数目不变、电荷总数不变、得失电子相等……化学守恒法关注变化的始态和终态,不纠结过程细节,利用不变的量建立物质之间的比例关系,化繁为简,从而达到快速解题的目的.守恒法是中学化学既常见又经典的解题方法,是各种解题方法的基础,穿插在其它方法中同时使用,是高中化学计算的“利器”.
在高中化学计算题中,常考的守恒有以下几种.
一、元素守恒
元素守恒即化学反应前后各元素的种类不变,各元素的原子个数不变.原子守恒的涵义与元素守恒相似,即反应前后原子的种类和数目都不变,这也是反应前后质量不变(质量守恒)的根本原因.因此,也可以认为元素守恒包含了原子守恒,是质量守恒的根本原因.计算时经常通过找出关联物质的对应关系,列出关系式,列比例式求解.
(1)足量稀硝酸(以铜为例):
n(反应HNO3)=n(被还原HNO3)+n(未被还原HNO3)=n(NO) +2n(Cu2+)
(2)足量浓硝酸(以铜为例):
n(反应HNO3)=n(被还原HNO3)+n(未被还原HNO3)=n(NO2) +2n(Cu2+)
(3)一定量浓硝酸(以铜为例):
n(反应HNO3)=n(被还原HNO3)+n(未被还原HNO3)=n(NO2) +n(NO)+2n(Cu2+)
(4)未知浓度的硝酸(以铜为例):
n(反应HNO3)=n(被还原HNO3)+n(未被还原HNO3)=n(气体)+2n(Cu2+)
例119.2 g铜跟适量的浓硝酸反应,铜全部反应后,共收集到气体11.2L(标准状况),反应消耗的HNO3的物质的量是( ).
A.0.5mol B.0.8mol
C.1.1mol D.1.2mol
解析此题很容易掉入陷阱,认为气体只有NO2.铜跟浓硝酸反应过程分为两步:第一步是铜和浓硝酸反应产生NO2,第二步是浓硝酸反应过程中慢慢变稀,铜和稀硝酸反应产生NO,若用传统方法写出两个化学方程式,列出方程式求解很麻烦.若利用原子守恒n(反应HNO3)=n(被还原HNO3)+n(未被还原HNO3)=n(NO2)+n(NO)+2n(Cu2+)即可化繁为简,很快得出答案.
n(NO2) +n(NO)=11.4L/22.4L·mol-1=0.5 mol
n(Cu2+)=n(Cu)=19.2 g/64g ·mol-1=0.3mol
n(反应HNO3)=0.5+0.3×2=1.1 mol
故答案选C.
二、电子守恒
电子守恒即指在氧化还原反应中,氧化剂得到的电子数等于还原剂失去的电子数.电子守恒包括化合价守恒,即氧化剂化合价降低的总数等于还原剂化合价升高的总数.两者的基本性质是一样的.应用于氧化还原反应的计算,可求出参与氧化还原反应的物质的物质的量和质量等,也经常用于电解池中的计算.
硝酸与金属反应属于氧化还原反应,金属失去的电子数等于氮原子得到的电子数.
例2将14 g某铜银合金与足量的bmol·L-1的HNO3充分反应后,放出的气体与标准状况下的氧气1.12L混合,通入水中恰好完全被吸收,此合金铜的质量是( ).
A.3.2 g B.4.8 g C.6.4 g D.9.6 g
解析铜银都被硝酸氧化,因为浓度未知,生成气体未知,但是与氧气混合再通入水中完全吸收生成的一定是硝酸,故氧气得到的电子数等于铜银合金失去的电子数.
n(O2)=1.12L/22.4L ·mol-1=0.05 mol
根据质量守恒列方程:
n(Cu)×64+n(Ag)×108=14
根据电子守恒列方程:
n(Cu)×2+n(Ag)×1=0.05×4
列方程组解得:
n(Cu)=0.05 mol
n(Ag)=0.1 mol
m(Cu)=0.025×64=3.2g
故答案选A.
三、电荷守恒
电荷守恒即对任一溶液而言,溶液是电中性的,即阳离子所带正电荷等于阴离子所带负电荷,离子方程式两边离子所带电荷数相等.在计算时列出相应的等式求解,也可用于离子方程式的配平.
硝酸与金属反应溶液中存在电荷守恒:
若溶液呈酸性,n(OH-) 较少,忽略不计,则
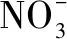
A.0.5amol B.(a+0.2)mol
C.2amol D.(0.2-a)mol
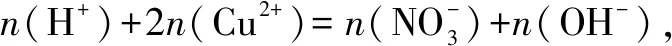
故答案选B.
总之,守恒法是高中化学计算的“利器”,在解题时从大局出发,善于观察,化繁为简,巧妙答题,能降低计算的难度,提高计算的速度.因此,需要学生在解题过程中熟练掌握,才能在关键时候快速准确求解,提高解题效率.
