生物素-亲和素增敏抑制型SPR等离子共振传感器检测牛奶中链霉素
2021-11-22王敏思朱文博
王敏思,柳 双,朱文博,宋 洋
(天津师范大学 天津市动植物抗性重点实验室 天津 300387)
链霉素(Streptomycin,STR)是一种氨基酸糖苷类抗生素药物[1],对结核杆菌和许多革兰阴性杆菌有较强的抗菌作用[2],是目前我国畜牧业和水产业常用的药物之一[3]。在奶牛养殖业中,链霉素被大量、频繁地超剂量用于奶牛乳腺炎的治疗,由此导致牛奶中高浓度的链霉素药物滞留和蓄积[4],并以食物链方式进入人体,危害人体健康[5]。链霉素有严重的肾毒性和耳毒性,长期摄入有链霉素残留的食物会造成肾脏及前庭功能和耳蜗神经永久性损伤[6]。食物中残留的链霉素可能会造成过敏反应,甚至引起休克[7]。此外,链霉素还具有潜在的致畸作用[8]。临床上,链霉素逐渐被其它类似药物所取代,然而,在畜牧业和水产业仍在继续使用[9],因此建立准确可靠、简便的检测方法很有必要。
目前,链霉素在我国及日本等多个国家(地区)均允许使用,鉴于其对人体的危害性,世界各国对其残留限量均有规定,其中欧盟国家及日本肯定列表中均规定牛奶中链霉素的最高残留限量为200 μg/kg[10-11],加拿大为125 μg/kg[12]。国内外定量链霉素残留的检测方法包括传统的高效液相色谱法(HPLC)[13]、液相色谱-串联质谱法(HPLCMS)[14-17]等仪器检测方法,以及酶联免疫法(ELISA)[18]、适配体传感器(Aptamer sensor,AS)[19]、试纸条(Test strip,TS)[20]等方法。HPLC-MS 可定性、定量分析,然而昂贵的仪器和专业的操作程序不利于大量样品以及现场检测。ELISA 是成熟的快速检测手段,广泛用于食源性危害物的快速检测。AS 建立所需时间较长,保存时间短。TS 检测时间短,准确度低。表1为近年来牛奶中链霉素残留的主要检测方法。

表1 本研究与以往链霉素检测方法比对Table 1 Comparison of the study with previous streptomycin detection methods
表面等离子体共振传感器(Surface plasmon resonance,SPR)是一种建立在免疫学基础上,利用物理光学现象的检测方法。由于SPR 对小分子物质的相应信号较低和非特异性吸附的影响,局限了其在食品安全领域的发展。基于生物素-亲和素(Biotin-avidin system,BAS)的亲和特性与SPR 结合[21],可以提高抗原抗体的亲和性,从而提高相应信号和检测的准确性[22-23]。与传统SPR 相比,更具优势。本研究将活化酯法合成的生物素化抗原结合在偶联链霉亲和素的SA 芯片,优化了抗体浓度、再生液等条件,建立BAS-SPR 链霉素残留高效检测方法,对20 例牛奶样品进行测定,该方法较既往的快速检测方法,灵敏、准确且可再生多次[24-25]。基于BAS-SPR 的信号放大策略建立的快速检测方法可为实际样品中STR 的检测提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
硫酸链霉素、庆大霉素、卡那霉素、氯霉素、硫酸新霉素、双氢链霉素、妥布霉素、(+)-生物素N-羟基琥珀酰亚胺(BNHS,≥98%),美国Sigma Aldrich 公司;10 mmol/L 磷酸盐缓冲液(PBS)缓冲液、不同pH 值的甘氨酸(Gly)-HCl(10 mmol/L)、50 mmol/L 氢氧化钠(NaOH)溶液、500 mmol/L 氯化钠(NaCl)溶液、碳酸钠(Na2CO3)缓冲溶液、二甲基甲酰胺(DMF),Harmonia Testing Technology Ltd.公司(中国天津);牛奶样品,天津师范大学超市;抗链霉素抗体(STR-Ab)6 mg/mL,天津师范大学动植物抗性重点实验室。
BIAcore 3000 仪器,美国GE 公司;SA 芯片,美国Biosensing Instrument 公司;HPLC-MS,美国Thermofinnegan 公司。
1.2 试验方法
1.2.1 BNHS-STR-OVA 的制备 直接交联法[26]合成的STR-OVA,用碳酸钠缓冲溶液(pH 9.6)稀释为1 mg/mL,与50 μL 在DMF 中的20 mg/mL 的BNHS 混合,将该反应混合物室温搅拌4 h,PBS 在4 ℃透析3 d,该抗原BNHS-STR-OVA 的质量浓度为0.8 mg/mL,于4 ℃储存备用。
1.2.2 BNHS-STR-OVA 在SA 芯片表面的固定试验采用SA 芯片进行固定化。生物素化抗原与芯片上的链霉亲和素结合即将抗原稳定的固定在芯片表面。10 mmol/L,pH 7.0 的PBS 作为整个反应中的流动相,流速为10 μL/min,对芯片表面进行冲洗,固定抗原时,流速5 μL/min,注射时间30 s。
1.2.3 测定过程 依据免疫抑制原理,将构建BAS-SPR 免疫传感器应用于目标物STR 的定量分析。一系列质量浓度的STR-Ab(6.0,7.5,10.0,15.0,30.0,60.0,80.0,100.0 mg/L)分别注入仪器中,流速30 μL/min,注射时间6 min,解离时间180 s,优化最佳抗体质量浓度。每个质量浓度重复3 次。PBS 代替抗体,作为对照。
将90 μL 一系列质量浓度的STR-PBS 溶液(0.1,0.5,1.0,2.0,4.0,8.0,16.0,64.0 μg/L)分别 与抗体等体积混合后注入仪器中,反应时间300 s。每个质量浓度注射3 次,根据响应值的变化,以标品质量浓度的对数为横坐标,抑制率为纵坐标,绘制相应的SPR 标准曲线图。

式中,B0——STR 质量浓度为0 的响应值;Bx——STR 质量浓度为x的响应值。
1.2.4 优化再生液 对再生液进行优化,选择pH 2.0 的甘氨酸-盐酸(Gly-HCl)、pH 2.2 的Gly-HCl、500 mmol/L 的NaCl 溶液、2.5 mmol/L 的NaOH溶液4 种再生液进行优化,流速10 μL/min,观察并比较反复测定过程中SPR 响应值的变化,并对结果进行比较,最后选择最佳的再生液。
1.2.5 方法特异性评价 本试验选择的STR 结构类似物为双氢链霉素、庆大霉素、卡那霉素、氯霉素、硫酸新霉素和妥布霉素。所有结构类似物用PBS 稀释至500,100,20,5,1,0.2 μg/L。用IC50计算交叉反应性百分比(CR%):

式中,IC50——测试化合物的浓度,其中相应的吸光度等于最大吸光度的一半。
1.2.6 样品前处理及添加回收试验 SPR 法:取5 mL 牛奶样品于10 mL 离心管中,8 000 r/min 离心10 min,取上清液用冰醋酸调节pH 值至4.6,振荡混匀后5 000 r/min 离心5 min,取上清液。处理后的样品液体储存于棕色小瓶中-20 ℃备用,用缓冲液稀释后过0.22 μm 水系滤膜,即可进行检测。
HPLC-MS 法:参考标准方法GB/T 22969-2008[27],经羧酸型固相萃取柱后用甲酸和庚烷磺酸钠溶液定容至2.0 mL,混匀后过0.20 μm 滤膜供液相色谱串联质谱测定。于牛奶样品中添加STR 标准品,最终质量浓度为20,40,80 μg/L,分别通过SPR 和HPLC-MS 测定回收率。
2 结果与分析
2.1 SPR 芯片表面的修饰及抗原固定
SPR 试验常使用葡聚糖修饰的CM5 芯片,或是便于自组装的裸金芯片。这两种芯片均需要对绑定探针进行预富集和活化,过程较为繁琐。本试验采用芯片修饰有链霉亲和素的SA 芯片,利用其与生物素(BNHS)的高亲和性,在SPR 芯片表面形成生物素-亲和素-抗原的探针。图1是BASSPR 传感器敏感探针制备示意图。

图1 抑制型BAS-SPR 传感器探针制备原理Fig.1 Preparation principle of inhibitory BAS-SPR sensor probe
图2为BNHS-STR-OVA 在SA 芯片表面结合情况。上样量2 μg。第1 次上样,响应值显著上升,第2 次上样,响应值上升幅度较小,第3 次上样,响应值无明显变化,说明芯片表面SA 的结合位点基本达到饱和状态,停止上样。BNHS-STROVA 共注射6 μg,因此选择6 μg 为BNHS-STROVA 的最佳固定量,BNHS-STR-OVA 与芯片表面SA 的结合响应值为1 435.4 RU。

图2 芯片表面BNHS-STR-OVA 的结合Fig.2 Binding of BNHS-STR-OVA on the chip surface
2.2 STR-Ab 质量浓度优化
抗体浓度在很大程度上影响了免疫测定的稳定性和灵敏度,是免疫分析方法中需要优化的一个重要参数。将STR-Ab(6.0,7.5,10.0,15.0,30.0,60.0,80.0,100.0 mg/L)分别与结合在芯片表面的BNHS-STR-OVA 进行结合,结果如图3所示,随着抗体质量浓度的增加,响应值不断升高;60 mg/L 和80 mg/L 抗体质量浓度的响应值分别为148.3 RU 和152.6 RU,几乎接近,说明抗原与抗体的结合基本达到饱和状态;这2 个质量浓度3 次进样响应值的变异系数(Coefficient of variation,CV%)分别为5.06,6.53。这可能是由于高质量浓度的抗体会降低再生效果,造成检测的稳定性降低。因此,为节约抗体,提高稳定性,确定抗体添加质量浓度为60 mg/mL。

图3 不同质量浓度的抗体与BNHS-STR-OVA 结合Fig.3 Binding of different concentrations of antibodies to BNHS-STR-OVA
2.3 再生条件的确定
再生液需要洗去结合的抗体,并保留结合在芯片上的抗原稳定,适当的再生溶液决定了试验的稳定性及芯片的使用寿命。链霉素碱性条件下不稳定,为保护芯片上的抗原,试验选择较为温和的再生液进行优化,分别为50 mmol/L NaCl,pH 2.0 Gly-HCl,pH 2.2 Gly-HCl 及2.5 mmol/L NaOH溶液,根据4 次结合反应和基准响应值变化进行再生效果比较。由图4显示的结果表明:50 mmol/L NaCl 溶液不能完全洗去抗体,因此再生时出现基准响应值上升,结合相应值下降;2.5 mmol/L NaOH 溶液再生结果表明,即使低浓度的碱性溶液,也会影响链霉素稳定,从而造成抗原损失;对比pH 2.0 Gly-HCl 和pH 2.2 Gly-HCl 溶液的再生效果,pH 2.2 Gly-HCl 溶液的再生信号稳定性更佳。通过试验可知,采用pH 2.2 Gly-HCl 溶液可使BAS-SPR 敏感膜芯片重复再生90次,表现出良好的稳定性和再生性。

图4 再生液优化结果Fig.4 The results of regenerant optimization
2.4 标准曲线的确定
基于分析物与偶联抗原间的竞争性反应原理,将抗体STR-Ab(60 mg/L)与等体积浓度梯度的STR 混合后注入芯片,BNHS-STR-OVA 分别与质量浓度为0.1,0.5,1.0,2.0,4.0,8.0,16.0,64.0 μg/L 的STR 竞争抗体,根据抗原抗体结合响应值与STR 浓度相关联绘制标准曲线。图5是不同质量浓度STR 与抗原竞争抗体的SPR 结合曲线,由此绘制出STR 的BAS-SPR 标准工作曲线,如图6所示,STR 线性检测范围是0.4~32.0 μg/L,IC50为1.65 μg/L,IC15为0.37 μg/L,检测时间为10 min。
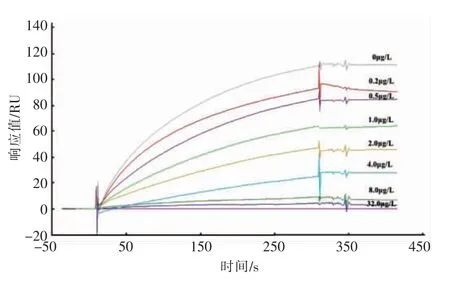
图5 STR 与BNHS-OVA-STR 竞争试验结果Fig.5 Results of competition between STR and BNHS-OVA-STR

图6 链霉素BAS-SPR 传感器检测标准工作曲线Fig.6 Standard curve for BAS-SPR sensor detection of STR
2.5 特异性评价
试验选用了6 种STR 结构及功能类似物分别进行BAS-SPR 测试,测定交叉反应率(CR%)。由表2结果可以看出,该抗体可以特异性的识别链霉素,且与双氢链霉素有极高的交叉反应(98.79%),然而与其它氨基糖苷类和结构类似的抗生素药物的交叉反应率小于0.01%。由于双氢链霉素是链霉素的衍生物,与链霉素仅相差一个基团,与链霉素有相似的生理功能,在国标中也将两者统一计量[28],因此在检测时可作为同一种物质检测。

表2 各化合物与抗体的交叉反应率和IC50 值Table 2 Cross reaction rate and IC50 value of each compound and antibody
2.6 样品检测
2.6.1 样品基质影响及消除 牛奶的基质影响主要包括蛋白质和脂肪。对于包含蛋白质和脂肪的牛奶样品,可以通过简单地离心,稀释和超滤将基质干扰降至最低。取牛奶样品进行处理,将获得的样品提取液经PBS 稀释0,2,4,8,16 倍后的溶液作为STR 标品的稀释液,经BAS-SPR 检测获得的抑制率曲线即为样品的基质曲线,结果如图7所示,样品稀释8 倍获得的基质曲线与校正曲线几乎重合。由此可知,稀释8 倍基本可以消除基质影响。

图7 牛奶样品中基质消除的优化曲线Fig.7 Optimization curve of matrix elimination in milk samples
2.6.2 添加回收试验 在牛奶中添加5.0,20.0,30.0 μg/L 的STR 标准品,通过SPR 和HPLC-MS检测添加回收率。如表3所示,SPR 回收率为96.6%~101.0%,HPLC-MS 回收率为95.6%~99.4%,SPR 相对于HPLC-MS 添加回收率较高。说明SPR 方法准确可靠,对牛奶样品中STR 的检测提供了一种高效、灵敏的检测方法。

表3 SPR、HPLC-MS 法检测STR 的3 个质量浓度水平下样品的回收率(n = 3)Table 3 SPR and HPLC-MS method for the recovery of samples at three levels of STR(n=3)
3 结论
本研究构建了BAS-SPR 增敏抑制型免疫传感器并应用于牛奶中STR 的快速检测。将BNHS-STR-OVA 固定于SA 芯片表面形成BAS-Ag 敏感膜,简化了固定化的活化过程,有效提高了响应值和芯片的稳定性。敏感膜上的抗原作为探针,依据免疫抑制原理,对目标物STR 进行定量分析。经过对固定化条件、抗体浓度、再生液等条件的优化,最终确定:抗体浓度为60 mg/L;固定化缓冲液为pH 7.0 PBS 缓冲液;芯片再生液为pH 2.2 Gly-HCl。得到竞争抑制型BAS-SPR 对STR 的方法检出限(IC15)为0.37 μg/L;灵敏度(IC50)为1.65 μg/L;整个检测过程用时10 min;芯片可重复使用90 次以上。3 个添加量(5,20,30 μg/L)回收率为96.6%~101.0%。该方法具有快速、样品处理方法相对简单,所用时间短、灵敏、检测限低等优点,在大量样品的痕量检测中具有优势。
