PKC/CUGBP1信号通路与强直性肌营养不良骨骼肌病理特征的关系
2021-11-22冯俊强
尹 雪,刘 娜,冯俊强
(大庆龙南医院神经内科,黑龙江 大庆 163000)
强直性肌营养不良(DM)是最常见的致死性单基因疾病之一,根据不同基因重复扩增所致分为DMⅠ型和DMⅡ型,二者都具有常染色体显性遗传和多系统特征,包括强直性肌病、白内障和心脏传导疾病[1-3]。目前该病在临床诊断中易出现误诊、漏诊,因此探究该病的致病机制对于该病的早期精准确诊、治疗具有重要意义。
蛋白激酶C(PKC)是一种在所有类型的细胞中均可表达的相关丝氨酸/苏氨酸激酶。PKC的功能包括基因表达、细胞迁移、增殖、分化和凋亡。此外,PKC还与心力衰竭、糖尿病和帕金森氏病以及炎症和免疫等常见疾病的病理生理过程有关[4]。据报道[5-7],DM是由CUG重复RNA转录引起,导致肌肉盲样的螯合和CUG三联体重复RNA结合蛋白(CUGBP1)的异常表达,并且PKC信号通路在DM中发生过度磷酸化,但是该信号通路的活性与DM骨骼肌纤维的病理特征及CUGBP1表达之间的关系尚未清楚。本研究旨在探究DM骨骼肌纤维病理特征与PKC/CUGBP1信号通路之间的关系。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年2月在大庆龙南医院确诊的DM患者11例(DM组),均为黑龙江省大庆市一个DM罹患家系成员,所有患者均签署知情同意书,均行开放式骨骼肌活检取材。诊断标准:1)中青年开始发病,病程缓慢;2)临床症状为肌强直、无力、萎缩;3)肌电图显示强直电位;4)肌肉病理符合强直性肌营养不良。临床症状:9例DMⅠ型患者最初表现为四肢无力、抓握、抬腿、张口咀嚼、闭眼困难,视力衰退;2例DMⅡ型患者进一步发展出现多系统受累,表现为心脏受累、糖尿病、智力低下、白内障、性功能障碍等。ELISA实验室检测11例患者血清肌酸激酶含量表现显著升高,平均为(323.01±30.12)U·L-1。
选取同期在本院行骨折手术治疗患者11例(正常组),经检查确认均无肌不良症状,骨折手术治疗时行骨骼肌活检取材。
1.2 检测方法
1.2.1 病理学表现
截取肌纤维的横切面,进行组织化学染色(HE、MGT、NSE、NADH-TR、ACP、ATP),在显微镜下用200~400放大倍数观察视野内肌纤维病理变化(包括肌纤维直径及肌纤维萎缩、肌纤维肥大、肌纤维核内移、嗜碱性肌浆块发生情况)。免疫组织化学法观察组织中膜蛋白的变化。
1.2.2 PKCδ、p-PKCδ、CUGBP1蛋白表达水平
运用蛋白免疫印迹法检测肌肉组织中PKC信号通路的关键蛋白PKCδ、p-PKCδ、CUGBP1的表达变化情况。选取病变程度中等适中的肱二头肌肌腹(避免选择过轻或过重萎缩病变的肌肉肌腹,因其所提供的信息可能因病变过轻导致病理进程变化不典型或病变过重导致信息大量丧失无法观察到典型病理改变)→局部浸润麻醉→切开皮肤,暴露深筋膜,切开深筋膜暴露肌肤→孤立、提取直径约1.0 cm 的肌纤维束→置于生理盐水湿纱布上修剪塑形→耦合剂包埋→液氮冷冻→切片机切片,厚度7 μm恒冷切片备用。将备好的各个组织块在无菌条件下充分研磨,用2倍组织体积的无菌水混匀,离心,弃沉淀,取上清。再用RIPA蛋白裂解液(来自北京百奥莱博)处理组织使组织在低温下充分裂解。提取组织中的总蛋白,并使用BCA蛋白定量试剂盒(来自上海生工生物)进行蛋白定量,100 ℃沸水浴变性处理10 min。取变性的蛋白上清液50 μg上样,用SDS-PAGE蛋白电泳分离蛋白。将琼脂胶上的蛋白在4 ℃冰箱中使用湿转法转移至PVDF膜,并用2.5%的脱脂奶粉37 ℃下封闭处理30 min。将1:1000倍稀释的兔抗PKCδ、p-PKCδ、CUGBP1抗体(来自上海艾博抗)浸泡PVDF膜,置于4 ℃冰箱中孵育12 h,结束后取出洗涤3~5次。再次转移至1:500倍稀释的辣根过氧化物酶标记的二抗(来自北京中西华大)溶液中,37 ℃孵育30 min。取出充分清洗,使用ECL显色试剂盒进行显色处理,最后使用Image J分析目的条带的灰度值与GAPDH的灰度值之间的比值,表示目的蛋白的表达水平。
1.3 统计学方法
使用SPSS21.0统计软件进行数据处理。对数据进行正态分布和方差分析检验,将符合正态分布的计量资料用均数±标准差表示;病理变化的频率用百分数(%)表示。正常组和DM组PKCδ、p-PKCδ的蛋白表达水平比较采用独立样本t检验;对11例DM组患者肌纤维萎缩、肌纤维肥大、肌纤维核内移、嗜碱性肌浆块发生率与PKCδ、p-PKCδ、CUGBP1表达水平的关系采用Pearson相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 骨骼肌病理学表现
1)HE染色结果显示:正常组骨骼肌组织未见病理学改变(图1A)。6例DMⅠ型患者和2例DMⅡ型患者肌纤维结缔组织大量增生,以致肌纤维松散排布,发生空泡样变;3例DMⅠ型患者和2例DMⅡ型患者肌纤维大小不一,有原形和多边形,出现肌纤维异常(小的为发生萎缩,大的为发生肥大),伴有不同程度的坏死或肌浆块;4例DMⅠ型患者和2例DMⅡ型患者肌纤维核聚集,形成核袋或核链(图1B)。2)MGT染色结果显示:7例DMⅠ型患者和2例DMⅡ型患者肌组织出现红色的纤维破碎片(图1C)。3)NADH-TR染色结果显示:4例DMⅠ型患者和1例DMⅡ型患者肌纤维出现虫蚀样变,发生萎缩变小的肌纤维深染成蓝色肌浆块(图1D)。4)NSE染色结果显示:11例DM患者萎缩变性的肌组织可见明显深染(图1E)。5)ACP染色结果显示:8例DMⅠ型患者和2例DMⅡ型患者肌组织酸性磷酸酶活性发生明显升高(图1F)。6)ATP染色结果显示:9例DMⅠ型患者肌纤维出现选择性Ⅰ型萎缩(图1G),2例DMⅡ患者肌纤维出现选择性Ⅱ型萎缩(图1H)。7)免疫组织化学结果显示:9例DMⅠ型患者和2例DMⅡ型患者患者的膜蛋白表达未出现异常(图2)。
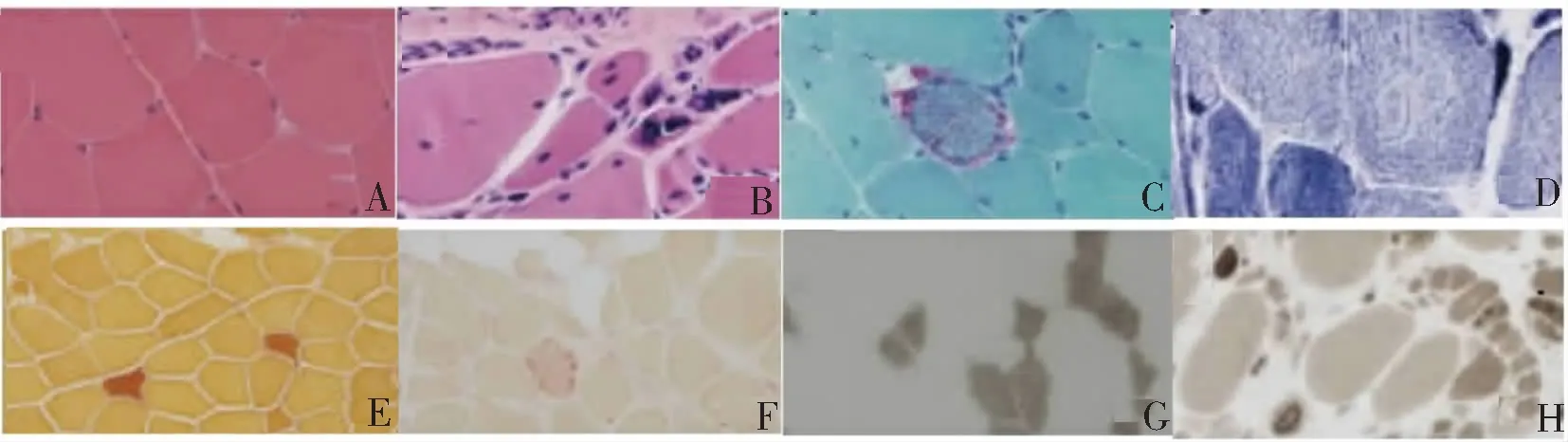
A:正常组HE染色(×400);B:DM组HE染色(×400);C:DM组MGT染色(×400);D:DM组NADH-TR染色(×400);E:DM组NSE染色(×200);F:DM组ACP染色(×200);G:DMⅠ型患者ATP染色(×200);H:DMⅡ型患者ATP染色(×200)。
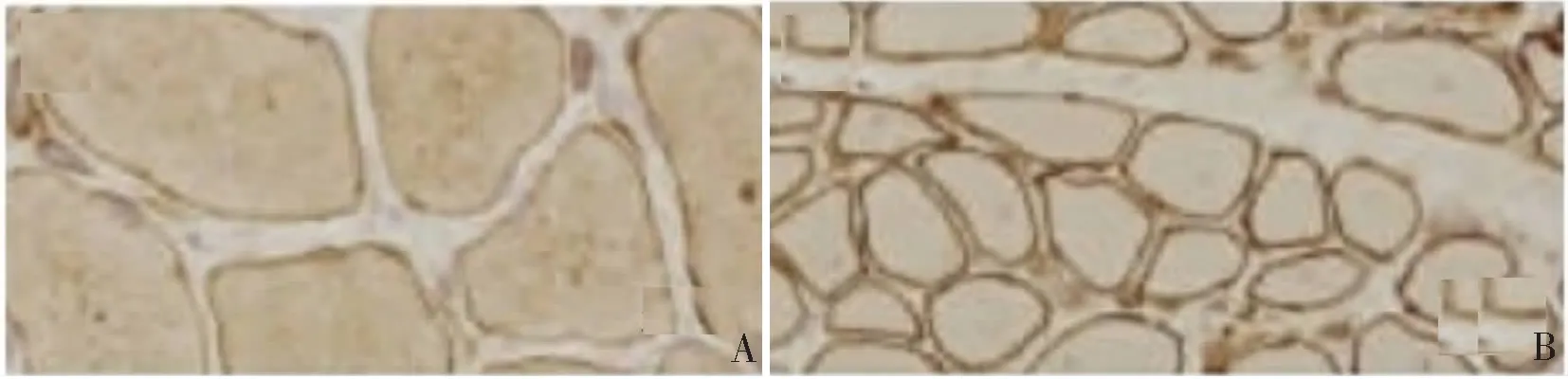
A:Dystrophin-C染色膜蛋白;B:Dysferlin染色膜蛋白。图2 免疫组织化学表现(×200)
11例DM患者肌纤维萎缩发生率在5.25%~30.50%之间,肌纤维肥大发生率在0.00%~9.67%之间,肌纤维核内移发生率在16.50%~92.75%之间,嗜碱性肌浆块发生率在0.00%~5.50%之间,见表1。

表1 11例DM患者骨骼肌病理变化
2.2 PKC/CUGBP1信号通路关键蛋白PKCδ、p-PKCδ、CUGBP1的表达
与正常组比较,DM组肌肉组织中PKCδ蛋白表达无显著差异(P>0.05),p-PKCδ、CUGBP1蛋白表达均显著升高(均P<0.001),见图3、表2。
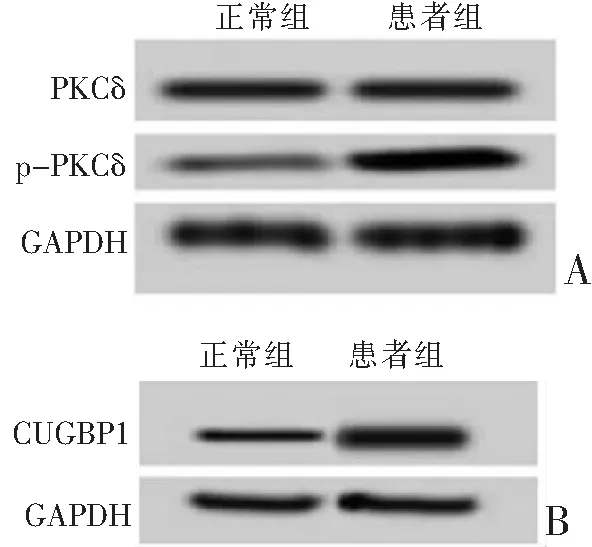
A:PKCδ、p-PKCδ蛋白表达;B:CUGBP1蛋白表达。图3 PKCδ、p-PKCδ、CUGBP1蛋白电泳图
表2 2组PKCδ、p-PKCδ、CUGBP1蛋白表达水平比较
2.3 DM患者PKCδ、p-PKCδ、CUGBP1表达与病理特征的相关性分析
DM患者p-PKCδ、CUGBP1表达与肌纤维萎缩、肌纤维肥大、肌纤维核内移发生率均呈显著正相关(均P<0.05),与嗜碱性肌浆块发生率、膜蛋白异常率均无明显相关(均P>0.05)。DM患者PKCδ表达与肌纤维萎缩、肌纤维肥大、肌纤维核内移、嗜碱性肌浆块发生率及膜蛋白异常率均无明显相关(均P>0.05)。见表3。
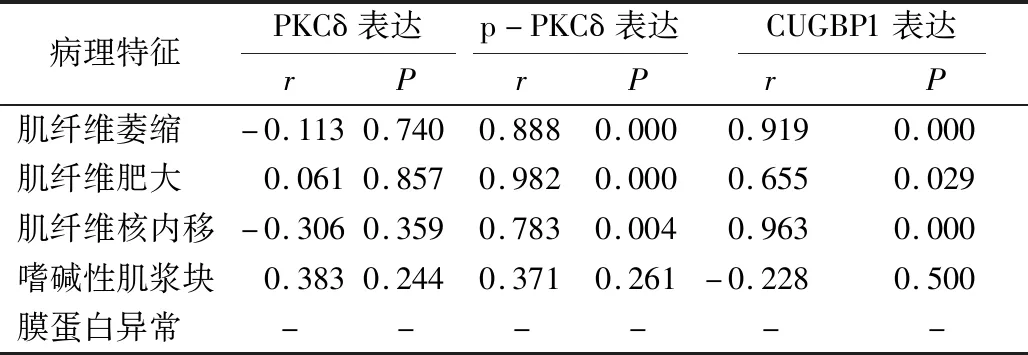
表3 DM患者PKCδ、p-PKCδ、CUGBP1表达与病理特征的相关性分析
3 讨论
DM是成年人中最常见的肌营养不良症,其原因是CTG或CCTG重复序列的基因组扩增不稳定,包含扩展重复序列的突变RNA转录物会干扰细胞核中的剪接因子,从而导致毒性功能获得及替代性的前mRNA剪接失调。该病的表现具有高度的可变性,并且可通过发病年龄和症状的严重程度区分[8]。其发病率极低且具有显性遗传的特性,即只要具有患病基因就会表现症状。症状的轻重与患者携带显性基因的数目相关[9-10]。虽然已有研究[5-7]证明PKC信号通路的活性会影响CUGBP1基因的表达水平,但是二者与患者的病理特征之间的关系尚未清楚。
PKC、CUGBP1参与DM的发生发展过程。唐迎龙[11]报道,CUGBP1不仅在DM中发挥重要作用,其还通过调控RyR1进而影响钙的释放,导致骨骼肌萎缩。据报道[12],在DMⅠ骨骼肌中LIM域结合3(LDB3)外显子11发生异常,其可以通过转染CTG重复序列扩展的基因来复制;此外,LDB3外显子11阳性与外显子11阴性相比,其对PKC的亲和力显著降低;由于PKC在DMⅠ中表现出过度活化并通过磷酸化稳定CUGBP1,因此LDB3的异常剪接可能会通过改变其对PKC的亲和力来促进CUGBP1的上调。也有研究[13]报道,PKC抑制剂可影响CUGBP1家族成员CELF1的过度磷酸化改善DMⅠ小鼠模型的心脏表型,其作用机制与PKC抑制剂消除了核病灶,降低了CELF1的蛋白表达水平有关,与PKC信号通路活性无关。近期,陈慧敏[14]在探究DM分子生物学发病机制中报道,核聚体结构为肌盲蛋白1与RNA发卡二级结构相结合,使游离MBNL1下降,异常扩增的核苷酸重复序列过度激活PKC信号通路的磷酸化过程,使DMⅠ型肌细胞中CUGBP1的表达水平异常升高。本研究通过组织化学染色、免疫组织化学染色观察骨骼肌组织的病理特征,并检测其PKCδ、p-PKCδ的蛋白表达水平,结果显示,p-PKCδ的表达水平与肌纤维萎缩、肥大、核内移呈正相关。这说明PKC信号通路的活性在DM患者骨骼肌中异常降低,这种情况与患者的病理特征(肌纤维萎缩、肥大、核内移)之间呈正相关。这与陈慧敏[14]的研究结果一致,再次证实了该信号通路在DM中的调控功能。本研究检测了患者骨骼肌组织中CUGBP1的蛋白表达水平,结果发现,CUGBP1在患者骨骼肌组织中的表达水平异常升高,说明CUGBP1与p-PKCδ之间可能存在正向相关关系,即PKC信号通路的磷酸化程度会影响下游基因CUGBP1的表达水平。此研究结果揭示了DM患者的病理特征与PKC/CUGBP1信号通路之间的联系,暗示PKC/CUGBP1信号通路可作为诊断、治疗DM的潜在生物靶标。值得注意的是,该研究还发现肌纤维萎缩、肥大、核内移与CUGBP1的表达水平也呈显著的正相关,这说明CUGBP1基因的表达量与患者的病理特征严重程度之间呈正相关。
综上所述,强直性肌营养不良骨骼肌的病理特征与PKC/CUGBP1信号通路的活性存在紧密联系,为DM的治疗提供理论依据。
