LncRNA-NEF转录激活FOXA2并通过抑制β-catenin信号通路抑制肝癌细胞的EMT过程
2021-11-19车军杨柳青孙斌贾泽博
车军 杨柳青 孙斌 贾泽博
肝细胞癌(HCC)占原发性肝癌的80~90%,是全世界第四大最常见癌症相关死亡原因[1]。转移是癌症的标志性事件,伴随转移细胞获得了耐药的能力[2]。研究表明,上皮-间质转化(EMT)是许多癌症中促进转移的关键步骤[3],而其逆过程,即间充质-上皮转化(MET)则可能有利于转移抑制或降低癌细胞耐药性[4]。在EMT过程中,上皮细胞失去其与基底的连接,丧失顶-基极性,并通过一系列的信号转导过程,形成侵袭性表型[5]。研究表明,EMT的标志性特征是上皮性标志物E-cadherin蛋白的丢失,伴随间充质性标志物Vimentin和Snail等蛋白表达的增加。当肿瘤细胞获得侵袭性间充质性表型时,它们的运动性和侵袭性增加,有利于其从局部扩散并渗透到血管中[6]。因此,靶向和逆转肿瘤细胞的EMT过程,实现MET,可能将有效减缓肿瘤细胞的侵袭和远端扩散[7-9]。已有大量研究揭示,Snail、TWIST、Slug和FOXA2均参与调节EMT过程[5]。FOXA2是其中一种关键的EMT抑制性转录因子,但其调节癌症转移的分子机制仍不清楚。最近已有研究显示,lncRNA-NEF能以顺式作用方式直接调节其基因组邻近基因FOXA2的转录[10]。但lncRNA-NEF是否能够通过FOXA2抑制EMT过程,以及其抑制EMT的何种信号通路,目前仍不十分清楚。在本研究中,笔者证实了lncRNA-NEF通过顺式作用方式转录激活FOXA2并通过抑制β-catenin信号通路抑制肝癌细胞的EMT过程。
资料与方法
一、肝癌和癌旁组织来源
收集2018至2019年医院肝癌患者手术切除的肝癌及癌旁组织10对。经患者和医院伦理批准同意后,采用上述组织进行研究。
二、肝癌细胞系细胞培养和药物处理
永生化的正常肝细胞MiHA、肝癌细胞系Hep3B、Huh7、HepG2、Sk-Hep-1购自ATCC(American Type Culture Collection,美国)。所有细胞系细胞均培养在含有10%胎牛血清(Gibco,美国)、100 IU/mL青霉素和100 μg/mL链霉素(Sigma-Aldrich,德国)的DMEM培养液(Gibco,美国)中,培养于37 ℃ 5% CO2孵育箱。Hep3B细胞接种于6-孔板里,TGF-β处理组加入2 ng/mL的TGF-β(Sigma-Aldrich,德国),处理72 h[11];对照组加入等体积的生理盐水。
三、载体构建和转染
构建FOXA2过表达的载体pcDNA3.1(+)购自南京金斯瑞生物科技(南京,中国)。采用Lipofectamine 3000(赛默飞世尔,美国)进行转染。
四、实时荧光定量PCR检测
组织和细胞的总RNA,采用动物组织总RNA提取试剂盒(DP431,天根生化)进行提取。反转录RT-PCR采用lnRcute lncRNA cDNA第一链合成试剂盒(去基因组)(货号KR202,天根生化)和FastKing一步法除基因组cDNA第一链合成预混试剂(货号KR118,天根生化)进行。实时荧光定量PCR引物见表1。
五、检测
组织和细胞的总蛋白采用RIPA裂解液(89900,赛默飞世尔)提取。一抗抗体分别为E-cadherin小鼠抗人单抗(货号14472,CST),Vimentin兔抗人单抗(货号5741,CST),Snail兔抗人单抗(货号3879,CST),FOXA2兔抗人单抗(货号8186,CST),p-β-catenin(phospho Y228)兔抗人单抗(货号ab32403,ABCam),Total β-catenin兔抗人单抗(货号ab223075,ABCam),CCND1兔抗人单抗(货号ab16663,ABCam),CD44兔抗人单抗(货号ab189524,ABCam),VEGF兔抗人单抗(货号ab150375,ABCam),β-actin小鼠抗人(货号ab8226,ABCam)。

表1 实时荧光定量PCR引物列表
六、统计学分析
采用GraphPad Prism 8.0软件进行统计学分析,计量数据以平均值±标准差的形式表示。比较两组间差异,采用的统计学方法为t检验,比较多组间差异,采用的统计学方法为One-way ANOVA。当P<0.05时为具有统计学差异。
结 果
一、LncRNA-NEF在肝癌组织中和肝癌细胞中的表达
lncRNA-NEF在肝癌组织中的表达水平为0.28±0.09,在癌旁组织中表达水平为1.05±0.34,差异具有统计学意义(t=3.792,P<0.05)。lncRNA-NEF与FOXA2 mRNA在Hep3B细胞、Huh7细胞、HepG2细胞、Sk-Hep-1细胞中的表达水平明显低于MiHA细胞(永生化的正常肝细胞,作为对照组),差异具有统计学意义(P<0.05)。见表2。
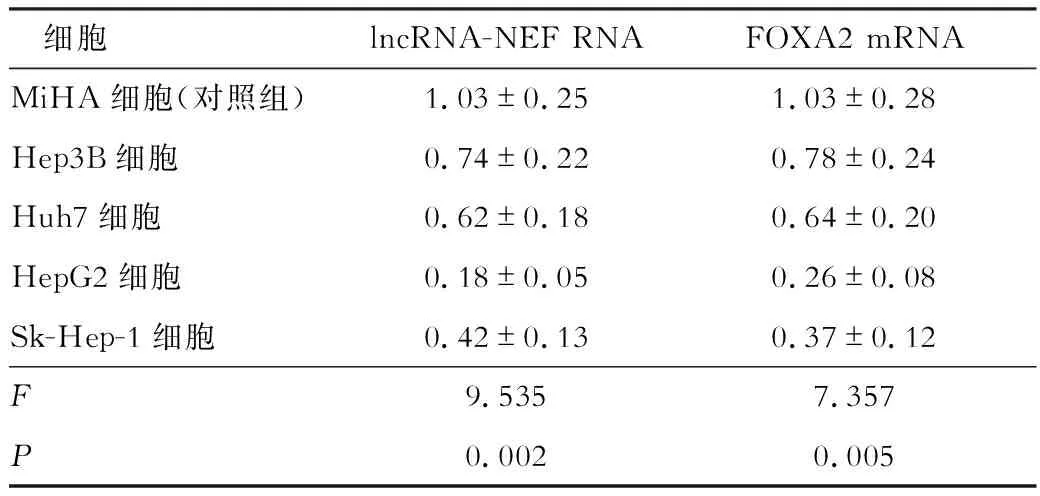
表2 各细胞中lncRNA-NEF RNA与FOXA2 mRNA的表达情况对比
二、在体外采用TGF-β处理能引起Hep3B细胞进入EMT转化并增强其侵袭能力
根据上述实验结果,Hep3B细胞是相对高表达lncRNA-NEF和FOXA2的,使用TGF-β处理(2 ng/mL,处理72 h)Hep3B细胞,使其进入EMT转化,实验分组为对照组(NC)和TGF-β处理组(TGF-β)。检测Hep3B细胞内E-cadherin、Vimentin、Snail蛋白因子的表达量,实验结果显示,E-cadherin表达量显著降低,Vimentin和Snail的表达量显著升高,差距均具有统计学意义(P<0.05),证明经TGF-β处理后的Hep3B细胞的确出现了间充质细胞的典型特征(图 1A)。进一步检测出现间充质细胞典型特征的Hep3B细胞内lncRNA-NEF的RNA和FOXA2的mRNA的表达情况,发现Hep3B细胞进入EMT后,lncRNA-NEF的RNA和FOXA2的mRNA表达均被显著下调(P<0.05)。为了进一步验证实验结果,采用Transwell实验,检测对照组和TGF-β处理组的Hep3B细胞的侵袭能力。结果显示,与对照组相比,TGF-β处理组的细胞侵袭能力显著增强(P<0.05)(图 1B)。具体数据见表3。
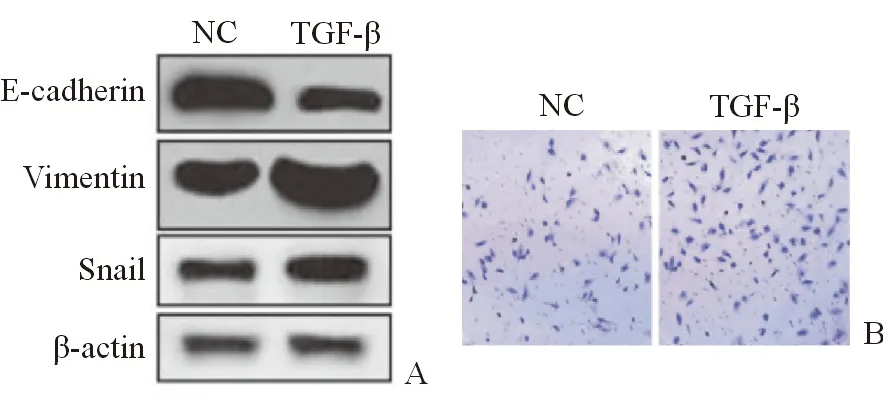
(A)检测Hep3B细胞内E-cadherin、Vimentin、Snail蛋白因子的表达量;(B)采用Transwell实验检测了2组细胞的体外侵袭能力
三、在体外过表达FOXA2能引起HepG2细胞进入MET转化并降低其侵袭能力
HepG2细胞是相对低表达lncRNA-NEF和FOXA2的,采用过表达FOXA2的策略,向HepG2细胞中转染pcDNA3.1-FOXA2质粒,使细胞进入MET转化。实验分组为对照组(NC)和pcDNA3.1-FOXA2转染组(pcDNA3.1-FOXA2)。首先检测FOXA2的mRNA和蛋白质的表达水平,结果显示,与对照组相比,pcDNA3.1-FOXA2转染组细胞的确过表达了FOXA2(P<0.05,图2A)。随后检测HepG2细胞内E-cadherin、Vimentin、Snail蛋白因子的表达量,结果显示,与对照组相比,E-cadherin表达量显著升高、Vimentin和Snail的表达量显著降低,差距均具有统计学意义(P<0.05,图2B),证明转染了pcDNA3.1-FOXA2质粒后的Hep3B细胞的确出现了上皮细胞的典型特征。检测lncRNA-NEF的RNA表达水平,发现lncRNA-NEF的RNA表达水平显著升高。为了进一步验证细胞的确进入了MET转化,采用Transwell实验,检测了对照组和pcDNA3.1-FOXA2转染组的HepG2细胞的侵袭能力。结果显示,与对照组相比,pcDNA3.1-FOXA2转染组的细胞侵袭能力显著降低(图2C)。具体数据见表3。
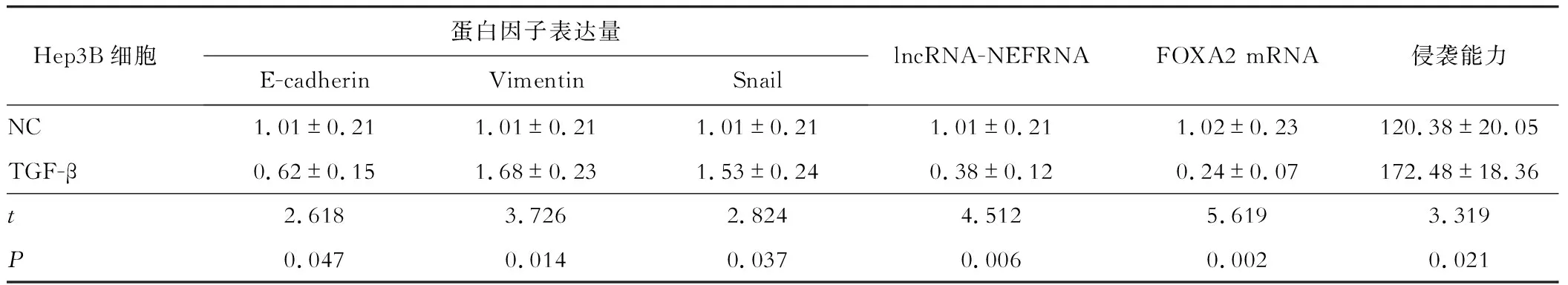
表3 Hep3B细胞蛋白因子、lncRNA-NEF RNA、FOXA2 mRNA的表达量与体外侵袭能力
四、LncRNA-NEF和FOXA2通过抑制β-catenin信号通路抑制肝癌细胞的EMT过程
采用Western blot技术,检测了对照组(NC)和TGF-β处理组(TGF-β)的Hep3B细胞(图 3A)以及对照组(NC)和pcDNA3.1-FOXA2转染组的HepG2细胞(图 3B)中磷酸化的β-catenin(p-β-catenin)、总β-catenin,以及β-catenin信号通路中的关键蛋白CCND1、CD44和VEGF蛋白因子的表达量情况。实验结果显示,与对照组相比,TGF-β处理组的Hep3B细胞内磷酸化的β-catenin(p-β-catenin)表达量显著增高(P<0.05),而总β-catenin蛋白水平不变。随后检测的β-catenin信号通路下游蛋白CCND1和CD44在TGF-β处理组表达被上调,以及VEGF在TGF-β处理组表达被下调(P<0.05)。与对照组相比,pcDNA3.1-FOXA2转染组的HepG2细胞内磷酸化的β-catenin(p-β-catenin)表达量显著降低(P<0.05),而总β-catenin蛋白水平不变。随后检测的β-catenin信号通路下游蛋白CCND1和CD44在过表达FOXA2组表达被下调,以及VEGF在过表达FOXA2组表达被上调(P<0.05)。具体数据见表4。

表3 HepG2细胞蛋白因子、lncRNA-NEF RNA、FOXA2 mRNA的表达量与体外侵袭能力
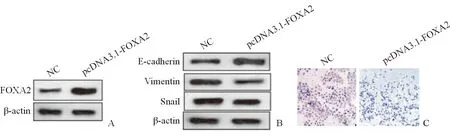
(A)检测FOXA2的蛋白质表达水平;(B)检测HepG2细胞内E-cadherin、Vimentin、Snail蛋白因子的表达量;(C)采用Transwell实验检测了两组细胞的体外侵袭能力
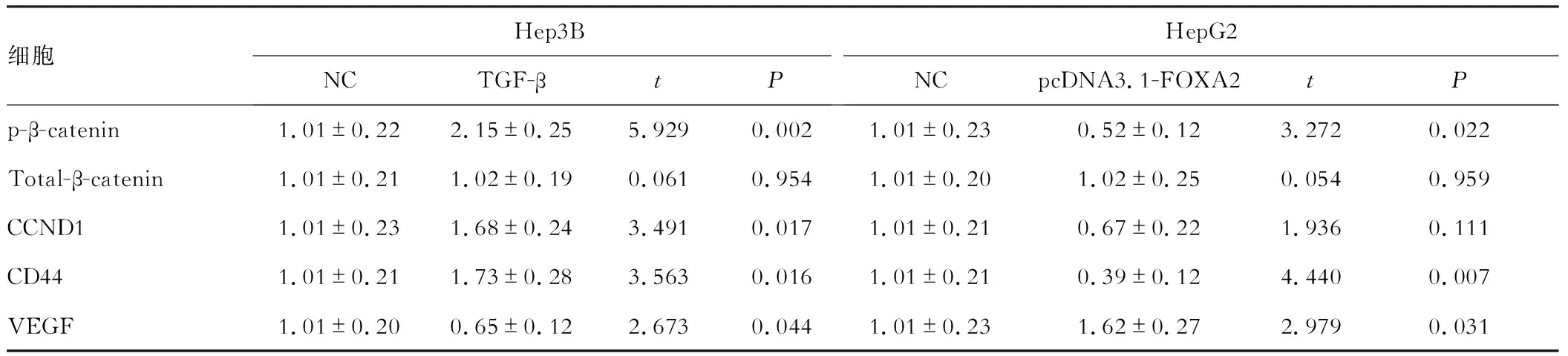
表4 细胞中p-β-catenin、Total-β-catenin、CCND1、CD44和VEGF的表达量
讨 论
EMT是研究从良性肿瘤向恶性癌症演变过程中信号转导机制的有效模型,但对广泛参与癌症发生、发展的lncRNAs是如何在EMT过程中调节信号转导网络的,人们仍知之甚少。本研究结果显示,肝癌组织中lncRNA-NEF和FOXA2的RNA表达水平均显著降低;在肝癌细胞中,lncRNA-NEF表达水平相对较低的细胞,FOXA2的RNA表达量也相对较低,lncRNA-NEF表达水平相对较高的细胞,FOXA2的RNA表达量也相对较高。这验证了之前的报道,即lncRNA-NEF和FOXA2的作用方式是顺式的[10]。另外,在肝癌细胞系HepG2细胞中过表达FOXA2能够显著升高lncRNA-NEF的RNA水平,也进一步验证了这一结果。同时结果还显示,与对照组相比,TGF-β处理组的Hep3B细胞lncRNA-NEF和FOXA2的RNA和FOXA2的蛋白表达水平均显著降低,侵袭能力显著增强,而过表达FOXA2的HepG2细胞lncRNA-NEF和FOXA2的RNA和FOXA2的蛋白表达水平均显著增高,侵袭能力显著减弱,证明了lncRNA-NEF和FOXA2的确参与了肝癌细胞的EMT转化。之前文献报道,在小鼠模型中,激活的β-catenin信号通路,能够负调控FOXA2的表达[12]。因此,本研究检测磷酸化的β-catenin(p-β-catenin)、总β-catenin,以及β-catenin信号通路中的关键蛋白CCND1、CD44和VEGF蛋白因子的表达量情况,结果显示,TGF-β处理组能够诱导Hep3B细胞进入EMT转化并激活β-catenin信号通路;与此相反,过表达FOXA2能够诱导HepG2细胞进入MET转化并抑制β-catenin信号通路。这些结果证实,lncRNA-NEF和FOXA2是通过抑制β-catenin信号通路来抑制肝癌细胞的EMT过程的。
尽管肿瘤早期诊断标记物的研究领域在迅速发展,但大多数HCC患者被发现时,通常已是晚期,治疗方案的可选择性有限且临床预后不良。在HCC中晚期患者中,肿瘤转移一直是严重威胁患者长期生存的主要危险因素。根据本研究的结果,lncRNA-NEF可被认为是EMT的候选抑制剂,lncRNA-NEF的增强表达可显著减弱癌症的转移,这也为进一步研究lncRNA-NEF作为HCC患者的治疗靶标,提供了可靠的基础研究证据。
