盐胁迫条件下‘巴麻火麻’内生真菌的分离鉴定与多样性分析
2021-11-19李娥黄勇孟园园李璇杜光辉刘飞虎
李娥 黄勇 孟园园 李璇 杜光辉 刘飞虎,
(1. 云南大学生命科学学院,昆明 650091;2. 云南大学农学院,昆明 650091)
土壤盐渍化问题已经严重影响了农业和环境的发展。早在1997年,Shannon[1]就预测世界上1/3的耕地资源受到盐害的影响[2]。目前,受盐害的土地面积正在逐年增加。植物内生真菌是指在其生活史的一定阶段或全部阶段,生活于活体植物组织内且不引起明显病害症状的一类真菌[3]。近来研究表明,一些内生真菌可以通过稳定植物营养元素吸收和保持离子平衡[4-6],提高植物渗透调节能力[7],保持植物光合作用和水分利用效率[8-10],增强植物抗氧化防御系统[11-12],产生次生代谢物或诱导相关耐盐基因表达[13-14]等方面来保护宿主植物,减轻盐害。
大麻(Cannabis sativa L.)为大麻科大麻属的一年生草本植物,雌雄异株[15-16]。工业大麻是大麻的品种类型,其 THC 含量<0.3%,在纺织、医药等多个领域都有运用,其产业前景乐观[17-19]。工业大麻因其生长量大、适应性广、抗逆性强,而成为盐碱地大面积种植的重要经济作物[20-21]。项目组前期研究发现,工业大麻品种‘巴麻火麻’苗期对NaCl胁迫的耐性较强[22],但关于其内生真菌,特别是与大麻共生提高其耐盐性的内生真菌的研究有待加强。为此,本研究以前期筛选的耐盐工业大麻品种‘巴麻火麻’为研究材料,分别通过0、100、200、300 mmol/L NaCl盐处理,探究大麻不同盐浓度的内生真菌的变化情况,结合优势度等参数筛选疑似大麻耐盐内生真菌,期望为挖掘与大麻共生提高大麻耐盐性的内生真菌提供参考。
1 材料与方法
1.1 材料
供试工业大麻品种‘巴麻火麻’由广西壮族自治区农业科学院提供。
1.2 方法
1.2.1 大麻盐胁迫处理及样品采集 试验采用盆栽法,塑料盆底直径16 cm、高19 cm(带托盆),装入泥炭基质(挪威JIFFY公司生产)1 kg,每盆施复合肥(NPK比例为13∶11∶11)10 g。一次性浇透水,每天保持适宜的土壤湿度,每隔1周移动塑料盆的位置,保证大麻光照均匀。出苗1周后间苗,每盆留下长势相同的5株大麻,待4对真叶时,每盆追肥300 mL(300 g复合肥+20 g尿素溶于10 L水中)。追肥一周后,盆栽大麻分为4组,每组4盆,分别浇浓度为100 mmol/L、200 mmol/L和300 mmol/L的NaCl溶液及清水(对照),每隔4 d浇一次,每次每盆浇溶液(或清水)300 mL;持续5次后停止浇灌。NaCl处理结束7 d后,从每个处理中随机挑选4株长势一致的大麻植株,分别采集根、茎、叶。其中,从上往下数第3、6、9对真叶分别标记为上叶(sy)、中叶(zy)和下叶(xy);茎从上往下15 cm、15-45 cm、45-60 cm 分为上茎(sj)、中茎(zj)和下茎(xj)。各处理、各部位样品分别放入灭菌的牛皮纸中。标记,封口,4℃低温保存。
1.2.2 内生真菌的分离和纯化 用自来水将大麻各组织样本冲洗30 min,去除表面的泥土及附属物。用滤纸吸干表面水分,用剪刀或者解剖刀截取2-3 cm的小段,置于灭菌烧杯中,放入超净工作台。经75%乙醇漂洗30 s,无菌水冲洗3-4次,再用NaClO(有效氯含量为3%)漂洗5 min,最后无菌水冲洗3-5次。将消毒后的组织材料用无菌刀片剪成若干0.5 cm×0.5 cm小块,各处理小块分别置于含有硫酸链霉素和氨苄青霉素的PDA平板上,处理组各取5株大麻,每株的7个部位各取10片组织片,每个处理共有70个组织片,5个重复。取最后一次洗液200 μL涂布于PDA培养基作为对照组,将组织片按压在PDA培养基上按压3次,在整个操作过程中打开3个培养皿,将3种检验方法的培养皿在相同条件下培养[23]。于(25±2)℃恒温箱中暗培养。接种组织块后第8天,统计内生真菌数量。
1.2.3 内生真菌鉴定 对分离得到的真菌进行ITS序列进行比对分析。DNA提取采用尿素法,分别以真菌通用引物 ITS5(5′-3′:GGAAGTAAAAGTCGTAACAACG)和 ITS4(5′-3′:TCCTCCGCTTATTGATATGC)(硕擎生物公司合成)为上下游引物进行扩增。PCR扩增反应体系如下:DNA模板2.5 μL,ITS4 1 μL,ITS5 1 μL,2×Taq mix 12.5 μL,ddH2O 8 μL。PCR扩增程序:94℃预变性5 min,94℃变性30 s,54℃退火 30 s,72℃延伸 1 min,35个循环,72℃延伸 8 min,4℃ 保存。PCR 扩增产物于l.2%琼脂糖凝胶电泳检测,将检测出目的条带的PCR扩增产物送至上海生物工程公司测序,测序结果用CExpress软件等进行序列校对,再通过ClustalX(1.8)和Phylip等软件进行OTU分析,相同序列选其中一条作代表序列,登录NCBI进行Blast比对(相似性97%以上为同种)。
1.2.4 数据分析 利用Excel 2016进行数据的统计。采用分离率(该指标可以衡量在一个特定的植物组织样品中内生真菌的丰度以及植物组织样品中多重侵染的频率)、Berger-parker优势度(表示一个种属在群落中的地位与作用)、Sorenson相似性指数(反映内生真菌群落的相似性系数)、Shannon-Wiener多样性指数指数(反映种群丰富度和均匀度)等指标反映不同浓度盐胁迫下大麻内生真菌的分离情况。各参数计算公式如下:
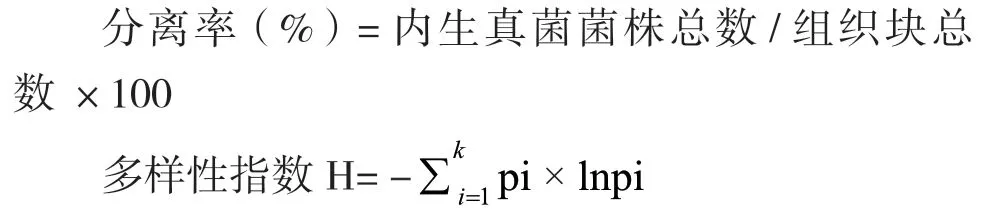
式中:k为某样品中内生真菌种数;pi是指某样品中某种(属)内生真菌i数量占全部内生真菌菌株总数的百分比。

式中:K指两种样品中共有的内生真菌种类数,a指其中一种样品的内生真菌种类数,b指另一种样品的内生真菌种类数 。

式中:H为多样性指数,S为菌种类型总数。

式中:S是菌种类型总数,N是菌株总数。
2 结果
2.1 不同盐浓度下大麻内生真菌种类
采用涂布检验、组织压片法检验、超净工作台检验3种方法的PDA培养基均无菌落长出,说明表面消毒彻底,分离的真菌属于内生真菌(图1)。本研究4个处理7个部位的1 400个大麻组织中共分离得到内生真菌543株,合并后得到88株菌,隶属于14个科18个属44个种。其中,对照组上叶、中叶、下叶、上茎、中茎、下茎和根7个部位中分别分离到9、14、41、7、11、21和50株真菌;100 mmol/L NaCl处理下分别分离到4、19、44、4、6、18和21株真菌;200 mmol/L NaCl处理下分别分离到4、15、32、5、16、8和44株菌;300 mmol/L NaCl处理下分别分离到14、12、25、10、5、34和50株菌。各处理分离得到内生真菌种属见表1。根据不同处理下分离得到内生真菌属绘制相对丰度,0 mmol/L NaCl处理下‘巴麻火麻’内生真菌主要包括以下类群 :Alternaria、Annulohypoxylon、Aphanocladium、Chaetomium、Cladosporium、Colletotrichum、Diaporth、Nemania、Neocosmospora、Nigrospora、Hypoxylon和Trichoderma,其中Trichoderma、Cladosporium和Chaetomium为优势属;100 mmol/L NaCl处理下‘巴麻火麻’内生真菌主要包括以下类群:Alternaria、Annulohypoxylon、Aphanocladium、Chaetomium、Cladosporium、Fusarium、Hansfordia、Kretzschmaria、Nemania、Neocosmospora、Nigrospora和 Trichoderma,其中Trichoderma、Nigrospora、Cladosporium为优势属;200 mmol/L NaCl处理下‘巴麻火麻’内生真菌主要包括以下类群:Annulohypoxylon、Chaetomium、Cladosporium、Diaporth、Fusarium、Hansfordia、Trichoderma,其中Trichoderma Cladosporium和Fusarium为优势属;300 mmol/L NaCl处理下‘巴麻火麻’内生真菌主要包括以下类群:Alternaria、Annulohypoxylon、Chaetomium、Cladosporium、Diaporth、Fusarium、Nigrospora、Pleosporales、Hypoxylon和Trichoderma,其中Trichoderma、Cladosporium和Fusarium为优势属、枝孢霉和哈茨木霉在各处理组中占比都大(图2)。
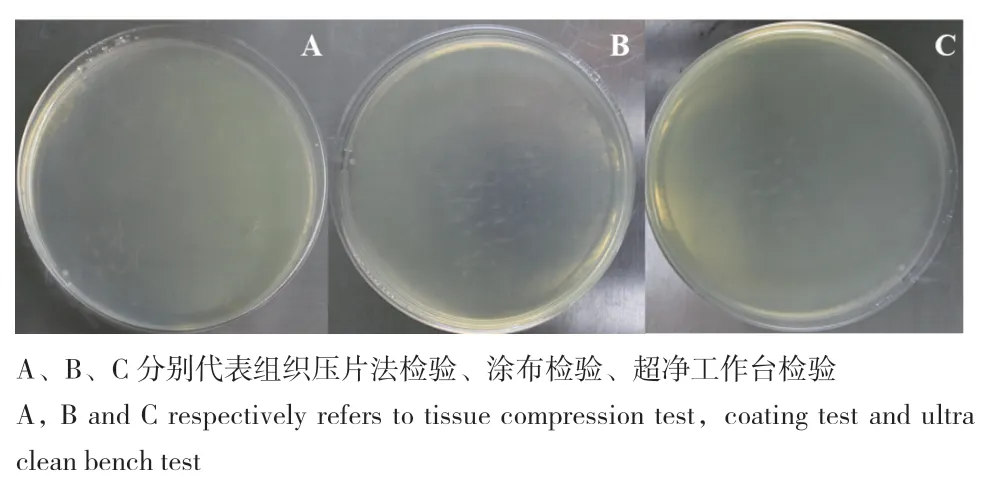
图1 内生真菌灭菌效果检测图Fig. 1 Sterilization effect of endophytic fungi

图2 不同盐处理下内生真菌的相对丰度Fig. 2 Relative abundance of endophytic fungi under different salt treatments

Alternaria sp..,m m,m③ladosporium sp②kahawae,ospora(22)albu e,igrospora usariu entosa,ocladium ania rospora dosporium eocosm -2018,ig Hypoxylon ph Hypoxylon fragiform dium arzianum,ium globosu maria pavim ia diffusa,N,N an Fusarium ypoxylon Colletotrichum la atroroseum,em usarium sp.,globosum,Cladosporium dosporium sp.,F s of salt stress ia diffusa②,richoderma Nemania diffusa,Leptosphaeria phanocla ypoxylon stygium,N a h ,H SP troroseum,ypoxylon stygium,A m oxysporum②,iseti②haan e novem,N Kretzsch crospora,C-2018,arzianum②,ma 20)lobosum②la sp.,m equ Annulohypoxylon stygium,F an Chaetomium leospora m oxysporum(11)m sp.,T globosum②,usariu Diaporth erma h les sp. 9 M Nigrospora sphaerica,A etomoxysporum②eris(20)em nulohypoxylon bovei,C Trichoderm Alternaria nn SP Nigrospora sphaerica,N,Cem arzianum,C uloh aria sp.,F usariu richod Diaporthe novem,N m sp.,P Annulohypoxylon a haetom m g olletotrichu aetomium tion rzianum,rium nnulohypoxylon s cucum Nigrospora oryzae,Species iu usariu Hypoxylon trugodes(centra An nn m,ovem②,uloh Pleosporales sp. 9 M X40,ia sp. JP38-6,oryzae,AHa nulohypoxylon stygium,A microscopica,A erianu nsfordia a h usariu fragiforme,CCh aria sp,R60.1,equ iseti,Fsa Altern Fu sp.,an solani,C m,种An albu Fusarium Neocosmospora rubicola,sp.,bicola,T nia sp. ANema diffusa,Hansford Trichoderm equiseti,F Diaporthe n oryzae,F Altern atephoru ru pilgha Th较,,,igrospora 黑m 枝 孢 孢 团 霉霉孢m毛 垫 霉 (8)壳菌菌 霉孢霉孢属,菌菌菌菌 属孢孢属ifferent con孢属属,种er d比类孢,lternaria链m镰 孢霉离nd usariu lternaria链iu m镰ypoxylon炭斯les格菌ladosporiu霉ladosporiu m镰菌p” u格ansfordia汉分igrospora 黑m 枝 孢 疽 属 菌em 点格oderma木属ladosporiu usariu leospora真em ,N ,C ,F菌菌属,C ,H olletotrichum炭孢团腔,A haetomania炭,N,N usariu igrospora 黑m 枝,A rich ,F属,H属属,H生a h,C olletotrichum炭 菌 腔 (14),C属属,C iaporth茎属,N,F,C霉病属eptosphaeria小菌霉霉属 属属属属属属,P菌菌 菌菌内am ypoxylon炭球richoderma木属属属枝菌属霉,T(13)霉菌菌菌孢菌孢属团壳ber of each species,D团壳格iaporth茎孢属麻”dium丝oderma木墩um ium毛ium毛链疽菌团壳etomania炭霉a木,D ia nulohypoxylon炭 团ha dosporium 枝菌属Hypoxylon炭porth茎疽属点腔,L etomania炭ted from “B maria炭Genera ospora炭霉属垫em火em eocosm nulohypoxylon炭nulohypoxylon炭团垫枝点病,T ha巴,N孢霉,N ia汉rich etom phanocla麻ium毛la lternaria usariu ha,N,C,D,A leosporales格菌属,T目” refer to the n属,A 数下“la 属An属,C,F nulohypoxylon炭An,C属病,P的迫,C属Kretzsch病Neocosmospora炭菌Aphanocladium丝m镰斯属霉属属属属霉An 属 属Hansford An 属 霉 疽 属Trichoderm(13)个种and ③胁度tic fun gi iso,,,) 各,②盐科科 ,科到,科离菌科is(6)壳菌ocreales incertae科盖菌浓hy菌菌分盖,孢,孢示同op 竹 ,孢 竹科枝壳科科枝表从竹科枝1 不 壳f end从壳ypocreales赤盖ectriaceae ocreaceae壳iaporthaceae,菌ladosporiaceae,H③”,赤iaceae 毛 壳n of species o yp yp ,D eratobasidiaceae(9 ladosporiaceae②、ocreaceae表科,C球,H藻haetom iaceae 毛,H ,H,H iaceae 毛ectriaceae iaceae 毛ladosporiaceae藻 ,C,N科ypocreaceae era and species,and “①①、毛,“,C球 科,C科haetom,C科球赤壳藻壳haetom ylariales incertae sed haetom毛科菌,C科科目gi,gen赤数,C菌科科,C科菌毛总菌pariso 从Trichosphaeriaceae从 孢菌科枝盖 科孢aeriaceae壳腔从小科孢Nectriaceae的小赤球科,X科孢菌iaporthaceae,Nyp角多 角多 角多 种ber of fun Families 炭Xylariaceae炭richosphaeriaceae erellaceae,um richosph Xylariaceae属科incertae sedis,D小炭炭,ble 1 C om osporiaceae竹Glom,T Pleosporaceae科Glom,T sedis,科(9)Xylariaceae Pleosporaceae Xylariales incertae sedis(9)角Clad Hypocreaceae Xylariaceae Pleosporaceae erellaceae菌科Leptosphaeriaceae真到Ta Salt concentration离refer to the total n示分)”数bers in “(表字里面um度浓mm ol·L-1)()”he n注Note:“:T盐/(0000102030
将4个处理始终存在的内生真菌通过NCBI序列比对,相似性97%以上为同种,4个处理始终存在的内生真菌的具体信息见表2,不同盐处理始终存在的内生真菌有球毛壳菌(Chaetomium globosum)、炭垫菌(Nemania diffusa)和炭团菌(Annulohypoxylon stygium)主要存在于大麻中叶和下叶中,而哈茨木霉(Trichoderma harzianum)主要在大麻根中存在,枝孢霉(Cladosporium)在各组织部位均存在(表3)。

表2 不同浓度盐胁迫下“巴麻火麻”始终存在的内生真菌及其ITS序列分析Table 2 Endophytic fungi and its sequence analysis of ‘Bama hemp’ under different concentrations of salt stress

表3 不同浓度盐胁迫下“巴麻火麻”始终存在的内生真菌分离数目Table 3 Number of endophytic fungi isolated from ‘Bama hemp’ under different concentrations of salt stress
2.2 内生真菌多样性分析
在0-300 mmol/L NaCl处理下,大麻内生真菌的丰富度指数在1.11-2.31之间,呈现先降后升趋势,200 mmol/L NaCl处理下内生真菌的丰富度指数最低,且与其他处理差异显著(图3-A);均匀度指数却呈现先升高后降低的趋势,300 mmol/L NaCl处理下最低,且与其他处理差异显著(图3-B);在0-300 mmol/L NaCl处理下,内生真菌的分离率在23%-42.85%之间,呈现先降后升趋势,100 mmol/L NaCl处理下最低,且与其他组差异显著(图3-C);在0-300 mmol/L NaCl处理下,多样指数在1.30-1.78之间,呈现先降后升趋势,200 mmol/L NaCl处理下与其他3组差异显著(图3-D)。不同盐浓度间大麻内生真菌相似性比较发现,相似性系数差异不显著,但均小于0.5,说明盐处理影响了真菌群落组成(表4)。

表4 不同盐浓度间大麻内生真菌相似性系数比较Table 4 Comparison of similarity coefficient of hemp endophytic fungi among different salt concentrations
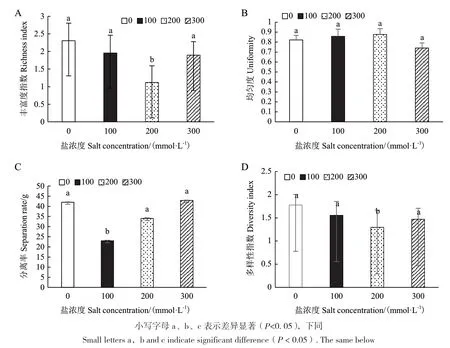
图3 不同浓度盐处理下大麻内生真菌的多样性分析Fig. 3 Diversity analysis of endophytic fungi in hemp under different concentrations of salt treatment
3 讨论
‘巴麻火麻’为广西省当地的籽用工业大麻品种。项目组的前期研究发现,其耐盐碱能力较强[20]。除了自身组织结构、生理特性以及分子机制外,大麻内生真菌是否能够增强其耐盐性,值得深入分析。本研究的结果初步发现:各处理相似性系数均小于0.5,说明盐处理影响了内生真菌的群落组成。随着盐浓度增加内生真菌多样性指数、丰富度、分离率先降后增,100 mmol/L NaCl处理下内生真菌分离率最低,200 mmol/L NaCl处理的内生真菌丰富度、多样性指数最低,说明一定的盐浓度会导致一些耐盐内生真菌数量和种类减少,一些对盐敏感的内生真菌死亡,使一类或者几类耐盐内生真菌占优势地位。
以往的研究,只是基于常规栽培环境下的内生真菌的分离、鉴定和分析[24-25]。但是缺乏在盐胁迫下大麻内生真菌的研究。本研究设置了不同浓度的NaCl处理,希望通过盐浓度的变化,发现大麻内生真菌的变化情况,寻找到与大麻共生提高大麻耐盐性的内生真菌。研究发现,各盐处理组内生真菌种类不同,但有3个科始终存在(炭角科、毛壳科和枝孢菌科),5个属始终存在(炭团菌属、毛壳菌属、枝孢霉属、炭垫菌属和木霉菌属),5个种始终存在(毛壳菌、哈茨木霉、炭垫菌、枝孢霉和炭团菌)。虽然,本研究分离到的毛壳菌、镰孢菌、链格孢、小球腔菌、格孢腔菌、枝孢菌、球护壳菌、炭团菌和炭垫菌等是常见的植物内生真菌[26-27],但不同盐处理下枝孢菌、球毛壳菌、炭团菌、炭垫菌和哈茨木霉始终存在,这5种内生真菌不随盐浓度增加而消失,推测这几种菌可能与提高植物耐盐性有关。
有报道称,枝孢菌、球毛壳菌为耐盐内生真菌[26],球毛壳菌能拮抗多种病原菌[28],还能产生赤霉素和吲哚乙酸和提高干旱条件下辣椒生长[29],但关于球毛壳菌、枝孢霉、炭团菌协助植物抵御盐胁迫的研究未见报道。哈茨木霉则已经报道能在盐胁迫下提高水稻、玉米、小麦[30]、芥菜[31]等多种植物耐盐性[32]。炭垫菌是重要的生防菌,但炭垫菌的耐盐性或协助植物抵御盐胁迫的研究还未见报道。
目前,关于植物内生真菌协助植物抵御盐胁迫机制涉及稳定植物营养元素吸收[33]、提高植物渗透调节能力[34],保持植物光合作用和水分子利用率[10]、提高植物抗氧化能力[35]、分泌植物促生长相关激素[36]、拮抗盐胁迫中的致病菌[37]及诱导相关耐盐基因表达[38]等,但没有统一定论。本研究发现,‘巴麻火麻’在0-200 mmol/L NaCl处理下,其内生球毛壳菌和哈茨木霉的数量会随致病菌的增加而增多。而报道称球毛壳菌和哈茨木霉可以抑制相关致病菌[38],故推测盐胁迫导致致病菌入侵植物根部机率增加,从而导致拮抗致病菌的植物内生真菌增殖。
4 结论
在不同盐浓度处理下,分析‘巴麻火麻’7个部位1 400个组织片中内生真菌变化情况发现:5种内真菌枝孢菌、球毛壳菌、炭垫菌、炭团菌、哈茨木霉在不同处理下始终存在,且变化有一定规律。推测几种内生真菌与大麻耐盐性有关。