雷公藤甲素所致的SD大鼠卵巢损伤及淫羊藿苷联合三七总皂苷的干预作用▲
2021-11-19邹颜红祁爱蓉徐缘钊罗登贵刘宴娟凌舒艺
邹颜红 祁爱蓉 徐缘钊 罗登贵 刘宴娟 凌舒艺 傅 博
(广州中医药大学第四临床医学院肾病科,广东省深圳市 518033,电子邮箱:1635765703@qq.com)
中药雷公藤,其性寒凉,味苦、辛、涩,有大毒,具有祛风除湿、舒经活络、消肿止痛、解毒等功效。现代研究表明,雷公藤含有生物碱、萜类化合物、卫矛醇等多种生物活性物质,雷公藤甲素是其主要有效成分[1]。目前,临床上广泛使用雷公藤制剂治疗肾病综合征、糖尿病肾病、类风湿关节炎、系统性红斑狼疮等多种免疫性疾病,具有较好的疗效。但同时其对肝脏、肾脏、血液系统、生殖系统等会造成一定的损伤,尤其是对生殖系统的毒性作用使得雷公藤制剂的临床应用受到很大限制[2-3]。因此,近年来雷公藤制剂的生殖毒性成为研究热点之一。
淫羊藿苷是中药淫羊藿的主要有效成分之一,它是一种黄酮类化合物,具有雌激素样作用,能够促进性激素分泌,延缓性腺衰老[4-5]。三七总皂苷是从中药三七中提取的有效活性成分,具有清除自由基、抗氧化、延缓衰老、调节细胞凋亡等功能[6]。有学者发现[7],联合应用淫羊藿苷和三七总皂苷对大鼠睾丸的生殖功能衰退有改善作用,但两者联合使用是否可以改善卵巢生殖功能的损伤,鲜有研究报告。本研究通过建立雷公藤甲素诱导SD大鼠卵巢损伤模型,初步探讨雷公藤甲素对卵巢的毒性,以及淫羊藿苷联合三七总皂苷对卵巢功能的保护作用。
1 材料与方法
1.1 主要试剂与仪器 雷公藤甲素(货号:PCS0576)购自中国成都植标化纯生物技术有限公司;淫羊藿苷(批号:PIKX-771H)、三七总皂苷(批号:GF49-NH59)均购自中国食品药品检定研究院;胎牛血清(批号:WXBD0055V)购自美国Sigma公司;杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)/F12完全培养液(批号:2020046)购自Biological Industries公司;青霉素-链霉素溶液(双抗)(批号:1989511)购自美国Gibco公司;生物素标记兔抗大鼠IgG(批号:SA1055)购自武汉博士德生物工程有限公司,过氧化物酶标记山羊抗兔IgG(批号:96203)购自上海翊圣生物科技有限公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(批号:C0105)、CCK-8试剂盒(批号:C0038)均购自上海碧云天生物技术有限公司;10%水合氯醛溶液(批号:DC04BA0020)购自BBI Life Sciences公司;4%多聚甲醛溶液(批号:70085400)购自Biosharp Life Sciences;TritonX-100溶液(批号:100M0128V)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号:SHBB5172V)均购自美国Sigma公司;乙醇(批号:20200530)购自广东光华科技股份有限公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS,批号:AF29511327)购自美国HyClone公司;二甲苯溶液(批号:C12019254)购自上海麦克林生化科技有限公司;透明质酸酶(货号:H6254)购自Sigma-Aldrich公司。多功能酶标仪(美国伯腾仪器有限公司,型号:Synergy HIM)、离心机(上海卢湘仪离心机仪器有限公司,型号:TDZ4-WS)、显微镜(日本尼康公司,型号:Ts2)、CO2培养箱(日本三洋电机株式会社,型号:MC0-18AIC)、超净工作台(上海力康医疗设备有限公司,型号:OptiClean1300)。
1.2 实验动物与分组 18只8~9周龄雌性SD大鼠,体重约250 g,由广东省医学实验动物中心提供[动物许可证号SCXK(粤)2018-0002]。将大鼠饲养在温度22℃~25℃、相对湿度55%~65%、12 h光照/12 h黑暗周期的房间内,适应性喂养约7 d后进行实验。使用随机数字表将大鼠分为正常对照组、模型组和治疗组3组,每组6只。正常对照组每日以含5% DMSO的生理盐水灌胃,模型组每日以雷公藤甲素50 μg/kg(溶于含5% DMSO的生理盐水中)灌胃,治疗组则每日以雷公藤甲素50 μg/kg+淫羊藿苷30 mg/kg+三七总皂苷30 mg/kg(溶于含5% DMSO的生理盐水中)灌胃,灌胃体积均为10 mL/(kg·d),1次/d。
1.3 实验方法
1.3.1 标本留取:连续灌胃6个月后,以10%水合氯醛溶液(0.3~0.4 mL/100 g)腹腔注射麻醉大鼠,将大鼠迅速浸入75%酒精中约5 s,移入超净工作台,无菌条件下进行解剖,观察并拍照记录卵巢形态,迅速剥离摘取双侧卵巢,进行后续实验。
1.3.2 卵巢病理切片与卵泡计数:将一侧卵巢置于4%多聚甲醛固定液中,常规脱水、透明、浸蜡、包埋、石蜡切片、HE染色,显微镜下观察卵巢病理组织形态改变,并参照Myers等[8]提出的卵泡分类方法进行卵泡计数。
1.3.3 原代卵巢颗粒细胞的分离与培养:在超净工作台上将另一侧卵巢用PBS反复冲洗,使用1 mL注射器针头挑出成熟卵泡,刺破卵泡使卵泡内颗粒细胞释放,置于培养液中,用吸管吹打分散成单个悬浮细胞;加入500 μL透明质酸酶,孵化30 min;离心(800 r/min,5 min)后小心吸去适量上清液,反复两次后进行反复吹打,将颗粒细胞吹打成细胞混悬液,加入0.25%胰酶消化3~5 min,再次离心(800 r/min,5 min)后弃去上清液;将DMEM/F12完全培养液加入底物中,再次离心(1 000 r/min,5 min)后,弃去适量上清液,收集颗粒细胞。用含10%的胎牛血清及1%双抗的DMEM/F12培养基将颗粒细胞的浓度调为5×105/mL,接种于24孔细胞孔板,1 mL/孔,置于37℃、5%CO2的培养箱中恒温培养,待细胞贴壁后进行后续实验。
1.3.4 原代卵巢颗粒细胞形态鉴定:取正常对照组原代卵巢颗粒细胞进行形态鉴定。(1)HE染色。细胞爬片3张,固定液固定10 min以上,蒸馏水洗涤2 min;苏木素染色液染色5~10 min,浸入自来水中冲洗去除多余的染色液约10 min,蒸馏水再洗涤1遍(数秒),伊红染色液染色30 s至2 min(可根据染色结果和要求调整时间)。按照下述顺序进行脱水、透明、封片:70%乙醇10 s、80%乙醇10 s、90%乙醇10 s、无水乙醇10 s、二甲苯透明5 min;换用新鲜的二甲苯,再透明5 min;用中性树胶或其他封片剂封片;显微镜下观察,并拍照记录。(2)细胞免疫组化染色。细胞爬片3张,用PBS漂洗3次,2 min/次;用4%的多聚甲醛固定15 min,干燥后用PBS漂洗3次,2 min/次;用0.5%的TritonX-100溶液孵育20 min,用PBS漂洗3次,2 min/次;再用3%的H2O2孵育15 min,用PBS漂洗3次,2 min/次;用牛血清白蛋白封闭20 min,甩掉封闭液,滴加一抗(生物素标记兔抗大鼠IgG),4℃过夜后,用PBS漂洗3次,5 min/次;滴加二抗(过氧化物酶标记山羊抗兔IgG),37℃下孵育30 min,用PBS漂洗5次,2 min/次;二氨基联苯胺显色(避光)约10~15 min,水洗5 min。苏木素复染10 min,自来水洗5 min;脱水、透明、树胶封片、镜下观察、摄片及分析。
1.3.5 CCK-8法检测卵巢颗粒细胞的活力:取1×105/mL颗粒细胞接种于96孔板中,100 μL/孔,每组设置6个复孔;于37℃、5%CO2培养箱培养24 h以上,待细胞贴壁后每孔加入10 μL的CCK-8试剂,继续置于37℃、5%CO2培养箱中孵育,孵育1 h后于酶标仪上检测450 nm处的吸光值。吸光值越大细胞活力越强。
1.4 统计学分析 应用SPSS 26.0统计软件进行统计分析。计量资料以(x±s)表示,方差齐者采用单因素方差分析进行组间比较,两两比较采用LSD-t检验,方差不齐者采用Kruskal-Wallis 检验进行组间比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组卵巢组织形态 (1)解剖形态:正常对照组肉眼下观察可见卵巢潮红柔软,表面较光滑;而模型组可见卵巢体积变小,颜色灰白,表面皱缩,质地较坚硬;治疗组可见卵巢体积稍小,颜色苍白,表面略皱缩。见图1。(2)病理形态:HE染色提示正常对照组大鼠卵巢体积与结构正常,可见各级卵泡广泛分布,卵泡液含量多,颗粒细胞层次较多;而模型组大鼠卵巢结构出现一定程度的破坏,生长期卵泡(包括初级卵泡、次级卵泡)以及成熟卵泡数量较正常对照组减少,闭锁卵泡数量明显增多,卵泡颗粒细胞层次明显变薄;治疗组大鼠卵巢结构则未见明显改变,各级卵泡数量与正常对照组间无明显差异。见图2。
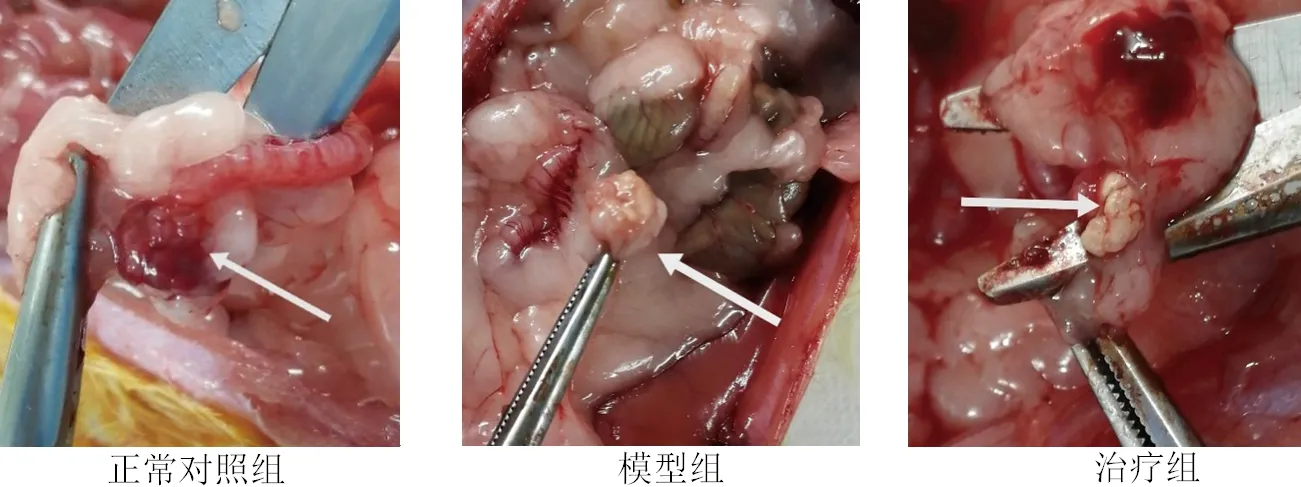
图1 各组大鼠卵巢组织形态
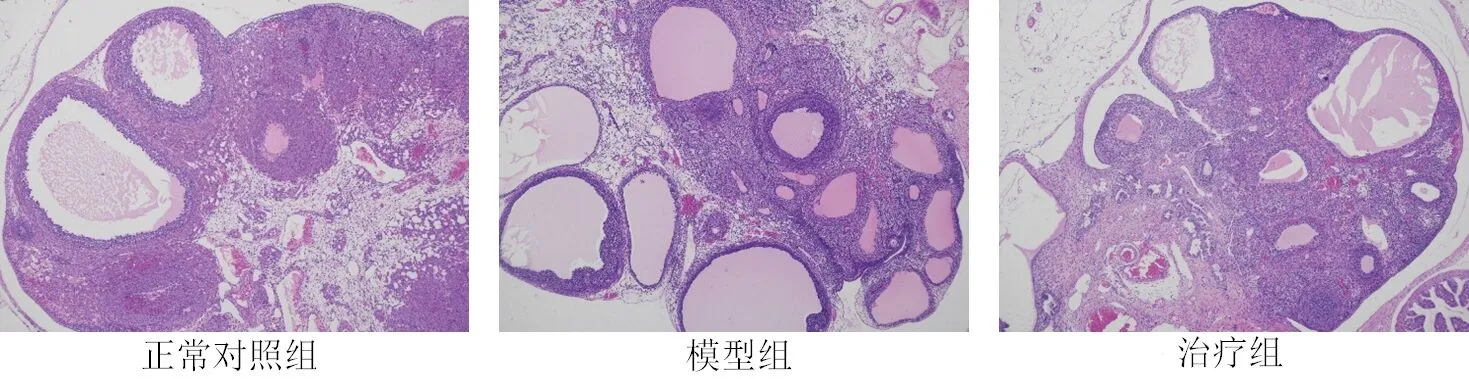
图2 各组卵巢病理切片 (HE染色,×40)
2.2 各组大鼠卵泡计数 以闭锁卵泡和成熟卵泡为代表,进行卵泡计数。与正常对照组和治疗组相比,模型组大鼠卵巢闭锁卵泡数量增多(均P<0.05),正常对照组与治疗组之间差异无统计学意义(P>0.05);与正常对照组相比,模型组和治疗组的成熟卵泡计数均减少(均P<0.05),模型组与治疗组之间差异无统计学意义(P>0.05)。见表1。
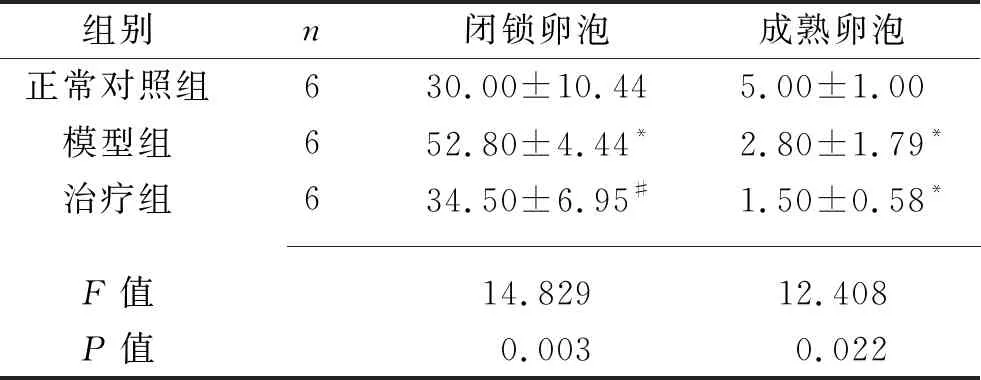
表1 3组大鼠卵泡计数的比较(x±s,个)
2.3 正常对照组原代卵巢颗粒细胞形态鉴定结果 (1)HE染色:在镜下可见贴壁细胞体积较大,形态完整,边缘清晰,大小均匀,呈梭形或多角形,细胞核和细胞质染色均匀,细胞核染色呈深蓝色,卵圆形或不规则形位于细胞中央,细胞质呈淡红色。与文献报道的形态一致[9]。见图3。(2)细胞免疫组化染色:在镜下可见贴壁细胞形态较完整,呈梭形或不规则形,细胞核和细胞质染色均匀呈棕褐色,高倍镜下可见细胞质内广泛分布细密的颗粒状物。见图4。
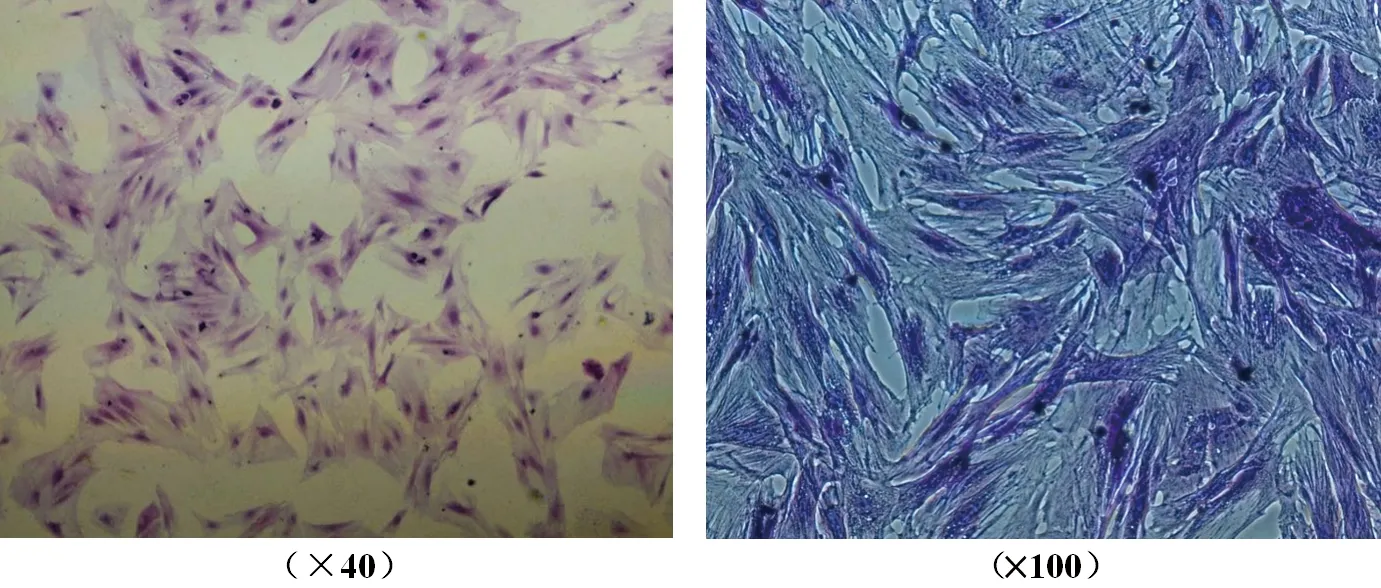
图3 卵巢颗粒细胞HE染色
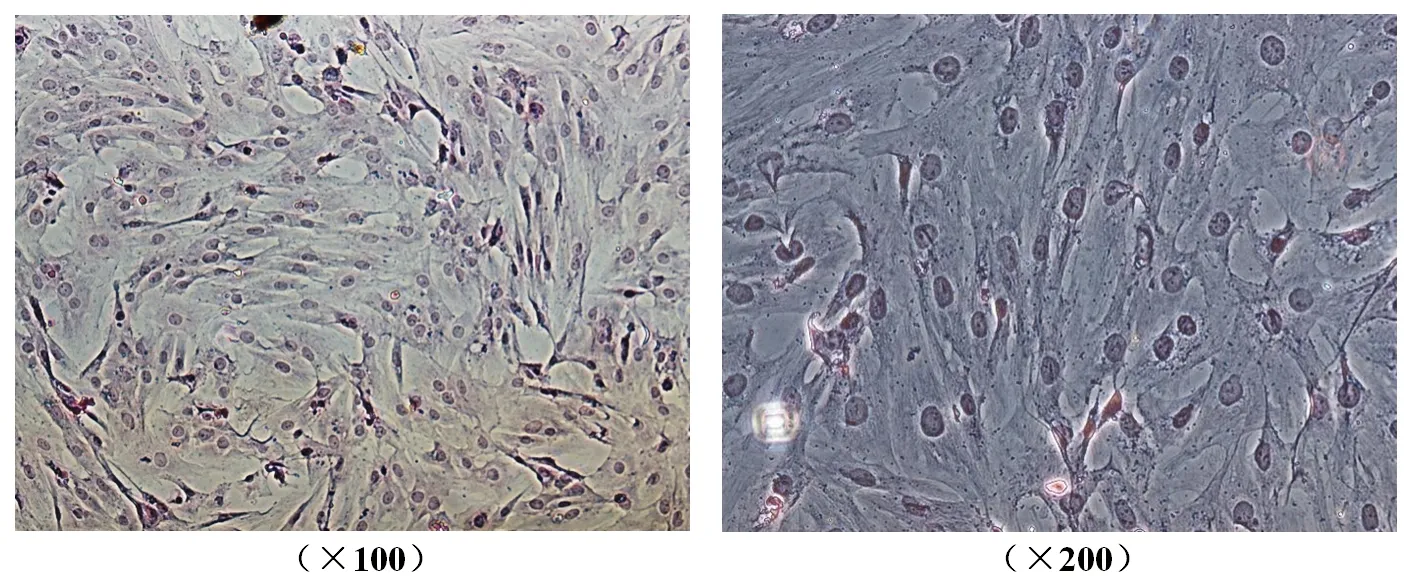
图4 卵巢颗粒细胞免疫组化染色
2.4 各组卵巢颗粒细胞活力 模型组大鼠卵巢颗粒细胞活力低于正常对照组(P<0.05);治疗组大鼠卵巢颗粒细胞活力较模型组有所上升(P<0.05),与正常对照组比较差异无统计学意义(P>0.05)。见表2。
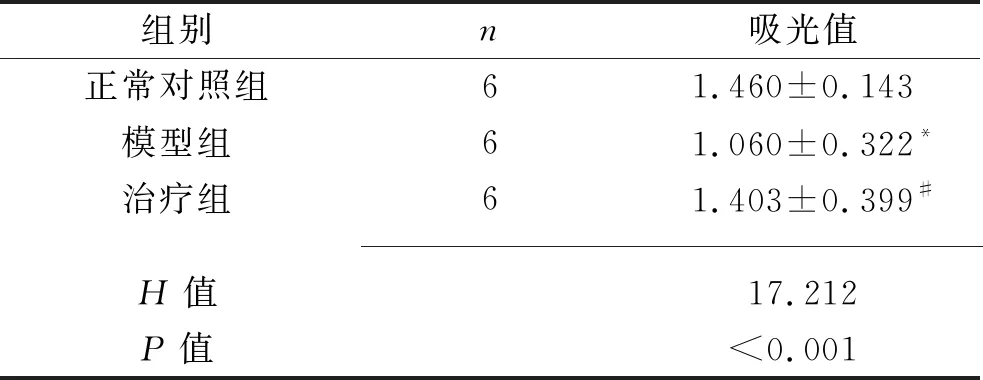
表2 3组卵巢颗粒细胞吸光值的比较(x±s)
3 讨 论
卵巢是雌性动物的主性器官,可产生和排出卵子,分泌雌激素和孕激素,卵泡是卵巢的基本功能单位,由卵母细胞和卵巢颗粒细胞组成,其中颗粒细胞作为卵巢中必需的体细胞,它可以支持和营养卵母细胞,并参与卵泡的发育和多种激素的分泌。研究显示,卵泡闭锁与颗粒细胞的凋亡密切相关[10-11]。
目前,分析雷公藤甲素对卵巢颗粒细胞损伤作用的相关文献中,其实验方法多数是利用卵巢颗粒细胞进行体外培养后,再使用雷公藤甲素等药物直接对颗粒细胞进行刺激干预,观察细胞增殖率或抑制率的变化[12-14]。而本研究则通过雷公藤甲素灌胃造模后再提取分离原代大鼠卵巢颗粒细胞,CCK-8法检测细胞活力,观察雷公藤甲素在动物体内对卵巢颗粒细胞产生的作用,避免直接使用药物单体刺激细胞时因药物的理化性质带来的干扰,更真实地反映雷公藤甲素在体内的药物效应。
本研究首先根据雷公藤多苷的人体常用剂量,并结合相关文献[15-17],根据大鼠与人的表面积换算公式进行换算,估算了雷公藤甲素的干预量为50 μg/(kg·d)。结果显示,雷公藤甲素干预后的大鼠卵巢体积变小,结构破坏,闭锁卵泡明显增多,成熟卵泡数量减少,颗粒细胞的活力也较下降,提示雷公藤甲素对雌性大鼠卵巢有明显的损伤作用。而在此基础上选用淫羊藿苷联合三七总皂苷来干预雷公藤甲素诱导的卵巢损伤,发现治疗组大鼠卵巢结构较模型组有所改善,闭锁卵泡减少,颗粒细胞活力较模型组有所提高,提示淫羊藿苷联合三七总皂苷对雷公藤甲素诱导的雌性大鼠卵巢功能损伤具有一定的改善作用。
综上所述,雷公藤甲素可诱导雌性大鼠卵巢发生损伤,而淫羊藿苷联合三七总皂苷可以一定程度上拮抗雷公藤甲素所致的这一损伤作用,这或可为临床合理应用中药配伍,以减轻雷公藤甲素毒性提供更确切的实验依据。但淫羊藿联合三七总皂苷的具体作用机制有待进一步深入研究。
