不同尾型绵羊群体尾脂差异lncRNA 的表达验证与功能预测
2021-11-18吐尔逊阿依牙力坤刘玲玲刘武军
吐尔逊阿依·牙力坤,曹 行,王 琼,2,刘玲玲,刘武军*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.吐鲁番职业技术学院,新疆吐鲁番 838000)
脂肪不仅是一种重要的储能物质,而且在调节动物体能量平衡过程中起着重要作用,并与动物产肉量、肉品质、肉风味等产肉性状密切相关。尾脂肪也被人类用作食物。但是,由于日常饮食中过多的脂肪被认为对人体健康有害,而脂肪功能的紊乱可导致许多心血管疾病的发生,如高血脂、II 型糖尿病等,因此动物脂肪沉积的分子调控机制备受关注。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 个核苷酸,具有调控细胞增殖、分化、凋亡及自噬等多种生物学过程的非编码RNA 分子[1]。动物脂肪沉积是一个复杂的生物过程,受功能基因、非编码RNA 和成脂相关信号通路等系列遗传因子的级联调控,其中lncRNA 起重要的调控作用[2]。近年来,越来越多的研究发现mRNA 和lncRNA 在动物脂肪沉积中发挥重要作用。前人发现了几种调控脂肪生成的lncRNA,例如3T3-L1 细胞中的lncRNANEAT1[3]和小鼠中的Blnc1[4]。在人类中,lncRNA ADINR 通过激活CCAAT 增强子结合蛋白α(C/EBPα)的转录来促进脂肪形成[5]。lncRNAH19 在骨髓间充质干细胞进入脂肪细胞的过程中抑制脂肪细胞的分化[6]。据报道,lncRNA MEG3 参与了人类脂肪干细胞在成脂和成骨分化之间的平衡[7]。最近,已经发现了几种调节绵羊脂肪形成的lncRNA。
Mohammad 等[8]对伊朗大尾羊和小尾羊进行了转录组比较分析,研究了绵羊肥尾lncRNA 的表达及其在脂肪沉积中的可能作用,并鉴定了7 个大尾和小尾之间差异表达基因,通过lncRNA-mRNA 相互作用的基因调控网络,发现了3 个与脂质代谢相关的重要模块。Miao等[9]在绵羊中通过深度测序已经确定了心脏、皮肤、肌肉、乳腺和脂肪组织等的转录组谱,分析了小尾寒羊与多塞特羊之间皮下脂肪组织的转录组信息。Ma 等[10]为了评估兰州大尾羊、小尾寒羊以及藏羊这些绵羊品种中与尾脂肪沉积和发育相关的lncRNA 和mRNA,对这3 个个体进行了高通量RNA 测序。通过3 组的RNA 测序数据显示长尾巴的绵羊和细尾巴的绵羊组之间有10个差异表达的基因和37 个差异表达的lncRNA。差异表达基因和差异表达的lncRNA 的靶基因的基因本体论和途径分析发现,脂肪酸代谢和与脂肪酸伸长有关的途径均富集,这些途径有助于脂肪沉积。
迄今为止,关于lncRNA 在绵羊脂肪沉积中的调控功能及其如何调节mRNA 表达的报道较少。本研究选择新疆地方绵羊巴什拜羊和巴什拜羊与盘羊杂交二代作为研究对象,采集肥尾和小尾绵羊群体的尾部组织,利用全转录组技术,筛选出在尾脂中高表达的差异MSTRG.37980、MSTRG.38164,对其靶基因进行预测,并对该lncRNA 及其靶基因的表达规律进行分析,初步确定二者表达量及其在调控绵羊脂肪代谢中的作用,以期为鉴定与绵羊脂肪代谢调节机制相关的功能基因提供依据。
1 材料和方法
1.1 实验样品的采集 本次实验所需的动物来自于新疆塔城裕民县地区随机挑选相同饲养条件下的10 月龄的6 只巴什拜羊及6 只野生盘羊×巴什拜羊的杂交二代羊,公母各3 只,屠宰后立即采集尾脂、皮下脂、背最长肌、股四头肌、臂三头肌、肝脏、瘤胃、十二指肠、盲肠、大肠、小肠共11 种组织,并将采集好的新鲜组织装入2 mL RNase-Free 冻存管,暂存于液氮中,带回实验室后将全部样品迅速转移至-80℃冰箱保存备用。
1.2 实验方法
1.2.1 差异表达lncRNA 的选择 前期对6 只巴什拜羊和6 只野生盘羊× 巴什拜羊的杂交二代羊的尾脂组织中的RNA-seq 结果共检测到了728 个差异表达的lncRNA;进行差异lncRNA 的靶基因预测后进行靶基因的功能富集分析,发现MSTRG.37980 的靶基因SCD(硬脂酰辅酶A 去饱和酶)参与PPAR 信号通路,MSTRG.38164 的靶基因GPAM(线粒体甘油-3-磷酸酰基转移酶)与脂肪部位脂肪沉积有关。
1.3 RNA 的提取 将肌肉组织样从液氮中拿出放入(取样品约100 mg)提前预冷好的研钵中进行磨碎,使用Trizol 法进行总RNA 的提取,取2 μL 总RNA 利用1%的琼脂糖凝胶进行完整性检验。
1.4 RNA 浓度的检测 在Nanodrop 分光光度仪检测孔内加入1 μL 的RNA 原液进行RNA 浓度检测,分别记录不同样品的浓度和OD260/280的数值。其中D260nm/D260nm=1.8~2.0 的样本可用于后续实验,于-80℃保存待用。
1.5 引物设计及合成并PCR 扩增检测
1.5.1 引物的设计 从2 种群体尾脂中差异表达筛选获得的2 个lncRNA,根据测序结果中提供的序列设计引物,SCD基因(GenBank 登录号:NM_001009254.1)和GPAM基因(GenBank 登录号:XM_012102928.3)mRNA 序列从NCBI 数据库中获得,利用Primer 5.0 软件设计引物,其中以β-actin(ID:HM067830.1)作为内参基因。引物名称和序列、退火温度以及扩增片段大小见表1。

表1 荧光定量引物信息
1.5.2 cDNA 的合成 使用上一步提取的总RNA,按照PrimeScript RT reagent Kit with gDNA Eraser 试剂盒说明书进行反转录,取出后的cDNA 在-20℃冷冻保存。
以上一步反转录获得的cDNA 作为模板,进行目的基因的PCR 扩增(总体系为20 μL):2×PCR Master Mix 10 μL,上、下游引物(0.2 μmol/L)各0.4 μL,cDNA 1.5 μL(100 ng),ddH2O 7.7 μL。扩增程序为:94℃5 min;94℃ 30 s;54℃ 30 s,39 个循环;72℃ 5 min。PCR 产物取3 μL 与2 μL 6×Loading Buffer 混匀,用2%琼脂糖凝胶电泳检测,180 V 20 min;使用凝胶成像系统采集图像,若获得的产物片段大小与预期一致则进行下一步实验。
1.5.3 实时荧光定量PCR 荧光定量检测采用7500 Fast Real-Time PCR System 型荧光定量PCR 仪进行,使用TB Green Premix Ex Taq II 的反应体系进行扩增(总体系为20 μL):TB Green Premix Ex Taq II 10 µL,RNase-freeddH2O 6 µL,上、下游引物各0.8 μL,Rox Reference Dye II 0.4 μL,cDNA 2 μL,具体实验操作流程按照产品说明书进行。每个样品基因表达以β-actin基因作为内参基因,每个样品重复检测3 次。PCR 程序为:95℃ 30 s,95℃ 5 s,54℃ 30 s,40 个循环。
1.6 统计分析 采用2-ΔΔCt法计算目的基因的相对表达量。运用SPSS 19.0 软件的单因素方差分析(One-way ANOVA)进行组间比较,并用最小显著差异法(Least Significant Difference,LSD)进行多重比较,P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 总RNA 的检测 图1 可明显看到28S 和18S 条带,5S 条带不明显,说明提取的总RNA 完整性好且无降解;利用核酸检测仪进行总RNA 浓度测定,提取的总RNA浓度高且无蛋白质、DNA 等污染,可用于后续实验。

图1 总RNA 电泳图
2.2 PCR 产物检测 利用2% 的琼脂糖凝胶电泳检测PCR 产物(图2),发现产物片段大小均符合预期,有且仅有1 条带,说明引物设计的特异性良好,前期RNA 提取及cDNA 的反转录符合要求。

图2 目的基因的qRT-PCR 检测
2.3 lncRNA 表达量与RNA-Seq 结果比较 选取绵羊尾脂样品,将挑选出的lncRNA 的qRT-PCR 结果与前期RNA-Seq 结果进行比较,结果表明:MSTRG.37980 与MSTRG.38164 在巴什拜羊与杂交二代羊尾部脂肪组织中的定量和RNA-Seq 结果基本一致,表明RNA-Seq 结果较为准确可靠,可用于后续实验。
2.4 巴什拜羊和杂交二代羊不同组织中MSTRG.37980的表达差异分析 由图3 可以看出,MSTRG.37980 在巴什拜羊尾脂和小肠中的表达量极显著高于杂交二代羊,在背最长肌中的表达量显著高于杂交二代羊,在皮下脂、臂三头肌、股四头肌、十二指肠、盲肠中的表达量均高于杂交二代羊,但差异不显著。

图3 MSTRG.37980 在巴什拜羊与杂交二代羊不同组织中的相对表达差异
2.5 巴什拜羊和杂交二代羊不同组织中SCD基因的表达差异分析 由图4 可以看出,SCD基因在巴什拜羊尾脂中表达量极显著高于杂交二代羊,在皮下脂、背最长肌、臂三头肌、股四头肌、十二指肠、盲肠、小肠部位的表达量高于杂交二代羊,但差异不显著;杂交二代羊大肠中表达量显著高于巴什拜羊,肝脏、瘤胃中的表达量高于巴什拜羊,但差异不显著。
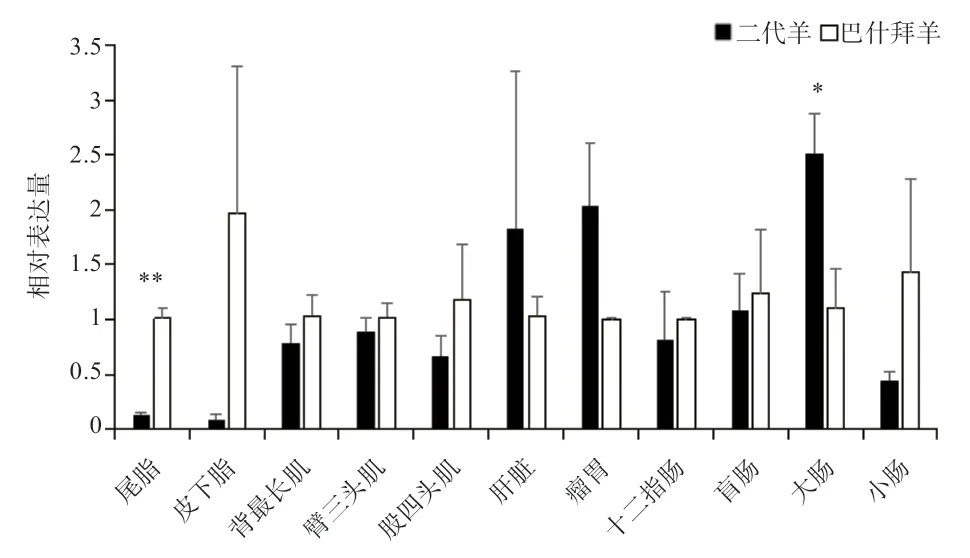
图4 SCD 基因在巴什拜羊与杂交二代羊不同组织中的相对表达差异
2.6 巴什拜羊和杂交二代羊不同组织中的MSTRG.38164表达差异分析 由图5 可知,MSTRG.38164 在巴什拜羊尾脂中表达量极显著高于杂交二代羊,背最长肌和肝脏中表达量显著高于杂交二代羊,且皮下脂、臂三头肌、股四头肌、十二指肠、盲肠、大肠、小肠中的表达量均高于杂交二代羊,差异不显著;杂交二代羊瘤胃中的表达量高于巴什拜羊。

图5 MSTRG.38164 在巴什拜羊与杂交二代羊不同组织中的相对表达差异
2.7 巴什拜羊和杂交二代羊不同组织中GPAM基因的表达差异分析 由图6 可以看出,GPAM基因在巴什拜羊肝脏中表达量显著高于杂交二代羊;杂交二代羊瘤胃中的表达量高于巴什拜羊,但差异不显著,其他部位表达量均低于巴什拜羊。

图6 GPAM 基因在巴什拜羊与杂交二代羊不同组织中的相对表达差异
3 讨 论
3.1 MSTRG.37980 与SCD基因在巴什拜羊和杂交二代羊各组织表达量的比较分析SCD是在脂肪生物合成中将饱和脂肪酸(SFA)转换为单不饱和脂肪酸(MUFA)的关键酶[11-12],它具有调节动物体内脂代谢的功能。前人研究发现,哺乳动物中,SCD主要在肝脏、肌肉组织、脂肪组织中高表达[13],可作为肌内脂肪沉积的潜在生物标志物[14]。而本研究发现SCD基因的mRNA 在巴什拜羊皮下脂肪表达量最高,杂交二代羊大肠、肝脏表达量最高,与前人研究一致,在组织中的表达量情况基本相同,但SCD基因在巴什拜羊与二代羊各组织中的表达规律有一定差异。Huang 等[15]在莱芜猪和大白猪皮下脂肪组织中鉴定出了与脂代谢和成脂分化相关的lncRNA 和基因,表明了lncRNA 可以靶向mRNA,然后在PPAR 信号传导通路、脂肪细胞分化和脂肪酸代谢中发挥重要的作用,并鉴定了SCD基因参与PPAR 信号通路。本实验结果推测SCD基因通过参与PPAR 信号通路,参加脂肪合成相关基因的表达,使得巴什拜羊形成大尾。Ma 等[10]人通过绵羊尾部脂肪组织中的差异表达基因和lncRNA 进行网络构建,共得到了493 对共表达对,并发现这些共表达的对中,大部分是显著正相关,只有一小部分对是负相关,表明了这些mRNA和lncRNA 可能主要通过正向调控发挥作用。本实验结果MSTRG.37980 和SCD基因的mRNA 在巴什拜羊和杂交二代羊各组织部位的表达规律基本相似,说明MSTRG.37980 可能参与脂肪沉积,并且可能通过正向调控作用使SCD基因的mRNA 表达高。
3.2 MSTRG.38164 与GPAM基因在巴什拜羊和杂交二代羊各组织表达量的比较分析GPAM基因的主要作用是通过催化三酰基甘油和磷脂生物合成过程,从而促进动物机体甘油三酯(TAG)的生成,并通过中心和外周调节作用,对哺乳动物脂肪沉积、能量消耗、胴体质量以及整体的代谢进行调控[16-17]。于海滨[18]为了验证GPAM基因对脂代谢的影响,通过脂质体介导牛GPAM基因的RNA 干扰载体,沉默内源,抑制GPAM表达后显著降低牛前体脂肪细胞和牛胎儿成纤维细胞中的甘油三酯含量,证明了GPAM基因可能在调节动物脂肪代谢中起关键作用。并且有学者发现,GPAM基因在所有脂肪中都有所表达,其中在肝脏、脂肪组织中表达量最高,其次是肌肉[19]。而本实验发现GPAM基因在肌肉、脂肪以及肝脏部位的表达量较高,与该研究结果基本一致,推测出GPAM可能调控脂肪合成。本实验对比了GPAM基因在巴什拜羊与二代羊相同部位的表达差异发现,该基因在2 种羊肝脏部位的表达差异显著。由此推测,GPAM基因在巴什拜羊中可能主要在肝脏、脂肪部位发生作用,从而增加脂肪的沉积。本实验还发现GPAM基因和MSTRG.38164 在巴什拜羊和杂交二代羊各部位的表达规律是相似的,MSTRG.38164 可能通过对GPAM的调控,参与脂肪合成并沉积。以上研究结果表明,MSTRG.38164 和GPAM基因功能可能是广泛的,尤其是在脂肪沉积方面。
4 结 论
本研究利用qRT-PCR 对2 种差异表达lncRNA 靶基因进行了表达量分析,发现MSTRG.37980 和MSTRG.3定量与RNA-Seq 结果相似;SCD基因和MSTRG.37980在巴什拜羊和杂交二代羊各组织部位表达规律基本相似,并且SCD基因通过参与PPAR 信号通路,参加脂肪合成相关基因的表达,使得巴什拜羊形成大尾,MSTRG.37980 可能参与脂肪沉积,并通过正向调控作用使SCD基因的mRNA 表达高;GPAM基因和MSTRG.38164 在巴什拜羊和杂交二代羊各部位的表达规律相似,GPAM基因可能在巴什拜羊肝脏、脂肪部位发生作用,使得脂肪沉积增加。MSTRG.38164 可能通过对GPAM的调控参与脂肪合成并沉积。
