黄芪多糖中抗炎组分的结构及其活性的初步研究
2021-11-18范信晖杨一丹秦雪梅李震宇李雪琴山西大学中医药现代研究中心太原00006山西大学化学生物学与分子工程教育部重点实验室中国科学院过程工程研究所通讯作者maillikesxueducn
范信晖,李 科,,杨一丹,秦雪梅,李震宇,李雪琴(山西大学中医药现代研究中心,太原 00006;山西大学化学生物学与分子工程教育部重点实验室;中国科学院过程工程研究所;通讯作者,E-mail:like@sxu.edu.cn)
中药黄芪是多年生豆科植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao或膜荚黄芪Astragalus membranaceus(Fisch.) Bge.的干燥根[1]。性味甘,微温,归脾、肺经,具有补脾益气、利水消肿、托毒生肌功效;为补药之长[2]。
本草考证发现,黄芪尚能够治疗伤寒、热病、瘰疬痰嗽、疟疾、骨蒸潮热、霍乱呕吐、痘疹等病症,但这些病症在历版《中国药典》中未被收载,而目前在临床实践中广泛应用的利水消肿、生津养血等免疫促进功能在古代本草中并非主要功效,不占主导地位[3]。《五十二病方》是目前发现最早记载黄芪主治的典籍,云“黄芪治疗疽病,肉疽则倍用”;《神农本草经》中将黄芪列为上品,言其“味甘微温,主痈疽久败创,排脓止痛,大风,痢疾,五痔,鼠瘘,补虚,小儿百病”;表明古人最早使用黄芪用于治疗疽病。现代研究表明,疽病的发病机制与西医所指的炎症密切相关,表明黄芪应该具有抗炎等免疫抑制功能;即黄芪具有免疫双向调节作用[4]。
黄芪多糖是黄芪药材中含量最多、免疫活性最强的一类物质[5]。大量研究表明,黄芪多糖具有免疫双向调节功能,已在细胞水平和动物水平得到验证[6-10]。然而目前黄芪多糖的研究大多以黄芪总多糖作为研究对象,究竟是黄芪多糖中哪些分子量多糖在起免疫促进功能,哪些分子量多糖具有免疫抑制活性,或者兼具免疫促进和免疫抑制活性?这些方面鲜见报道,也是黄芪多糖创新药物研发亟需解决的问题。
本课题组前期研究发现,黄芪总多糖的分子量分布主要分为两个部分,由APS-Ⅰ(大于2 000 kD)和APS-Ⅱ(10 kD)组成;通过超滤膜分离手段将两个组分分离制备,并通过细胞筛选和动物试验验证,发现APS-Ⅱ是起免疫促进作用的主要组分[11,12],而两个组分在免疫抑制过程中的药理作用尚不清楚。
因此,本研究采用水提醇沉法提取山西浑源黄芪中的多糖成分,采用超滤膜截留法将APS截取得到APS-Ⅰ和APS-Ⅱ,运用光谱、色谱以及质谱等方法对APS-Ⅰ和APS-Ⅱ的结构进行分析,并采用LPS诱导巨噬细胞株RAW264.7建立细胞炎症模型,以此评价APS-Ⅰ和APS-Ⅱ的抗炎活性。本研究对于探明黄芪抗炎的物质基础奠定了基础,也为黄芪多糖的药物开发准备了条件。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 高效液相色谱仪(依利特P230);Waters 2695液相色谱仪;示差折光检测器(RID);2489紫外检测器;CPA225D万分之一电子天平;Neofuge13R高速冷冻离心机(上海力申科学仪器有限公司);SC-3610低速离心机(安徽中科中佳科学仪器有限公司);ZX-LGJ-18普通型冷冻干燥机(上海知信实验仪器技术有限公司);RE-52型旋转蒸发器(上海亚荣生化仪器厂);Trace PolarisQ气相色谱-质谱联用仪(美国Thermo Finnigan公司);Bruker Tensor27型红外光谱仪;Bruker 600-MHz Avance Ⅲ NMR Spectrometer(瑞士,布鲁克公司);Chirascan V100圆二色光谱仪(英国应用光物理公司)。
1.1.2 试剂 山西浑源黄芪(仿野生蒙古黄芪),山西大学秦雪梅教授鉴定为蒙古黄芪的干燥根(2017年采收,生长年限5年)。药材样品留存于山西大学中医药现代研究中心样品库。系列相对分子质量(Mr)右旋糖酐对照品(Mr:180,2 500,7 100,10 000,21 400,41 100,84 400,133 800及2 000 000,中国食品药品检定研究院);葡萄糖(Glu),半乳糖(Gal),半乳糖醛酸(GalA),鼠李糖(Rha),甘露糖(Man),岩藻糖(Fuc),阿拉伯糖(Ara)和N-乙酰葡糖胺(GlcNAc)(纯度大于98%;山西玖玖商贸有限公司);木瓜蛋白酶购自Solarbio公司(美国);三氟乙酸(TFA,纯度大于99%;中国上海阿拉丁);氘代硼氢化钠(NaBD4)购自Sigma公司(美国);无水二甲基亚砜(DMSO)购自阿拉丁(中国上海);1-苯基-3-甲基-5-吡唑啉酮(PMP,纯度大于99%;国药集团化学试剂有限公司);分析级甲醇、无水乙醇、氯仿及正丁醇均购自天津市大茂化学试剂厂;色谱级乙腈为美国Thermo公司。所有其他试剂均为分析级。RAW264.7小鼠巨噬细胞从ATCC获得,MTT、澳洲胎牛血清、DMEM培养基、0.25%胰蛋白酶、PBS磷酸盐缓冲液、脂多糖均购自北京索莱宝科技有限公司。一氧化氮(NO)检测试剂盒购自上海碧云天生物技术有限公司;肿瘤坏死因子-α(TNF-α)和白细胞介素-10(IL-10)的酶联免疫吸附测定(ELISA)试剂盒均购自武汉博士德生物工程有限公司。
1.2 APS的提取
参考文献[13]方法提取APS,黄芪粉末过100目筛后取黄芪细粉15 g,以1 ∶20比例加入去离子水,90 ℃下磁力搅拌器搅拌提取4 h,离心取上清液浓缩至150 ml,酶解法结合三氯乙酸法除蛋白(加入200 U木瓜蛋白酶,45 ℃下水浴6 h,随后加10%三氯乙酸至总体积200 ml,冰浴中搅拌15 min后静置30 min,离心弃沉淀)。离心后上清液中缓缓加入无水乙醇至最终醇浓度为80%,静置过夜,沉淀冷冻干燥得APS。
1.3 APS的分离
根据APS的分子量分布特点,采用超滤膜截留法进行分离,可将APS分为2个部分。第一部分分子量大于2 000 kDa(超出线性范围),第二部分的分子量为10 kD。将APS配制成5 mg/ml的溶液,并通过分子截留量为100 kD的超滤膜将APS分为>2 000 kD(APS-Ⅰ)和10 kD(APS-Ⅱ)两个组分。截流后,将这2个部分冷冻干燥,计算得率。
1.4 总糖含量测定
采用苯酚硫酸法对总糖含量进行测定[14]。标准曲线制作:精密量取100 μg/ml的葡萄糖对照品溶液0,0.1,0.2,0.4,0.6,0.8,1 ml,分别置于试管中加水至1 ml,然后加入5%苯酚溶液1 ml,浓硫酸5 ml,各管加完浸于沸水浴中煮沸5 min后取出,用冰浴冷却至室温。在485 nm波长下以0 μg/ml为空白,测定其余各管吸光度。以葡萄糖含量(μg)为横坐标,以吸光度为纵坐标,绘制标准曲线,得到葡萄糖的线性回归方程为y=4.712 7x+0.062 2,R2=0.994 5。
多糖含量测定:将样品配制成100 μg/ml的溶液。精密吸取供试品1.0 ml,按上述方法平行测定3次,将测得的吸光度带入方程,即得样品的总糖含量。
1.5 糖醛酸含量测定
采用间羟基联苯法测定糖醛酸含量[14],标准曲线制备:取0,0.1,0.2,0.3,0.4,0.5,0.6 ml的葡萄糖醛酸溶液于试管中,然后加水到1.0 ml。在冰水中预冷后加入6 ml Na2B4O7硫酸溶液,涡旋。在沸水浴中反应12 min。冰浴至室温,分别加入间羟基联苯溶液120 μl,涡旋,室温放置40 min,525 nm处测吸光度。以葡萄糖醛酸溶液浓度为横轴,525 nm处的吸光度为纵轴,作图,得到葡萄糖醛酸的线性回归方程y=4.411 9x+0.075 1,R2=0.992 4。
样品测定:将样品配制成100 μg/ml的溶液。精密吸取供试品1.0 ml,按上述方法平行测定3次,将测得的吸光度带入方程,即得样品的糖醛酸含量。
1.6 相对分子质量测定
标准曲线制作:取系列相对分子质量(Mr)右旋糖酐对照品,分别加纯水稀释成5 mg/ml的对照品溶液,每针进样10 μl,流动相为纯水,流速为1.0 ml/min,柱温35 ℃,色谱柱为TSK gel GMPWXL凝胶柱(300 mm×7.8 mm,13 μm)(日本Tosoh Corporation公司),示差折光检测器34 ℃,测得各标准品的保留时间。以保留时间tR为横坐标,lgMw为纵坐标,作标准曲线,得到右旋糖酐对照品线性回归方程lgMw=-0.782tR+12.451,R2=0.999 8。
样品分子量测定:分别精密称取多糖样品5 mg,配制成浓度约为5 mg/ml的样品溶液,每针进样10 μl,流动相为纯水,流速为1 ml/min,柱温35 ℃,示差检测器34 ℃,测得各样品的保留时间。所得保留时间由标准回归方程计算分子量。
1.7 结构分析
1.7.1 单糖组成分析 参照文献[15]方法,对多糖样品进行水解和衍生化,并采用PMP柱前衍生化-高效液相色谱法(HPLC-UV)法测定其单糖组成。
多糖的水解:称取5 mg多糖样品置于水解管中,加2 mol/L三氟乙酸3 ml溶解混匀,密封,置于110 ℃烘箱中加热水解3 h。取出,放置冷至室温后,转移至圆底烧瓶中,浓缩至干。减压条件下反复加入2 ml甲醇,重复3次,去除残余的三氯乙酸。最后将水解产物溶于1 ml纯水中,备用。
单糖对照品的衍生化:参照文献[15]方法配制10 mmol/L的单糖混合对照品溶液,取混合标品0.2 ml至2 ml的EP管中,与0.24 ml 0.5 mol/L的PMP及0.2 ml 0.3 mol/L的NaOH溶液混合放置于恒温金属浴中,70 ℃、300 r/min反应70 min。冷却至室温后加入0.2 ml 0.3 mol/L的HCl进行中和反应,加入1 ml氯仿萃取,离心弃去有机层,重复萃取3次,得到上层水液经0.45 μm微孔滤膜滤过,供HPLC进样。
多糖样品的衍生化:精密吸取多糖水解液0.2 ml按照“单糖对照品的衍生化”项下方法处理后即得,供HPLC进样。
HPLC-UV检测条件:色谱柱为Venusil XBP C18(250 mm×4.6 mm,5 μm;中国天津博纳艾杰尔科技有限公司);流动相A相为磷酸二氢钠缓冲液(pH 6.7,50 mmol/L;B相为乙腈,按A ∶B=82 ∶18等度洗脱;流速1.0 ml/min;柱温35 ℃;检测波长250 nm;进样量20 μl。
1.7.2 甲基化分析 精密称取APS-Ⅰ和APS-Ⅱ样品5 mg;参考文献[16]方法,对APS-Ⅰ和APS-Ⅱ进行甲基化,通过IR确定甲基化程度,甲基化完成后,进行酸水解、还原和乙酰化衍生,采用气相色谱-质谱联用仪(GC-MS)进行分析。
气相条件:以DB-5MS毛细管柱为气相色谱柱,入口温度220 ℃;载气:高纯氦,载气流量:1.0 ml/min,分流设为10 ∶1;温度变化:起点温度是100 ℃;以5 ℃/min升温到180 ℃,1 min;以1 ℃/min升温到190 ℃,2 min;以30 ℃/min升温到220 ℃,2 min;以1 ℃/min升温到230 ℃,2 min;以20 ℃/min升温到280 ℃,10 min。
质谱条件:参照文献[17],电离源:电子轰击源(EI);离子源温度:220 ℃;传输线温度250 ℃;扫描模式为全扫描;扫描范围:m/z30-550。
1.7.3 红外光谱分析 取APS-Ⅰ和APS-Ⅱ样品(2 mg)与KBr粉末混合,压制成片,扫描波长范围在4 000-450 cm-1之间。
1.8 黄芪多糖的抗炎活性实验
1.8.1 MTT法检测药物毒性 参考文献[18]的方法并做适当修改,用含10% FBS胎牛血清的完全培养液将RAW264.7细胞配成单个细胞悬液,以每孔104个细胞的浓度接种到96孔板,每孔体积100 μl。在5% CO2,37 ℃条件下孵育24 h,届时细胞单层铺满孔底。24 h后给药,实验分为:空白组,APS、APS-Ⅰ和APS-Ⅱ多糖给药组,多糖给药组浓度梯度分别为10,25,50,100,250,500 μg/ml。每个浓度的药物设置6个复孔。给药完成后,于培养箱培养24 h。次日取出96孔板,向含细胞的96孔板中每孔加入10 μl 5 mg/ml的MTT试剂,再于培养箱中培养4 h。4 h后小心吸弃MTT试剂,向每孔中加入100 μl DMSO试剂。室温下用摇床振荡10 min,再于酶标仪490 nm下检测每孔吸光度。
1.8.2 ELISA法检测IL-10、NO和TNF-α的水平 用含10% FBS胎牛血清的完全培养液将RAW264.7细胞配成单个细胞悬液,以每孔104个细胞的浓度接种到96孔板,每孔体积100 μl。在5% CO2,37 ℃条件下孵育24 h,届时细胞单层铺满孔底。设置空白组,炎症模型组,以及APS、APS-Ⅰ和APS-Ⅱ多糖给药组(浓度梯度分别为10,25,50,100 μg/ml),每组均设置6个复孔,药物预干预2 h后,炎症模型组与多糖给药组加入适量LPS,使得LPS终浓度为1 μg/ml,对照组加入等量的PBS后继续培养24 h;24 h后取细胞培养基上清液,1 000g,4 ℃,离心15 min,取上清液,根据ELISA试剂盒和NO快速检测盒的说明测定IL-10、NO和TNF-α的生成量。
1.8.3 统计学分析 实验数据用均数±标准差表示,采用Prism 7.00软件进行单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 总糖含量及糖醛酸含量测定
APS、APS-Ⅰ和APS-Ⅱ总糖含量分别为88.2%,74.4%,79.5%;糖醛酸含量分别为11.9%,27.2%,4.6%。
2.2 APS的分离及分子量测定
APS、APS-Ⅰ和APS-Ⅱ的分子量测定结果见图1。通过80%醇沉得到黄芪总多糖APS包含两个不同分子量多糖APS-Ⅰ(大于2 000 kD)和APS-Ⅱ(10 kD),采用超滤膜截留法将APS截取得到APS-Ⅰ和APS-Ⅱ(见图1)。
2.3 黄芪多糖单糖组成测定
根据单糖混合对照品图谱与样品黄芪单糖特征图谱进行对比,可以确定APS-Ⅰ和APS-Ⅱ均由Rha,GalA,Glu,Gal和Ara 5种单糖组成(见图2,3),但各单糖在APS-Ⅰ和APS-Ⅱ中所占的比例有所区别。以阿拉伯糖的物质的量为1,APS-Ⅰ中Rha,GalA,Glu,Gal,Ara的比例约为0.1 ∶0.39 ∶17.2 ∶13.4 ∶1;在APS-Ⅱ中约为0.14 ∶0.14 ∶24.04 ∶9.6 ∶1。

1.甘露糖;2.鼠李糖;3.半乳糖醛酸;4.N-乙酰氨基葡萄糖;5.葡萄糖;6.半乳糖;7.阿拉伯糖;8.岩藻糖图2 单糖标准品的HPLC-UV色谱图Figure 2 Chromatogram of sugar standards by HPLC-UV
2.4 黄芪多糖红外光谱分析
两种多糖的红外光谱见图4,APS-Ⅰ在3 413.04 cm-1处的吸收峰属于-OH的伸缩振动;在3 004.74 cm-1,2 970.30 cm-1处的吸收峰是由于C-H键的拉伸振动引起的;1 715.86 cm-1处的吸收峰归因于C=O的伸缩振动,提示APS-Ⅰ中存在糖醛酸;1 421.09 cm-1和1 363.76 cm-1的吸收峰属于δ-CH2的弯曲振动;1 220.07 cm-1的吸收峰归因于C-O-C的伸缩振动;1 092.28 cm-1的吸收峰表明存在吡喃糖环;901.29 cm-1和785.5 cm-1的吸收峰属于β型糖苷键;即APS-Ⅰ以β型吡喃糖苷键为主。APS-Ⅰ和APS-Ⅱ的红外光谱相似度很高,除含有糖的特征官能团吸收峰外,APS-Ⅱ在1 092.25 cm-1和530.28 cm-1的吸收峰表明存在吡喃糖环;901.26和814.74 cm-1处的峰分别表明存在β和α-糖苷键。综上,APS-Ⅰ以β型糖苷键为主;APS-Ⅱ同时包含α型糖苷键和β型糖苷键;且二者结构中均含有糖醛酸。
2.5 黄芪多糖甲基化分析
APS-Ⅰ和APS-Ⅱ甲基化分析的GC-MS总离子色谱图见图5。通过将甲基化多糖的离子碎片特征与CCRC数据库(https://www.ccrc.uga.edu/specdb/ms/pmaa/pframe.html)比较,得到APS-Ⅰ和APS-Ⅱ的连接方式(见表1,2)。APS-Ⅰ单糖残基连接方式为→4)-L-Ara-(1→,→2)-D-Gal-(1→,→4)-L-Rha-(1→,→6)-D-Glu-(1→,→6)-D-Gal-(1→和→4)-D-Glu-(1→;APS-Ⅱ单糖残基连接方式为→4)-L-Ara-(1→,→3,4)-D-Gal-(1→,→6)-D-Gal-(1→和→4)-D-Glu-(1→。
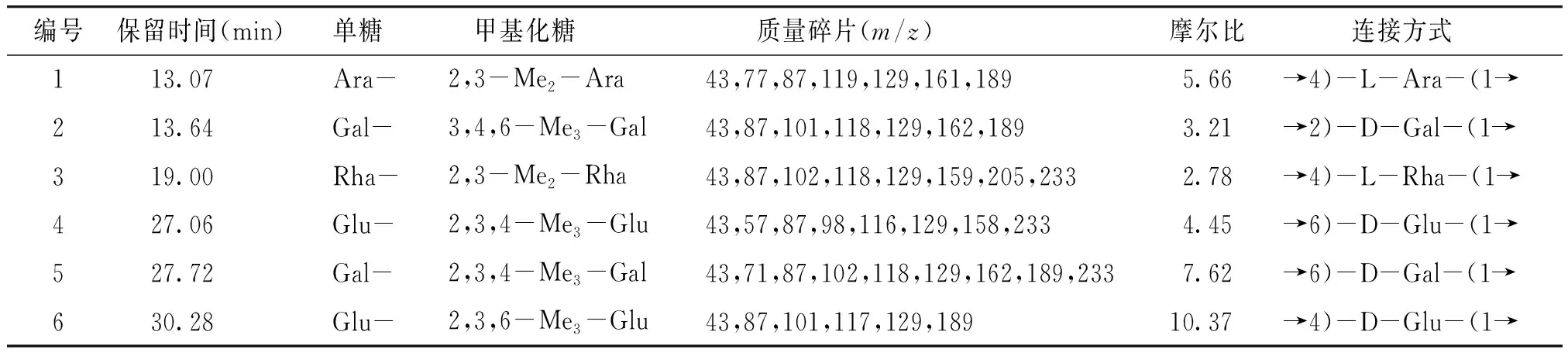
表1 APS-Ⅰ甲基化结果分析Table 1 Results of methylation analysis of APS-Ⅰ
2.6 MTT法检测药物毒性结果
本实验采用MTT法考察了APS、APS-Ⅰ和APS-Ⅱ不同浓度下对RAW264.7细胞存活率的影响,结果显示,3个组分在0-100 μg/ml下与细胞共培养24 h无明显毒性(见图6),因此可在0-100 μg/ml范围内选取合适浓度进行后续炎症因子的测定。

与0 μg/ml相比,*P<0.05图6 不同浓度APS、APS-Ⅰ和APS-Ⅱ的MTT实验结果Figure 6 Effect of different concentrations of APS, APS-Ⅰ and APS-Ⅱ on cell viability by MTT assay

表2 APS-Ⅱ甲基化结果分析Table 2 Results of methylation analysis of APS-Ⅱ
2.7 LPS诱导的RAW264.7炎症细胞模型的建立
LPS作用24 h后进行形态学观察,空白组细胞体积较小,呈边缘明亮的类圆形,偶有细长触角,符合巨噬细胞形态(见图7A);当经1 μg/ml LPS刺激24 h后,模型组细胞体积明显增大并伸出大量伪足,细胞形态呈不规则形状(见图7B)。

图7 1 μg/ml LPS刺激24 h后RAW264.7巨噬细胞形态改变Figure 7 Morphological changes of RAW264.7 macrophages after stimulation with 1 μg/ml LPS for 24 h
2.8 APS、APS-Ⅰ和APS-Ⅱ对小鼠单核巨噬细胞RAW264.7细胞增殖及分泌NO、TNF-α和IL-10的影响
与空白组相比,LPS模型组NO、TNF-α和IL-10的产生显著增加(P<0.05,见图8),说明LPS诱导的小鼠单核巨噬细胞RAW264.7细胞炎症模型可以成功构建。
由图8可知,APS和APS-Ⅰ均可抑制LPS模型组产生NO。APS为100 μg/ml时,抑制NO产生的作用最强;APS-Ⅰ为100 μg/ml时,抑制NO产生的作用最强。APS和APS-Ⅰ最佳剂量组与模型组比较差异有统计学意义(P<0.05),均能显著抑制NO的产生。APS-Ⅱ可促进LPS模型组产生NO,APS-Ⅱ为100 μg/ml时,促进NO产生的作用最强,与模型组比较差异有统计学意义(P<0.05)。不同分子量组分抑制NO产生的活性顺序为APS-Ⅰ>APS>APS-Ⅱ。

与空白组相比,*P<0.05;与模型组相比,#P<0.05图8 APS、APS-Ⅰ和APS-Ⅱ对RAW264.7细胞释放NO的影响Figure 8 Effects of APS, APS-Ⅰ and APS-Ⅱ on NO in RAW264.7 cells
由图9可知,APS、APS-Ⅰ和APS-Ⅱ均可抑制LPS模型组产生TNF-α。APS为100 μg/ml时,抑制TNF-α产生的作用最强;APS-Ⅰ为100 μg/ml时,抑制TNF-α产生的作用最强;APS-Ⅱ为50 μg/ml时,抑制TNF-α产生的作用最强。APS和APS-Ⅰ最佳剂量与模型组比较差异有统计学意义(P<0.05),均能显著抑制TNF-α的产生。不同分子量组分抑制TNF-α产生的活性顺序为APS-Ⅰ>APS>APS-Ⅱ。

与空白组相比,*P<0.05;与模型组相比,#P<0.05图9 APS、APS-Ⅰ和APS-Ⅱ对RAW264.7细胞释放TNF-α的影响Figure 9 Effects of APS, APS-Ⅰ and APS-Ⅱ on TNF-α in RAW264.7 cells
由图10可知,APS在0-50 μg/ml时可以促进IL-10的产生。APS为25 μg/ml时,促进IL-10产生的作用最强,与模型组比较差异有统计学意义(P<0.05)。APS在50-100 μg/ml时可以抑制IL-10的产生。APS为100 μg/ml时,抑制IL-10产生的作用最强,与模型组比较差异有统计学意义(P<0.05)。APS-Ⅰ可促进LPS模型组产生IL-10。APS-Ⅰ为50 μg/ml时,促进IL-10产生的作用最强,与模型组比较差异有统计学意义(P<0.05)。APS-Ⅱ可抑制LPS模型组产生IL-10。APS为100 μg/ml时,抑制IL-10产生的作用最强;与模型组比较差异有统计学意义(P<0.05)。不同分子量组分促进IL-10产生的活性顺序为APS-Ⅰ>APS>APS-Ⅱ。
综上所述,APS-Ⅰ的体外抗炎活性优于APS-Ⅱ。
3 讨论
黄芪多糖是黄芪药材中含量最多、免疫活性最强的一类物质。大量研究表明,黄芪多糖具有免疫双向调节功能[5-10]。然而目前的研究大多以黄芪总多糖作为研究对象,并未进行分离制备。课题组前期根据黄芪多糖主要由两组不同分子量多糖部位组成的特点,通过超滤膜分离手段将两个组分分离制备,得到APS-Ⅰ(分子量大于2 000 kD)和APS-Ⅱ(分子量约为10 kD)两个组分,并从细胞水平和动物水平筛选出了APS-Ⅱ是发挥免疫促进作用的主要组分;而两个组分在免疫抑制过程中的药理作用尚不清楚。
大量研究表明,结构是影响多糖发挥生物活性的主要因素[19]。因此,本文从结构表征以及抗炎活性两个方面对分离得到的两种多糖进行了研究。
本研究结果显示,多糖结构分析显示:APS-Ⅰ(大于2 000 kD)和APS-Ⅱ(10 kD)分子量差异明显。从单糖组成上看,二者均由Rha,Gal A,Gal,Glu和Ara 5种单糖组成,但是其单糖含量比例差异明显,APS-Ⅰ中Gal A和Gal的比例要远高于APS-Ⅱ;糖醛酸含量测定发现,APS-Ⅰ糖醛酸含量远高于APS-Ⅱ,约为其6倍,与单糖组成结果一致。红外光谱一般可以得到多糖取代官能团的结构与位置,糖残基构型等,APS-Ⅰ和APS-Ⅱ的红外光谱相似度很高,除含有糖的特征官能团吸收峰外,二者结构中均含有糖醛酸,与文献结果一致[20-23]。甲基化分析可知,二者具有不同的糖连接方式,APS-Ⅰ主要的连接方式为→4)-D-Glu-(1→,→6)-D-Gal-(1→和→4)-L-Ara-(1→,APS-Ⅱ主要的连接方式为→4)-D-Glu-(1→,→3,6)-D-Glu-(1→和→3,4)-D-Gal-(1→。
多糖抗炎活性分析显示:NO是炎症反应中生成的重要炎症因子,介导炎症等疾病的发生,其含量可以作为炎症反应程度的指标[24],APS-Ⅰ在质量浓度为0-100 μg/ml时显著抑制NO的产生,抑制效果优于APS-Ⅱ。TNF-α是炎症反应中主要促炎细胞因子,可调节细胞的生长分化、调节免疫应答,具有重要的生物功能[25],本研究结果显示,APS-Ⅰ在质量浓度为0-100 μg/ml时显著抑制TNF-α的产生,抑制效果优于APS-Ⅱ。IL-10是一种多细胞源性的细胞因子,其中单核细胞、巨噬细胞是其主要来源细胞。在控制病原体和微生物造成的炎症反应中,IL-10具有抗炎、免疫抑制、负反馈调节的生物学功能[26],本研究结果显示,APS-Ⅰ在质量浓度为0-100 μg/ml时显著促进IL-10的产生,促进效果优于APS-Ⅱ。由此可知,APS-Ⅰ的体外抗炎活性优于APS-Ⅱ。
近年来有研究表明,酸性多糖具有较好的抗炎活性。袁雷等[27]从血满草中分离得到一种酸性多糖SPS-1,并对其进行硫酸化修饰得到SSPS-1,体外抗炎实验发现,二者均可显著降低LPS诱导的RAW264.7细胞促炎因子IL-1β,IL-6和TNF-α的分泌,并能显著增加抗炎因子IL-10的分泌。朱燕等[28]从芦荟中分离得到一种酸性多糖,并采用二甲苯致小鼠耳肿胀模型检测其抗炎活性,结果发现芦荟酸性多糖对二甲苯所致的小鼠耳肿胀有明显的缓解作用,表现出较好的抗炎活性。Kuang等[29]从麻黄根茎中分离得到一种酸性杂多糖,体内免疫学试验表明,麻黄多糖具有低毒和强烈的免疫抑制作用,这可能与其抑制血清中的IL-2和IL-4水平以及降低小鼠血清中的CD4+/CD8+比值。本研究发现APS-Ⅰ糖醛酸含量远高于APS-Ⅱ,约为其6倍,提示这可能是APS-Ⅰ体外抗炎活性优于APS-Ⅱ的重要原因。
在课题组前期研究基础上,本文通过体外活性筛选实验找到了APS中抗炎活性较好的主要组分APS-Ⅰ,进一步对APS-Ⅰ的一级结构进行了解析,一定程度上解释了APS的抗炎活性构效关系。然而本文也存在一些不足之处,从多糖结构上看,仅仅只从分子量,单糖组成和糖连接方式3个角度进行了解析,后续可以进行糖序列以及高级结构解析;从多糖抗炎活性上看,仅从细胞水平上筛选出抗炎组分,后续应在炎症动物模型上验证该结论,并可以利用多组学技术探究APS-Ⅰ发挥抗炎活性的作用机制。
