Rho蛋白激酶抑制剂对体外ECM介导的牙周膜细胞功能的作用
2021-11-18西北妇女儿童医院口腔科西安7006西安交通大学附属口腔医院修复科通讯作者mailjiaru987mailxjtueducn
兰 婷,贾 如(西北妇女儿童医院口腔科,西安 7006;西安交通大学附属口腔医院修复科;通讯作者,E-mail:jiaru987@mail.xjtu.edu.cn)
牙周炎涉及牙齿周围支持的结缔组织和牙槽骨的丧失,是一种多因素的慢性感染性疾病[1]。牙周膜是一种多功能的软结缔组织,在牙周组织的动态平衡中起着至关重要的作用[2]。牙周膜细胞(periodontal ligament cells, PDL)由不同功能特征的异质成纤维细胞群组成[3]。在各种外刺激的作用下,PDL细胞最终产生更多的分化细胞,这些细胞可以合成邻近的骨、牙骨质和牙周膜的细胞外基质(extracellular matrix, ECM)[4]。ECM包含Ⅰ型和Ⅲ型胶原、纤维连接蛋白[5]。文献表明,Ⅰ型胶原蛋白是牙周细胞外基质的主要成分,对成骨的诱导和动态平衡必不可少[6]。纤维连接蛋白是一种多结构域蛋白,能够与胶原蛋白结合,通过促进细胞黏附和迁移并在伤口修复中发挥重要作用[7]。因此,外源性Ⅰ型胶原和纤维连接蛋白可能调节Rho信号,从而促进PDL细胞的分化。文献表明,PDL细胞具有多种成骨特性,如碱性磷酸酶(alkaline phosphatase, ALP)的基因表达,以及形成矿化结节的能力[8]。
哺乳动物Rho鸟苷三磷酸酶(Rho GTPase)是细胞骨架动力学的关键调节因子,影响许多细胞过程,包括形态发生、极性、迁移和细胞分裂[9]。Rho蛋白激酶(Rho protein kinase, ROCK)参与调节肌动蛋白的细胞骨架组织[10]。有研究表明,ROCK在诱导PDL细胞成骨分化中具有重要作用[11]。盐酸土根碱(emetine dihydrochloride, EmD)是一种从吐根根部提取的主要生物碱,在临床上被用作催吐以及抗原生动物的主要治疗药物,可显著抑制ALP活性、基质矿化和Rho蛋白激酶(ROCK1和ROCK2)的活性[12]。然而,Rho通过改变ECM基因表达诱导PDL细胞分化的机制尚不清楚。本研究旨在探究ROCK抑制剂EmD在体外ECM介导的PDL细胞增殖、迁移、愈合和成骨分化过程中可能的作用和机制。
1 材料和方法
1.1 材料
α-MEM培养基、DMEM培养基、成骨分化培养基、谷氨酰胺和青霉素抗生素购于Gibco公司(美国);EmD购于MedChemExpress公司(美国);胎牛血清购于Thermo公司(美国);Ⅱ型分散酶购于上海翊圣生物科技有限公司;Ⅰ型胶原酶购于Invitrogen公司(美国);MTS分析试剂盒购于普洛麦格(北京)生物技术有限公司;96孔板、24孔板、6孔板和10 cm培养皿购于Corning公司(美国);Lab Assay ALP试剂盒购于Whatman(沃特曼)公司(英国);RIPA裂解缓冲液购于南京森贝伽生物科技有限公司公司;Bradford蛋白质测定试剂盒购于上海酶联科研;RNease Mini试剂盒购于QIAGEN公司(德国);SYBR Green PCR Master Mix试剂盒购于Thermo公司(美国);Ⅰ型胶原蛋白前体、纤连蛋白、碱性磷酸酶和丝状肌动蛋白一抗和二抗IgG购于Abcam公司(英国);化学发光底物(ECL)购于Thermo公司(美国)。
1.2 方法
1.2.1 细胞培养及分组 牙周膜样本取自2019年1月至2019年6月间西北妇女儿童医院口腔科收治的5名牙周组织健康的提供者。将取得的健康牙周组织在2 mg/ml Ⅱ型分散酶和4 mg/ml Ⅰ型胶原酶的溶液中进行消化,并在37 ℃下放置1 h。取消化后的溶液,制备成PDL单细胞悬液(在10 cm培养皿中为1×104个),并于α-MEM培养基中培养(补充20%胎牛血清、2 mmol/L谷氨酰胺和100 U/ml青霉素抗生素)。当需要检测PDL细胞成骨分化能力时,则将α-MEM培养基换为成骨分化培养基。为了研究不同组分对PDL细胞的影响,根据实验设计,将细胞分为4组:PDL组,无ECM包被的PDL细胞培养于不含EmD的培养基;PDL+ECM组,有ECM包被的PDL细胞培养于不含EmD的培养基;PDL+ECM+EmD组,ECM包被的PDL细胞培养于含10 μmol/L EmD的培养基;PDL+EmD组,无ECM包被的PDL细胞培养于含10 μmol/L EmD的培养基。本研究均获得每位受试者的知情同意,本项研究得到了西北妇女儿童医院医学伦理委员会的批准(批准号:No.2019-1-23-1016)。
1.2.2 PDL细胞活力测定 为了检测PDL细胞的活力,使用含有四唑化合物[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲氧基苯基)-2-(4-磺苯基)-2H四唑内盐]的MTS分析试剂盒评估各分组中PDL细胞的活力。将PDL细胞以每孔5×103个细胞的密度接种到含成骨培养基的96孔板中,并孵育24 h。然后使用浓度为0,1,5,10,20,50,75,100 μmol/L的EmD处理PDL细胞。孵育48 h和14 d后,根据试剂盒使用说明书进行显色,使用酶标仪检测490 nm处的吸光度。
1.2.3 PDL细胞成骨分化及ECM介导的成骨分化培养 为了检测PDL组和PDL+EmD组PDL细胞的成骨分化能力,将PDL细胞以每孔5×103个细胞的密度接种于α-MEM培养基中,并培养至80%-90%的细胞融合,然后将培养基替换为成骨分化培养基(含50 μmol/L抗坏血酸-2-磷酸、10 nmol/L β-磷酸甘油和100 nmol/L地塞米松)继续培养14 d,同时每隔2~3 d更换1次培养基,PDL+EmD组培养基加入10 μmol/L EmD。使用显微镜检测PDL组和PDL+EmD组中PDL细胞形态学变化及矿物沉积情况。为实现ECM诱导成骨分化,将细胞接种于ECM涂层平板,其余操作同上。
1.2.4 碱性磷酸酶(ALP)的活性测定 为了检测PDL组和PDL+EmD组PDL细胞中ALP的活性,将PDL细胞在6孔未包被或ECM包被的培养皿中进行成骨分化培养,PDL+EmD组培养基加入10 μmol/L EmD,并分别在成骨分化培养的第0,2,4,6,8,10,12,14天后收获。使用RIPA裂解缓冲液提取总细胞裂解物,根据Lab Assay ALP试剂盒操作说明对ALP活性进行定量分析,裂解物的ALP活性由对硝基苯磷酸释放的对硝基苯酚的量确定,并使用酶标仪测量490 nm处的吸光度。
1.2.5 实时RT-PCR测定ALP的mRNA表达水平 为了检测PDL组和PDL+EmD组PDL细胞中ALP的mRNA表达水平,采用实时RT-PCR进行检测。将PDL细胞在6孔未包被或ECM包被的培养皿中进行成骨分化培养,PDL+EmD组培养基加入10 μmol/L EmD,并分别在成骨分化培养的第0,2,4,6,8,10,12,14天后收获。根据使用说明书,采用RNease Mini试剂盒,从PDL细胞中提取RNA,并进行蛋白酶K和DNase I处理。使用由ABI 7300实时PCR系统SuperScript Ⅲ和SYBR Green PCR Master Mix试剂盒逆转录为cDNA,并进行定量RT-PCR分析。ALP-F:5′-CCTCCTCGGAAGACACTCTG-3′,ALP-R:5′-GCAGTGAAGGGCTTCTTGTC-3′;GAPDH-F:5′-GAGTCAACGGATTTGGTCGT-3′,GAPDH-R:5′-GACAAGCTTCCCGTTCTCAG-3′。扩增程序为:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火15 s,72 ℃延伸20 s,进行40个循环。相对于GAPDH mRNA的表达,在归一化后显示ALP mRNA相对表达水平,并使用2-ΔΔCt法对数据进行量化。
1.2.6 免疫荧光分析Ⅰ型胶原和纤连蛋白 为了检测PDL组和PDL+EmD组PDL细胞中Ⅰ型胶原蛋白和纤连蛋白的表达水平,采用免疫荧光进行检测分析。将PDL细胞在含有成骨培养基的8孔室中分化培养14 d,PDL+EmD组培养基加入10 μmol/L EmD,然后在4%甲醛/磷酸盐缓冲液中固定。随后将样品与一抗Ⅰ型胶原蛋白前体(Procollagen-Ⅰ,1 ∶50)、纤连蛋白(Fibronectin,1 ∶250)和丝状肌动蛋白(F-actin,1 ∶100))孵育过夜,然后使用Alexa Fluor 488标记的二抗(1 ∶500)孵育1 h。使用4′,6-二基-2-苯基吲哚(DAPI)进行细胞核染色,最后使用荧光显微镜(Olympus)进行观察。
1.2.7 蛋白质印迹分析Ⅰ型前胶原蛋白和纤连蛋白的表达水平 为了检测PDL组和PDL+EmD组PDL细胞中Ⅰ型胶原蛋白和纤连蛋白的表达水平,采用蛋白质印迹方法进行检测分析。将PDL细胞先在12孔非包被板中培养至融合度为80%-90%,并在成骨分化培养基中培养14 d后收集细胞,PDL+EmD组培养基加入10 μmol/L EmD。使用RIPA裂解缓冲液对细胞进行裂解处理,并使用Bradford蛋白质测定试剂盒测定蛋白质总量,将每个样品(30 μg)总蛋白进行SDS-PAGE电泳。然后转移至PVDF膜上,使用5%脱脂奶粉封闭1 h,洗去非特异性吸附,然后使用一抗Ⅰ型前胶原蛋白(Procollagen-Ⅰ,1 ∶500)、纤连蛋白(Fibronectin,1 ∶1 000)、ALP(1 ∶1 000)和GAPDH(1 ∶1 000)于4 ℃孵育过夜。然后使用TBST缓冲液清洗3次,并于室温孵育二抗IgG(1 ∶5 000)1 h,并再次使用TBST缓冲液清洗3次。使用化学发光底物(ECL)孵育上述PVDF膜,使用ChemiDocTMMP系统和ImageLab软件(Bio-Rad)检测蛋白条带并进行定量分析。
1.2.8 PDL细胞增殖测定 为了检测PDL组、PDL+EmD组、PDL+ECM+EmD和PDL+EmD组中PDL细胞增殖情况,采用MTS分析试剂盒进行检测。将PDL细胞在含成骨培养基的96孔未包被或ECM包被的培养皿中培养14 d。其具体方法为:将PDL细胞以每孔5×103个细胞的密度接种到含成骨培养基的96孔未包被或ECM包被的培养皿中,并孵育24 h。按照分组分别使用浓度为10 μmol/L的EmD处理或不处理PDL细胞。然后孵育14 d后,根据MTS分析试剂盒使用说明书进行显色,使用酶标仪检测490 nm处的吸光度。
1.2.9 ALP菌落阳性效率测定 为了检测PDL组、PDL+EmD组、PDL+ECM+EmD和PDL+EmD组中PDL细胞增殖情况,使用ALP活性分析试剂盒进行检测。将PDL细胞以1×103个细胞/孔的接种密度接种在含成骨培养基的6孔未包被或ECM包被的培养皿中,按照分组要求用0,10 μmol/L的EmD处理PDL细胞。14 d后,将细胞在4%多聚甲醛中固定30 min。然后用结晶紫染色5 min后,使用照相机及显微镜对细胞菌落进行计数并评估菌落形成能力。
1.2.10 PDL细胞迁移和愈合能力测定 为了检测PDL组、PDL+EmD组、PDL+ECM+EmD和PDL+EmD组中PDL细胞迁移和愈合能力,使Transwell和伤口愈合实验进行分析。在24孔未包被或ECM包被的孔径为8 μmol/L的聚碳酸酯膜的Transwell腔室中评估EmD对PDL细胞迁移的能力。于上腔室中加入200 μl含1×105个细胞的0.1% FBS的DMEM培养基,在下腔室中加入500 μl含0,10 μmol/L EmD的0.1% FBS的DMEM中。于37 ℃孵育20 h,除去膜上层未迁移细胞后,将已迁移通过膜的细胞固定在4%多聚甲醛中,用0.1%结晶紫染色,并于显微镜中观察和计数。
在伤口愈合试验中,将PDL细胞接种在未包被或ECM包被的培养皿中上,培养至融合度为90%。在血清饥饿24 h后,使用无菌移液管吸头刮擦单层。然后将含有0或10 μmol/L EmD和0.1% FBS的培养基加入到每个平板中。使用显微镜(Olympus)于0 h和12 h在相同位置拍摄细胞迁移的距离,使用Image Pro Plus 6.0软件测量和计算细胞迁移的距离。
1.3 数据分析
2 结果
2.1 ROCK抑制剂EmD对PDL细胞活力的影响
MTS检测ROCK抑制剂EmD对PDL细胞活力的结果表明,当EmD的使用浓度为0-10 μmol/L,培养48 h后PDL细胞的活力基本不受影响;当EmD的使用浓度超过10 μmol/L,PDL细胞的活力开始降低,当浓度超过50 μmol/L时,PDL细胞活性受到显著抑制(P<0.05,见图1)。使用10 μmol/L EmD培养PDL细胞14 d后,PDL细胞活力稳定,这表明10 μmol/L的EmD对PDL细胞进行长期处理不会对细胞活力产生显著影响。

A.MTS定量分析不同EmD浓度处理48 h后对细胞活力的影响 B.MTS定量分析不同EmD浓度处理14 d后细胞活力的影响与0 μmol/L EmD相比,*P<0.05,**P<0.01图1 EmD对PDL细胞活力的影响Figure 1 The effect of EmD on the viability of PDL cells
2.2 ROCK抑制剂EmD对PDL细胞中碱性磷酸酶表达水平和活性的影响
ALP的表达水平和活性检测结果显示,从第8天开始,与PDL组相比,PDL+EmD组细胞中ALP的表达水平显著降低(P<0.05);从第10天开始,与PDL组相比,PDL+EmD组细胞中ALP的活性显著下降(P<0.01,见图2)。成骨细胞分化结果表明,PDL组中PDL细胞表现出明显的矿化作用;与PDL组相比,PDL+EmD组PDL细胞分化降低,矿化作用仍保持较低水平。这表明在PDL细胞的成骨分化过程中,ROCK抑制剂EmD部分抑制了ALP活性(见图3)。

与PDL组相比,*P<0.05,**P<0.01,***P<0.001图2 EmD显著抑制ALP的表达和活性Figure 2 EmD significantly inhibited the expression and activity of ALP

图3 EmD对PDL细胞成骨分化过程中细胞形态学的影响Figure 3 Effects of EmD on the morphology of PDL cells during osteogenic differentiation
2.3 ROCK抑制剂EmD对PDL细胞中Ⅰ型胶原和纤连蛋白表达水平的影响
免疫荧光分析结果表明,PDL组中PDL细胞以高密度多层生长;与PDL组相比,PDL+EmD组出现更细的肌动蛋白丝。Ⅰ型胶原蛋白前体染色结果显示,PDL组纤连蛋白位于细胞表面、核周区域和细胞外空间;与PDL组相比,PDL+EmD组Procollagen-Ⅰ和Fibronectin蛋白的免疫反应性显著减弱。Western blotting分析结果显示,与PDL组相比,PDL+EmD组的Procollagen-Ⅰ和Fibronectin蛋白的表达水平显著降低(P<0.01),ALP蛋白表达水平差异无统计学意义(P>0.05,见图4和图5)。

与PDL组相比,*P<0.05,**P<0.01图5 Western blotting分析检测Procollagen-Ⅰ、Fibronectin和ALP的蛋白表达水平Figure5 The protein expression levels of Procollagen-Ⅰ, Fibronectin and ALP detected by Western blotting
2.4 ROCK抑制剂EmD对ECM介导的PDL细胞增殖的影响
将原代培养的PDL细胞的单细胞悬液培养21 d后,与PDL组相比,PDL+ECM组PDL细胞增殖活力均显著升高(P<0.05),PDL+EmD组ALP阳性菌落的出现率和PDL细胞增殖活力差异均无统计学意义(P>0.05);与PDL+ECM相比,PDL+ECM+EmD组ALP阳性菌落的出现率和PDL细胞增殖活力均显著降低(P<0.05,见图6)。这些结果表明,ECM(胶原蛋白Ⅰ和纤连蛋白)外源刺激加速了细胞增殖,而EmD有效地降低了ECM介导的PDL细胞中ALP活性,从而抑制ECM介导的PDL细胞增殖。
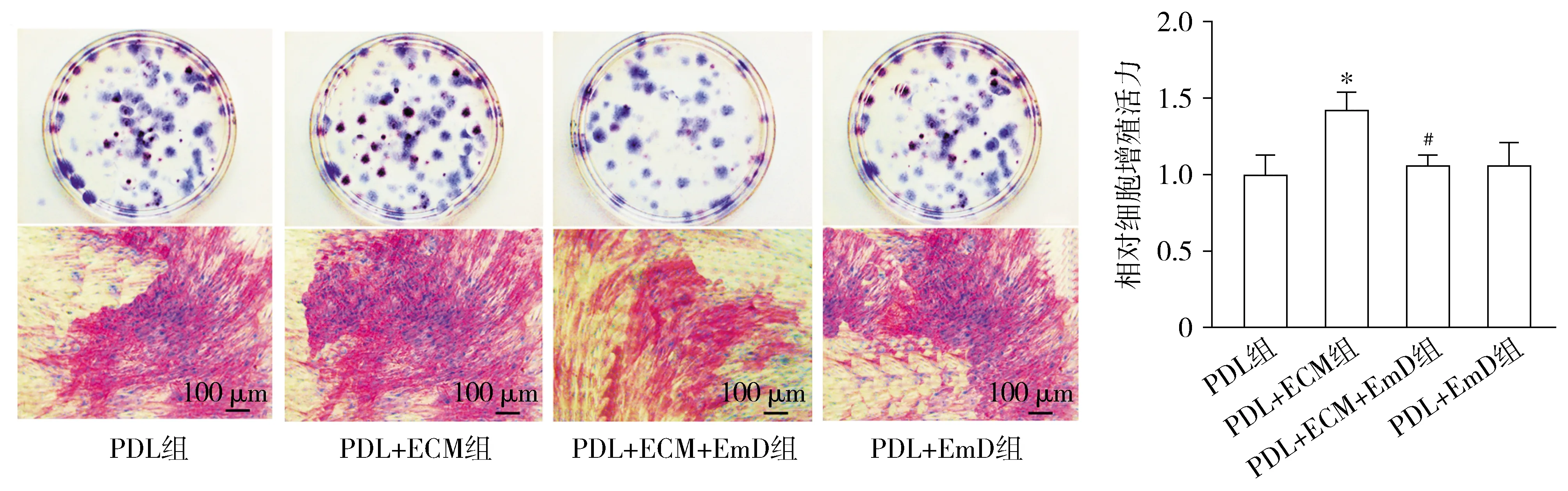
A.原代培养PDL细胞的单细胞悬液ALP阳性菌落分析 B.MTS分析PDL细胞增殖情况与PDL组相比,*P<0.05;与PDL+ECM组相比,#P<0.05图6 PDL增殖及ALP阳性菌落分析Figure 6 Analysis of cell proliferation and ALP positive colonies
2.5 ROCK抑制剂EmD对ECM介导的PDL细胞迁移和愈合能力的影响
与PDL组相比,PDL+ECM组PDL细胞迁移和愈合能力显著升高(P<0.01),PDL+EmD组PDL细胞迁移和愈合能力差异均无统计学意义(P>0.05);与PDL+ECM组相比,PDL+ECM+EmD组的PDL细胞迁移和愈合能力显著降低(P<0.01,见图7)。

与PDL组相比,**P<0.01;与PDL+ECM组相比,##P<0.01图7 EmD对PDL细胞迁移及愈合能力影响Figure 7 Influence of EmD on the migration and healing abilities of PDL cells
2.6 ROCK抑制剂EmD对ECM介导的PDL细胞成骨分化的影响
与PDL组相比,PDL+ECM组细胞的ALP活性显著升高(P<0.01),PDL+EmD组细胞的ALP活性显著降低(P<0.01);与PDL+ECM组相比,PDL+ECM+EmD组细胞的ALP活性显著降低(P<0.01,见图8)。该结果表明EmD显著抑制ECM介导的成骨分化。

与PDL组相比,***P<0.001;与PDL+ECM组相比,###P<0.001图8 EmD对ECM介导的成骨分化的影响Figure 8 Effect of EmD on ECM-mediated osteogenic differentiation
3 讨论
文献表明,可溶性和细胞外基质(ECM)分子可调节PDL细胞的分化[13]。为了了解PDL细胞成骨分化是否需要ROCK激活,本研究使用ROCK抑制剂EmD进行了抑制试验,以消除ROCK的活性。MTS分析结果表明,低浓度的EmD处理可维持PDL细胞的正常增殖,而高浓度的EmD则明显抑制PDL细胞的增殖和活力。当使用10 μmol/L的EmD处理时,即使连续培养14 d,也不影响PDL细胞的活力,这说明使用该浓度对PDL的细胞活力并不影响。
另外,文献表明,PDL细胞具有成骨特性[14]。在本研究中,通过检测早期成骨标志物碱性磷酸酶表达,以监测PDL细胞的分化进程。碱性磷酸酶的表达在第14天达到高峰,而PDL+EmD组细胞中碱性磷酸酶的表达水平、碱性磷酸酶的活性和矿化水平均受到显著抑制。尽管EmD处理后碱性磷酸酶蛋白水平和碱性磷酸酶活性变化之间的差异的原因尚不清楚,但研究表明,碱性磷酸酶活性的降低与PDL细胞中钙沉积的减少有关[15]。这些结果间接表明,ROCK抑制剂EmD抑制了PDL细胞肌动蛋白细胞骨架的稳定,抑制了PDL细胞成骨的启动和进展。
研究表明,成骨细胞在分化和表达成骨细胞相关基因之前,通常优先表达ECM成分的编码基因,如编码胶原和纤维连接蛋白的基因[16]。文献表明,PDL细胞的成骨分化涉及ECM成分基因表达的改变[17]。ECM除了提供结构性支持外[18],还有许多作用;如ECM是细胞微环境的重要组成部分,与各种细胞外刺激(如生长因子和激素)在调节细胞分化方面起着至关重要的作用[19]。据报道,细胞通过整合素与ECM黏附,激活引导成骨细胞分化的细胞间信号通路[20]。而ECM成熟需要ECM微环境协同促进分化及伴随ALP表达的增加[21]。ECM增加Rho/ROCK信号依赖的成骨转录因子Rho/ROCK的表达水平,这种转录因子称为矮小相关转录因子2,并可以调节ALP启动子的活性[22]。因此,我们推测ROCK抑制剂EmD下调了ECM相关基因的表达水平,从而间接降低了ALP的表达水平。本研究表明,ROCK抑制剂EmD抑制了PDL细胞中Ⅰ型胶原和纤维连接蛋白的蛋白表达水平,同时肌动蛋白应激纤维形成显著减少。免疫荧光分析结果表明,ROCK抑制剂EmD显著减弱了Ⅰ型胶原蛋白前体和纤连蛋白的免疫反应性。这些结果间接表明,ROCK抑制剂抑制了ECM连接的肌动蛋白细胞骨架重排和PDL细胞的成骨分化水平。
牙周膜由处于不同分化阶段的不同细胞群组成[23]。文献表明,连续酶消化分离的PDL细胞表现出不同的增殖、碱性磷酸酶和矿化活性[24]。另外,在体内ALP活性和Ⅰ型胶原表达在邻近骨骼的PDL中表现最强,而在邻近骨骼的PDL中细胞增殖不显著[25]。文献表明,ECM和细胞骨架结构有助于调节Rho活性[26]。这些数据清楚地表明,ROCK信号通过协同增加PDL细胞中Ⅰ型胶原和纤维连接蛋白水平来调节成骨分化。
细胞通过整合素与ECM黏附,有助于细胞外刺激在细胞质和细胞骨架内的传递,并诱导成骨分化[27]。整合素介导的细胞与ECM的黏附也提供了细胞增殖所必需的细胞内信号[28]。本研究结果表明,ECM外源刺激加速了细胞增殖,而ROCK抑制剂EmD有效地降低了ALP活性,从而抑制ECM介导的细胞增殖。细胞迁移和愈合能力结果显示,ECM外源刺激加速了细胞迁移和愈合能力,而ROCK抑制剂EmD有效地抑制了ECM介导的细胞迁移和愈合能力。
综上所述,本研究表明,在成骨分化过程中,ROCK在PDL细胞的ECM微环境中起着核心作用。ROCK抑制剂EmD可以减弱骨诱导反应,如碱性磷酸酶活性、F-肌动蛋白聚合和ECM(Ⅰ型胶原和纤维连接蛋白)的表达。因此,ROCK信号是控制PDL细胞和ECM之间动态界面的重要介质,在成骨分化过程中调节由内而外和由外而内的信号。牙周ECM可能通过依赖于ROCK并影响ECM基因表达的机制来介导PDL细胞的成骨分化,并保证细胞正常的增殖及愈合。
