维生素D3通过miR-145抑制胃癌细胞的迁移
2021-11-18李嘉熙赵敏超李家良常素娥西安交通大学第二附属医院精准医疗研究院西安710004通讯作者mailsuechangxjtueducn
李嘉熙,赵敏超,李家良,常素娥(西安交通大学第二附属医院精准医疗研究院,西安 710004;通讯作者,E-mail:suechang@xjtu.edu.cn)
胃癌(gastric cancer,GC),是世界十大恶性肿瘤之一。据2020年WHO全球癌症统计数据,胃癌的发病率和死亡率分别居第五位和第四位,其中胃癌发病108万(占5.6%),胃癌死亡77万(占7.7%),在我国恶性肿瘤中排第3位和第2位,占全球比接近一半[1]。近年来靶向治疗和新辅助化疗作为新型治疗方法一定程度上改善了患者预后,且随着社会经济的发展和生活方式的改变,我国胃癌的死亡率和发病率总体呈逐渐下降趋势,但是有明确的分子机制研究且可方便采取的干预措施相对较少,因此维生素D对胃癌发生发展的作用机制研究对人类防治胃癌提供依据有着重要的意义。
维生素D3是一种人体必需的营养物质,近年来基础和临床医学研究表明,维生素D3缺乏会提高多种肿瘤疾病发生的风险[2,3],尤其是消化道癌症疾病[4]。维生素D3为一种固醇类衍生物,其活性形式1,25(OH)2D3(1alpha,25-dihydroxyvitamin D3)主要通过和维生素D受体(vitamin D receptor,VDR)结合,再与视黄醇X受体(retinoid X receptor,RXR)形成异源二聚体,在胞核中识别维生素D反应元件(vitamin D response elements,VDREs),从而激活或抑制靶基因的转录,调节肿瘤细胞的增殖、凋亡、分化、迁移、侵袭和血管生成[5,6]。近年研究发现维生素D3也会以直接或间接地方式调控多种miRNAs(microRNAs)的表达水平[7],而miRNAs作为一类长20 nt左右的非编码小分子RNA,广泛存在于真核生物中,胃癌中存在多种miRNAs的异常表达参与胃癌细胞的发生和发展。本研究从维生素D3影响胃癌细胞中miRNA表达入手,研究维生素D3对胃癌细胞迁移的调控机制,为维生素D3在胃癌中的分子机制提供新的理论依据。
1 材料与方法
1.1 主要试剂和材料
维生素D3粉末、结晶紫购自北京索莱宝科技有限公司,RPMI-1640培养基购自美国HyClone公司,胰酶购自山东思科捷科学仪器有限公司,胎牛血清购自美国GEMINI公司,PBS购自GIBCO公司,miR-145抑制剂和引物购自上海生工生物工程有限公司,Lipofectamine2000、Trizol购自Invitrogen公司,二甲基亚砜(DMSO)购自Sigma公司,逆转录试剂盒、荧光定量PCR试剂盒购自宝生物工程(大连)有限公司。6孔板、12孔板、24孔板、培养瓶、冻存管购自美国Corning公司,Transwell小室购自Millpore公司。AGS、BGC-823、SGC-7901和GES-1细胞均受赠于西安交通大学生物医学实验中心。
1.2 细胞培养
胃癌细胞AGS、BGC-823、SGC-7901和正常GES-1细胞用RPMI-1640培养基(含10%胎牛血清)培养,将培养瓶置于37 ℃、5% CO2及适宜湿度的培养箱中,每天观察细胞生长状态,隔天换液或传代培养。
1.3 细胞转染和维生素D3处理
为观察维生素D3对胃癌细胞迁移能力的影响,将胃癌细胞SGC-7901分为对照组和维生素D3组。将细胞种到12孔培养板内,待细胞达到70%汇合度,分别加入DMSO和维生素D3(终浓度500 nmol/L),然后用Transwell迁移实验检测胃癌细胞迁移能力。
为观察维生素D3作用的分子通路,将胃癌细胞SGC-7901分为对照组、维生素D3组、miR-145抑制剂组和联合处理组。先将细胞种到12孔培养板内,待细胞汇合度达到70%左右,用DMSO处理对照组和miR-145抑制剂组,用维生素D3(终浓度500 nmol/L)处理维生素D3组和联合处理组,1 d后再将miR-145抑制剂用lipo2000依照说明书转染至miR-145抑制剂组和联合处理组细胞,然后用Transwell迁移实验检测细胞迁移能力。
1.4 RNA提取、逆转录和qRT-PCR检测VDR表达水平
提取胃癌细胞系AGS、BGC-823、SGC-7901和正常GES-1细胞的RNA,反转录为cDNA,以GES-1组为对照组,应用实时定量PCR实验检测VDR在胃癌细胞系中的相对表达量。具体操作步骤见下:①RNA提取:将细胞分别种在6孔板中,待细胞状态良好,达到90%汇合度,每孔加入Trizol 1 ml,依次加入氯仿,离心后收集水相,加入异丙醇,弃上清,加入75%乙醇(DEPC水稀释),离心弃上清,加入50 μl DEPC水溶解沉淀,最后利用Nano-drop进行浓度测定提取的RNA浓度。②RNA逆转录:依次加入反应体系,5×primer Script Buffer 2 μl+RT Enzyme Mix 0.5 μl+逆转录引物0.5 μl+RNA(200 ng/μl)1 μl+RNAase free ddH2O 6 μl,设置反应条件为:37 ℃ 15 min;85 ℃ 5 s。然后稀释至50 ng/μl,-20 ℃冻存。③qRT-PCR:依次加入real-time PCR体系:SYBR premix ExTaq TM Ⅱ(2×)10 μl+F-primer 1 μl+R-primer 1 μl+cDNA(100 ng/μl)1 μl+ddH2O 7 μl,设置反应程序:95 ℃ 30 s,然后95 ℃ 5 s、60 ℃ 30 s、72 ℃ 30 s进行40个循环反应,完成后进行溶解曲线绘制。VDR上游引物:5′-GAAGCTGAACTTGCATGAGGA-3′,下游引物:5′-GTCCTGGATGGCCTCAATC-3′;GAPDH上游引物:5′-GCCAAAAGGGTCATCATCTC-3′,下游引物:5′-GTAGAGGCAGGGATGATGTTC-3′。
1.5 Transwell细胞迁移实验
通过Transwell实验检测细胞迁移能力,实验分为对照组、维生素D3组、miR-145抑制剂组和联合处理组,按照1.3中提到的方法处理细胞。具体实验步骤:将转染后1 d的各组细胞分别用胰酶消化,培养基洗3遍,1% FBS的RPMI-1640重悬细胞,将不同组细胞浓度稀释到5x105cells/ml,取200 μl加入Transwell上室中,下室加入600 μl完全培养基,孵育培养20-24 h后,取出小室,棉签擦去上室非侵袭细胞,于超净台中倒置风干,在24孔培养板中加入600 μl 0.1%结晶紫,将小室置于其中浸没到结晶紫中,37 ℃染色30 min;取出小室,用PBS冲洗小室及24孔板,到清洗的PBS无紫色。在显微镜下对不同组小室进行观察,直径上取5个视野进行照相,利用Image J统计细胞数量,并计算相对迁移率。
1.6 数据统计分析
所有数据分析均采用SPSS 13.0软件包,两组样本之间的比较采用独立样本t检验,所有结果重复3次。P<0.05认为差异具有统计学意义。
2 结果
2.1 维生素D3抑制胃癌细胞SGC-7901的迁移
Transwell迁移实验结果显示,与对照组相比,维生素D3组细胞穿过Transwell小室膜的细胞明显减少(见图1),两组间相对迁移率差异有统计学意义(P<0.01,见图1)。表明维生素D3对胃癌细胞的迁移有抑制作用。
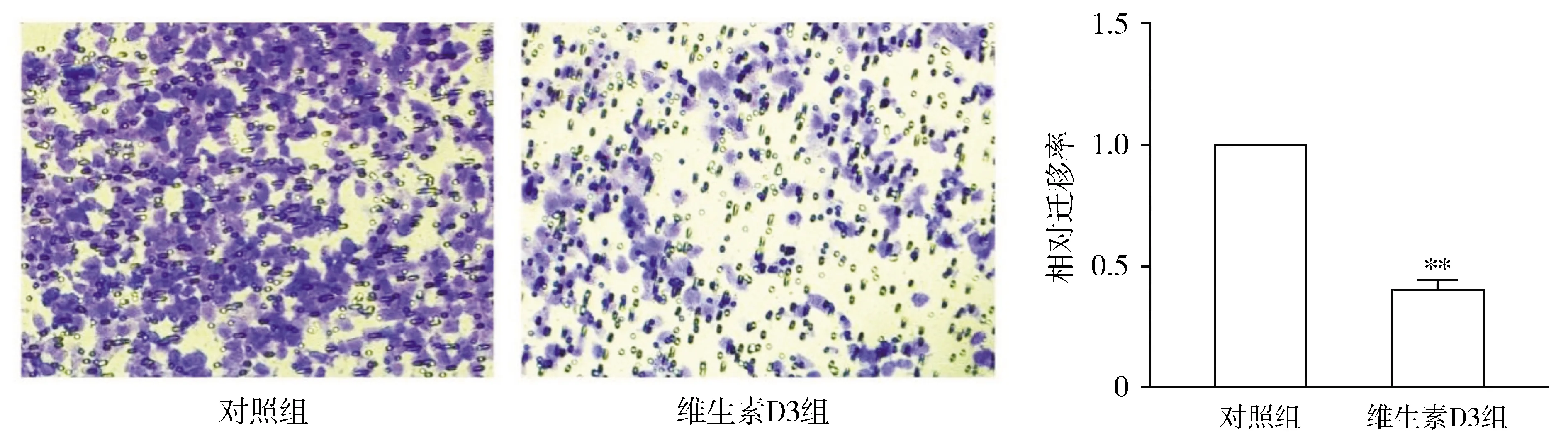
与对照组比较,**P<0.01图1 维生素D3对胃癌SGC-7901细胞迁移的影响 (×20)Figure 1 The effect of miR-145 on the cell migration of SGC-7901 cells (×20)
2.2 VDR在胃癌细胞中的表达情况
相对于正常胃黏膜上皮细胞GES-1,胃癌细胞系AGS、BGC-823和SGC-7901细胞系中,VDR表达降低,差异有统计学意义(P<0.01,见图2)。提示维生素D3可能通过VDR影响下游靶基因的表达。
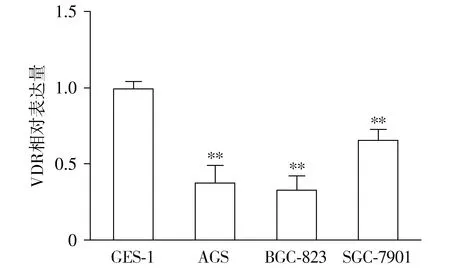
与GES-1比较,**P<0.01图2 VDR在胃癌细胞中的相对表达量Figure 2 Relative expression of VDR in gastric cancer cell lines
2.3 维生素D3通过miR-145抑制胃癌SGC-7901细胞的迁移
结果显示,相对于对照组,miR-145抑制剂组迁移细胞数多,两组间相对迁移率差异有统计学意义(P<0.001,见图3);相对于维生素D3处理组,联合处理组迁移细胞数有一定增加,两组间相对迁移率差异有统计学意义(P<0.01,见图3)。提示维生素D3对胃癌细胞迁移功能的影响可能通过miR-145实现。
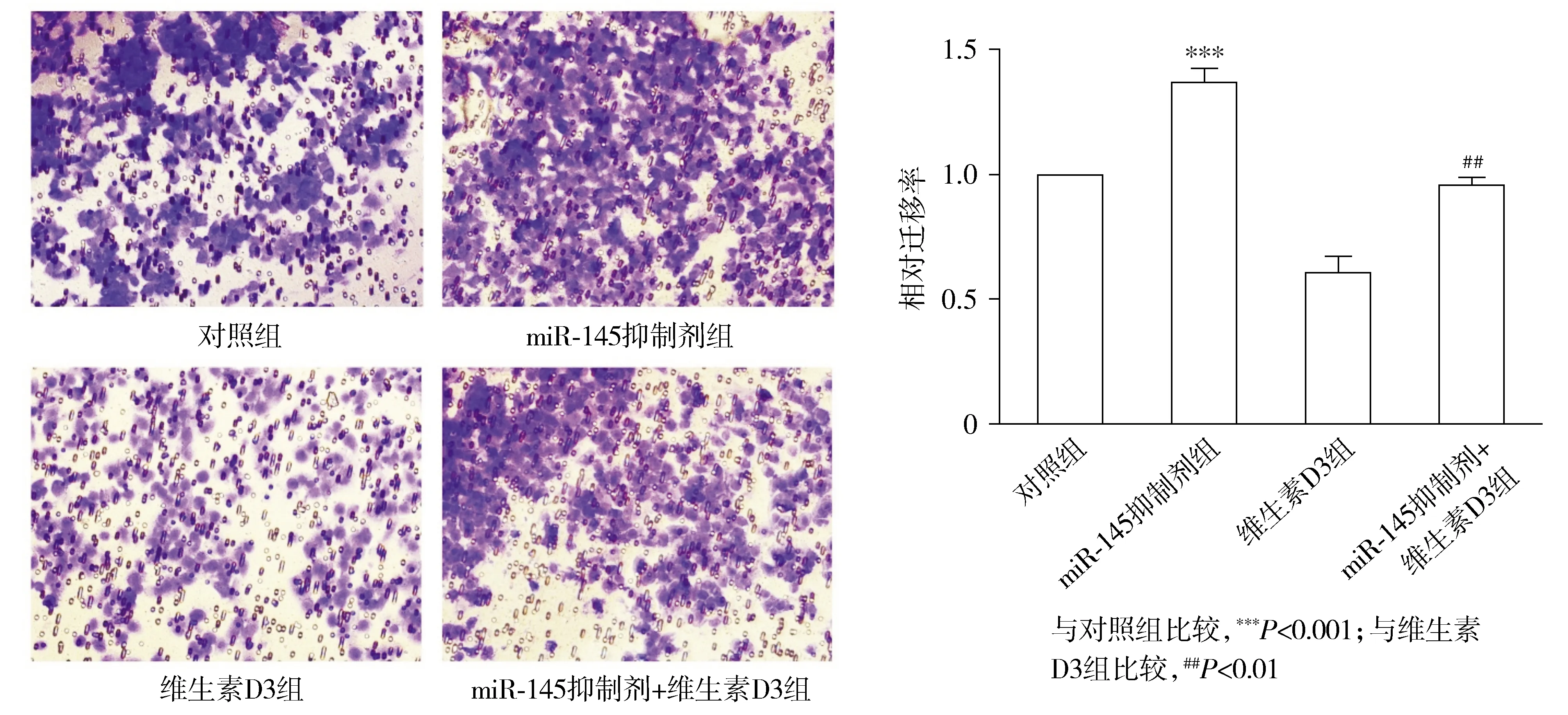
图3 miR-145抑制剂对维生素D3抑制胃癌细胞迁移作用的影响 (×20)Figure 3 Effect of miR-145 inhibitor on the inhibitory effect of vitamin D3 on gastric cancer cell migration (×20)
3 讨论
近年来,流行病学和动物研究发现低水平的维生素D与癌症风险增加相关,且维生素D缺乏已经影响总人口的40%[3]。已有研究显示,只有8.1%的胃癌患者达到足够的维生素D3水平,且57.9%患者处于缺失水平,低水平维生素D与低生存率有显著的相关性,维生素D水平可作为胃癌的独立预后因素[8]。关于维生素D3抑制肿瘤发生和生长的作用已有诸多报道,主要在细胞的生长、增殖、凋亡、迁移和侵袭等经典癌症途径研究方面。
维生素D3主要通过结合并激活受体VDR发挥生物学效应,在恶性肿瘤中,通过ChIP-seq在癌细胞的基因组发现上千个VDRE位点,多种调节细胞周期、细胞分化、信号转导和细胞程序性死亡的蛋白表达受到VDR的影响[9],此外,miRNA作为一类重要的调节基因表达的非编码RNA,其本身在癌症异常表达并参与调控肿瘤增殖分化等生物学功能,维生素D3对miRNAs表达的影响以及是否通过VDR进行转录调控,为维生素D3发挥生物学效应增加一种新的分子机制,关于miRNA参与维生素D3在癌细胞中的调控机制,已有多项研究报道,例如Kong等[10]研究表明VDR信号抑制癌症相关的成纤维细胞释放外泌体miR-10a-5p,并限制其对胰腺癌细胞的支持作用;我们之前的研究表明,miR-145作为VDR的靶基因直接参与了维生素D3对胃癌细胞增殖的抑制作用[11]。在本文中,我们进一步研究说明维生素D3能够抑制胃癌SGC-7901的细胞迁移,且挽救实验证实miR-145在其中发挥重要的中间分子作用,进一步说明维生素D3在调控胃癌细胞的分子机制中,可能通过迁移相关的靶基因抑制胃癌细胞迁移,且miR-145有多个已经证实的迁移相关靶基因通过Sp1/NF-κB等介导的信号通路抑制肿瘤细胞迁移和侵袭[12]。近两年也有较多关于miR-145受上游基因调控再通过靶基因所在经典的肿瘤细胞信号通路而影响癌细胞迁移,例如PVT1通过调节miR-145-5p/ITGB8轴并抑制MEK/ERK信号通路,敲低PVT1可抑制NSCLC细胞的增殖、迁移和侵袭,并诱导其凋亡[13]。我们也将进一步研究miR-145在胃癌中的信号通路,为维生素D3在胃癌中的作用机制提供新的理论基础。
