积雪草酸对大鼠蛛网膜下腔出血后IL-33/ST2信号通路及小胶质细胞的影响
2021-11-18刘建敏金海涛吕建萌党星波陕西省人民医院急诊外科西安710000通讯作者maildangxb2006163com
胡 炜,刘建敏,金海涛,吕建萌,王 沛,王 刚,党星波(陕西省人民医院急诊外科,西安 710000;通讯作者,E-mail:dangxb2006@163.com)
蛛网膜下腔出血(subarachnoid hemorrhage, SAH)是一种严重的脑血管疾病,可诱发长期的神经功能缺损,死亡率和致残率极高[1]。在SAH后的急性期,活化的小胶质细胞可引起促炎细胞因子的急性上调及自由基的产生,继而加重脑水肿和继发性神经元损伤甚至凋亡[2,3]。积雪草酸是从积雪草中分离得到的三萜类物质,具有显著的抗氧化和抗炎作用[4,5]。研究证实,积雪草酸具有强大的神经保护特性,可缓解局灶性脑中风[6]和阿尔茨海默病[5]模型中出现的神经功能障碍和神经元损伤。然而,积雪草酸能否缓解SAH后早期脑损伤及其具体作用机制尚不清楚。
ST2是一种IL-1受体家族的受体蛋白,主要在各种免疫细胞上表达[7]。ST2可与其配体白细胞介素-33(IL-33)的受体,在免疫细胞反应介导的保护性免疫炎症反应中起重要作用[8]。近期研究发现,IL-33/ST2信号通路的激活可通过抑制小胶质细胞激活减轻局灶性脑中风后的炎症反应和神经元损伤[9]。因此,本研究拟探讨积雪草酸治疗对大鼠SAH后IL-33/ST2信号通路及早期脑损伤影响,为治疗SAH的研究提供新的方向和理论依据。
1 材料与方法
1.1 主要材料及设备
积雪草酸购自美国Sigma公司;ED-1(CD68)、IL-33和ST2抗体购自美国Abcam公司;β-actin抗体购自美国Santa Cruz公司;TUNEL凋亡检测试剂盒购自美国Roche公司;4′,6-二脒基-2-苯基吲哚(DAPI)购自美国Sigma公司;Alexa Fluor 488标记荧光二抗购自美国Life technologies公司。
1.2 实验性蛛网膜下腔出血(eSAH)模型制备
参照文献[10]采用血管内穿刺法建立大鼠实验性蛛网膜下腔出血(eSAH)模型。氯胺酮(100 mg/kg)麻醉大鼠后,分离右颈总动脉、右颈外动脉和右颈内动脉。在右颈外动脉远侧作一切口,将4-0单丝尼龙缝合线经残端置入,引入颈内动脉直至感觉到阻力,此时距颈总动脉分叉处约20 mm。继续将缝合线推进约3 mm,穿透大脑中动脉分叉处的颈内动脉,后立即撤回缝合线,允许颈内动脉再灌注以制成eSAH模型。
1.3 实验分组
体质量280-330 g雄性SD大鼠,购自西安交通大学医学院实验动物中心。随机分为4组:假手术组(sham组)、实验性蛛网膜下腔出血组(eSAH组)、积雪草酸低剂量组(积雪草酸低剂量组)和积雪草酸高剂量组(积雪草酸高剂量组),每组18只。sham组仅在手术操作中将尼龙线头端送至右颈内动脉,但不刺破动脉管壁;eSAH组、积雪草酸低剂量组和积雪草酸高剂量组制备eSAH模型。积雪草酸低剂量组和积雪草酸高剂量组分别于模型制备后0,6,12 h腹腔注射50 mg/kg和75 mg/kg积雪草酸(溶于1 ml生理盐水)[6];sham组和eSAH组于术后或模型制备后0,6,12 h腹腔注射1 ml生理盐水。
1.4 脑水含量测定
每组取6只大鼠,于eSAH后24 h用过量注射戊巴比妥钠(150 mg/kg)麻醉大鼠,取出脑组织并快速分离成左半球、右半球、小脑和脑干。立即称量脑标本得湿重,于100 ℃烘箱中干燥48 h,称得干重。脑含水量=(湿重-干重)/湿重×100%。
1.5 Western blot检测IL-33和ST2蛋白表达
每组取6只大鼠,于eSAH后24 h过量注射戊巴比妥钠(150 mg/kg)处死大鼠。取右脑半球皮质,称重后充分匀浆并离心。BCA蛋白质检测试剂盒测定蛋白质含量后,将等量蛋白质重悬于上样缓冲液中。100 ℃下变性10 min后,用120 g/L十二烷基硫酸钠聚丙烯酰胺(SDS)凝胶电泳分离并电转到硝酸纤维素膜上。50 g/L脱脂牛奶封闭2 h后,与相应一抗(IL-33抗体,1 ∶1 000;ST2抗体,1 ∶1 000;β-actin抗体,1 ∶500)反应12 h。之后加入抗兔/小鼠IgG辣根过氧化物酶(HRP)标记的二抗(1 ∶5 000)处理膜,用ECL化学发光底物显影并通过X线胶片显现。使用Image J软件分析量化条带密度。
1.6 TUNEL凋亡及ED-1阳性小胶质细胞检测
每组取6只大鼠,于eSAH后24 h,麻醉大鼠并用40 g/L多聚甲醛经心脏灌注2 h。分离脑组织,在40 g/L多聚甲醛中后固定6 h,石蜡包埋后切成约5 μm厚的切片。用10 g/L Triton X-100透化2 min,封闭30 min后,根据厂商的说明书使用行TUNEL染色,并用4′,6-二脒基-2-苯基吲哚(DAPI)行核复染。荧光显微镜400倍镜下观察损伤测大脑皮层并摄片,DAPI染色细胞核呈蓝色荧光,TUNEL阳性细胞核呈红色荧光,计算凋亡指数(=TUNEL阳性凋亡细胞数/DAPI有核细胞总数×100%)。
将切片在4 ℃下与ED-1一抗(1 ∶200)孵育24 h。第2天,用PBS洗涤切片,室温下加入Alexa Fluor 488标记的荧光二抗孵育2 h。荧光显微镜400倍镜下观察并摄片,计数5个不同视野中ED-1阳性细胞,计算ED-1阳性细胞密度(个/mm2)。
1.7 统计学方法
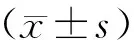
2 结果
2.1 SAH后大鼠脑大体标本观察情况
大体标本观察发现,eSAH组大鼠脑标本多处因血液进入蛛网膜下腔而呈红色,以willis环附近最为明显,而sham组则未见明显出血表现,脑组织表面发白(见图1),说明eSAH模型构建成功。
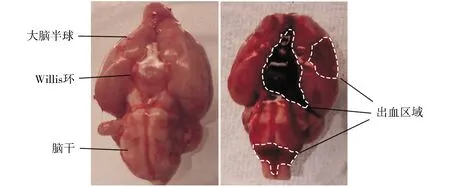
A.假手术组 B.实验性蛛网膜下腔出血组图1 SAH后大鼠脑大体标本观察情况Figure 1 General observation of brain tissues in sham group and eSAH group
2.2 各组大鼠SAH后脑水含量的比较
与sham组比较,eSAH组大鼠左大脑半球、右大脑半球及小脑的含水量显著增加(P<0.05);与eSAH组比较,积雪草酸低剂量组和积雪草酸高剂量组左大脑半球和右大脑半球含水量明显减少(P<0.05),而小脑含水量未见明显改变(P>0.05);与积雪草酸低剂量组比较,积雪草酸高剂量组脑含水量未见明显差异(P>0.05,见图2)。
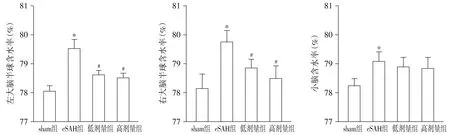
与sham组比较,*P<0.05;与eSAH组比较,#P<0.05图2 各组大鼠SAH后脑水含量的比较Figure 2 Comparison of the water content after subarachnoid hemorrhage among the groups
2.3 各组大鼠SAH后大脑皮层IL-33和ST2蛋白表达水平的比较
与sham组比较,eSAH组大脑皮层IL-33和ST2蛋白表达有所增加(P<0.05);与eSAH组比较,积雪草酸低剂量组和积雪草酸高剂量组大脑皮层IL-33和ST2蛋白表达明显上调(P<0.05);与积雪草酸低剂量组比较,积雪草酸高剂量组大脑皮层IL-33和ST2蛋白表达显著增加(P<0.05,见图3)。
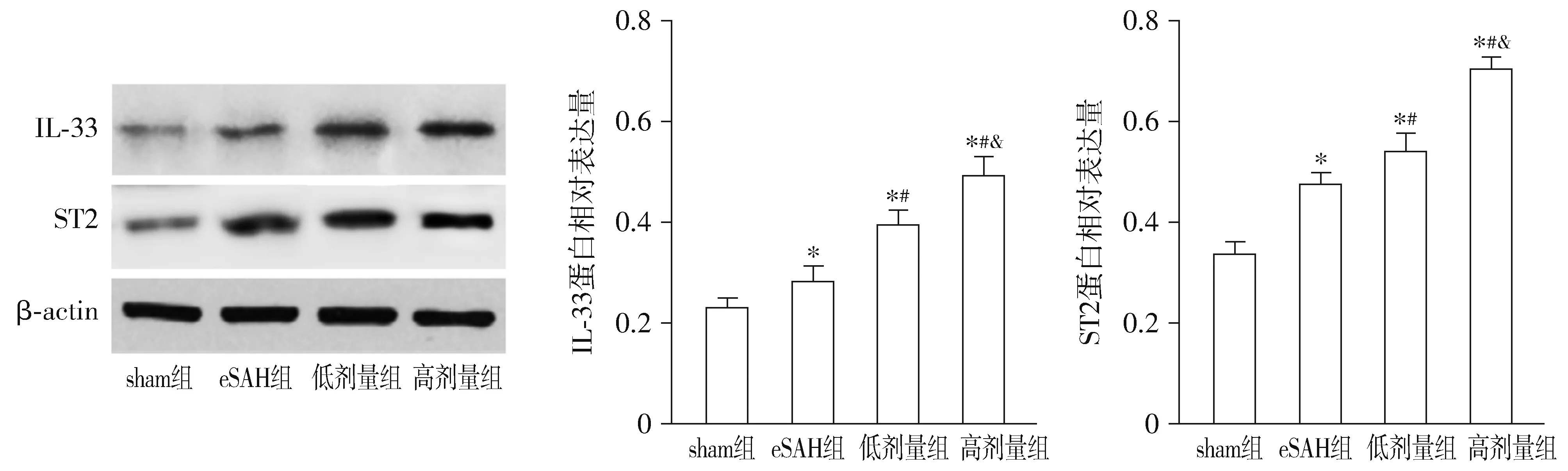
与sham组比较,*P<0.05;与eSAH组比较,#P<0.05;与积雪草酸低剂量组组比较,&P<0.05图3 各组大鼠SAH后大脑皮层IL-33和ST2蛋白表达水平的比较Figure 3 Comparison of cerebral IL-33 and ST2 protein expression after subarachnoid hemorrhage among the groups
2.4 各组大鼠SAH后大脑皮层ED-1阳性小胶质细胞数的比较
与sham组比较,eSAH组大脑皮层ED-1阳性小胶质细胞数明显增加(P<0.05);与eSAH组比较,积雪草酸低剂量组和积雪草酸高剂量组大脑皮层ED-1阳性小胶质细胞数显著减少(P<0.05);与积雪草酸低剂量组比较,积雪草酸高剂量组大脑皮层ED-1阳性小胶质细胞数未见明显差异(P>0.05,见图4)。
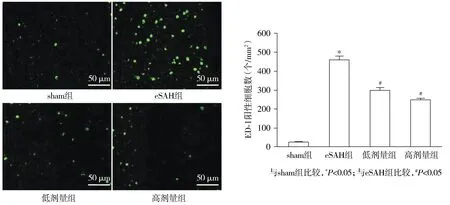
ED-1阳性小胶质细胞数呈绿色荧光图4 各组大鼠SAH后大脑皮层ED-1阳性小胶质细胞数的比较Figure 4 Comparison of the number of ED-1-positive microglia after subarachnoid hemorrhage among the groups
2.5 各组大鼠SAH后脑皮层凋亡指数的比较
与sham组比较,eSAH组大脑皮层凋亡指数明显增加(P<0.05);与eSAH组比较,积雪草酸低剂量组和积雪草酸高剂量组大脑皮层凋亡指数显著减少(P<0.05);与积雪草酸低剂量组比较,积雪草酸高剂量组大脑皮层凋亡指数未见明显差异(P>0.05,见图5)。
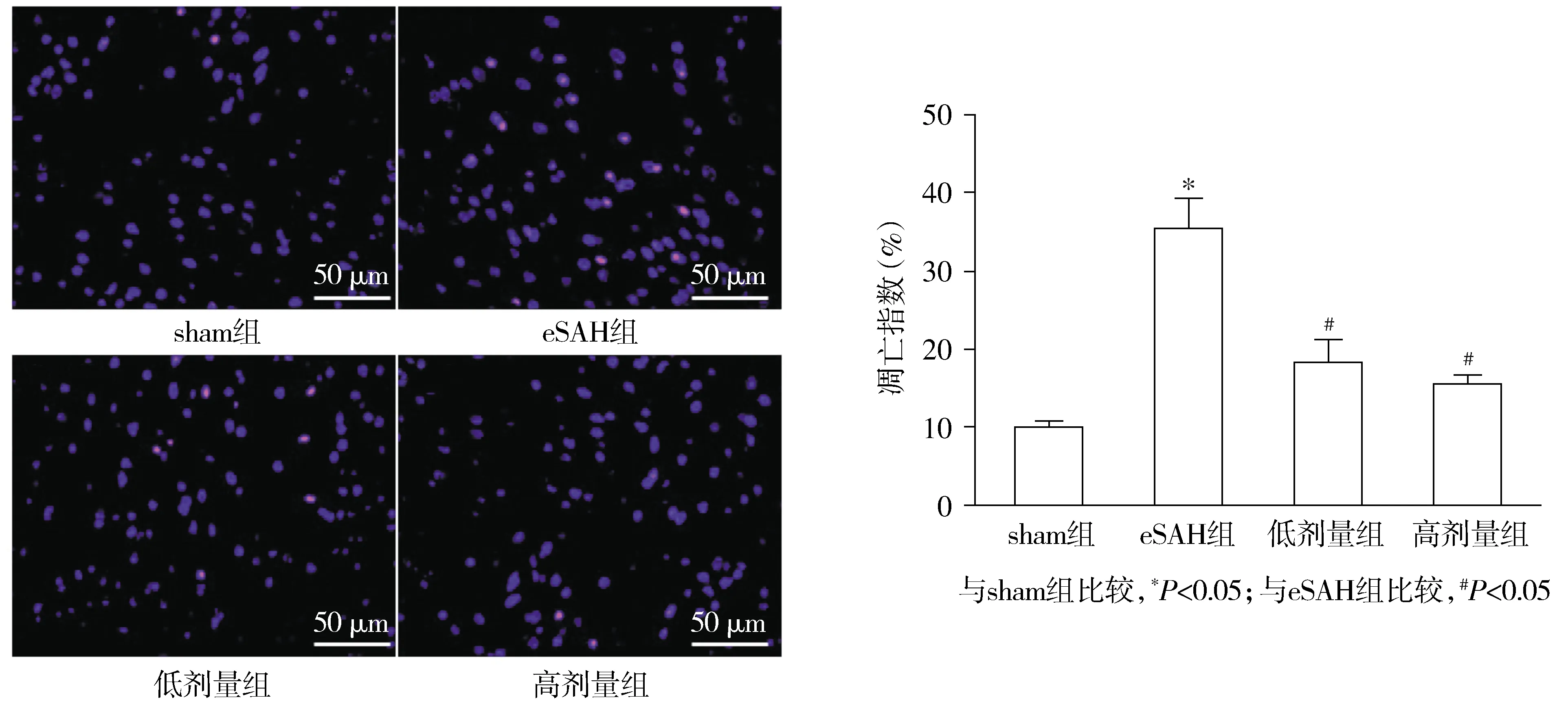
TUNEL阳性凋亡细胞呈红色荧光,细胞核用DAPI复染呈蓝色荧光图5 各组大鼠SAH后脑皮层凋亡指数的比较Figure 5 Comparison of the apoptotic index after subarachnoid hemorrhage among the groups
3 讨论
本研究探讨了积雪草酸对蛛网膜下腔出血后IL-33/ST2信号通路及小胶质细胞的影响。研究结果显示,腹腔注射50 mg/kg或75 mg/kg的积雪草酸均能减轻大鼠蛛网膜下腔出血后的脑水肿,激活IL-33/ST2信号通路,并抑制小胶质细胞的活化。
积雪草酸已被证实在局灶性脑缺血[6]、阿尔茨海默病[5]、帕金森综合征[11]等多种动物模型中具有脑保护作用。与之一致,本研究结果表明,积雪草酸治疗可有效缓解蛛网膜下腔出血后出现的脑水肿和细胞凋亡。积雪草酸的这种作用对蛛网膜下腔出血具有实用的临床意义。首先,蛛网膜下腔出血后的脑血管痉挛和血脑屏障破坏是导致脑水肿和患者死亡的关键机制,而已有研究证实积雪草酸可维持血脑屏障的完整性,对蛛网膜下腔出血后病理改变具有较好的针对性;其次,即使在局灶性脑缺血发作后12 h给药,积雪草酸治疗也具有神经保护作用,这就说明其在临床上具有更长的治疗时间窗;最后,积雪草酸虽然半衰期仅有2 h,但治疗的效果却可以持续到14 d,这表明积雪草酸具有较好的持续获益[6]。
小胶质细胞是脑内的先天性免疫细胞[12]。在SAH后,小胶质细胞可显著增殖活化,并产生大量促炎细胞因子(如IL-6和TNF-α)[12]。在小鼠和人类样品中发现,小胶质细胞可在血管出血部位开始积聚,逐渐向周围皮质扩散,并在出血后第7-14天达到最大[12]。该变化趋势与SAH患者的死亡和脑血管痉挛发生的高峰期基本吻合。本研究通过检测ED-1(小胶质细胞活化标志物[13])阳性细胞的密度以反映小胶质细胞的活化程度,结果显示SAH后24 h受损皮层中活化小胶质细胞显著增多。已有体外研究发现,积雪草酸可抑制BV2小胶质细胞介导的神经炎症反应[14]。而本研究首次在体内研究中证实,腹腔注射积雪草酸可显著减轻SAH后小胶质细胞的活化。这就说明,积雪草酸可能通过抑制小胶质细胞活化缓解SAH后出现的神经炎症反应和神经损伤。
IL-33/ST2信号通路在管理脑缺血损伤后小胶质细胞的活化和功能中起到关键作用[15]。ST2基因缺陷可加剧急性脑缺血再灌注损伤后脑梗死面积和神经功能损伤[9]。而本研究结果发现,SAH后受损皮质中IL-33和ST2的蛋白表达均有所增加。鉴于ST2主要表达于小胶质细胞[9],我们推测SAH后IL-33/ST2信号通路的初步激活可能与小胶质细胞的增殖相关。而本研究进一步结果发现,积雪草酸可显著上调受损皮质中IL-33和ST2的蛋白表达。已有研究发现,激活IL-33/ST2信号通路可促使小胶质细胞由炎症性的M1型向抗炎性的M2型小胶质细胞转变[9]。因此我们推测,积雪草酸可能通过激活IL-33/ST2信号通路抑制SAH后小胶质细胞激活,进而缓解炎症反应和细胞凋亡,最终起到神经保护的作用。
综上所述,积雪草酸治疗可减轻大鼠蛛网膜下腔出血后小胶质细胞激活及细胞凋亡,其作用机制可能与激活IL-33/ST2信号通路相关。
