深纹核桃与防御相关的萜烯合成酶基因鉴定分析
2021-11-18徐令文郝佳波李贤忠
徐令文, 王 毅, 郝佳波, 张 雨, 赵 敏, 赵 川, 李贤忠, 陆 斌
(1.西南林业大学林学院,云南 昆明 650224;2.云南省林业和草原科学院,云南省森林植物培育与开发利用重点实验室,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
植物中萜类化合物是种类最多的次级代谢产物.作为天然化合物,其结构以异戊二烯为基本单元,以聚异戊二烯为骨架.萜类化合物依据异戊二烯的数目进行分类,分为单萜、倍半萜、二萜、三萜和多萜[1].萜类物质在植物中发挥着重要的生理作用,作为合成植物激素的前体,萜类化合物参与赤霉素(gibberellins, GAs)、独脚金内酯(strigolactones)和脱落酸(abscisic acid, ABA)等物质的合成[2],有研究表明[3,4],用日本柳杉(Cryptomeriajaponica)中萜类化合物α-蒎烯和其他物质培养NK-92MI细胞,可使细胞中颗粒酶A(Granzyme)生物活性明显提高.
萜烯合成酶调控萜类化合物的形成.研究表明[5],五碳前体物质通过叶绿体中的MEP(methylerithritol phosphatepathway)代谢途径或胞浆中MVA途径(mevalonate pathway)生成萜类化合物.在胞浆中形成的法呢基焦磷酸(FPP-C15)以及牻牛儿基牻牛儿基二磷酸(GGPP-C20)或是在叶绿体中形成的焦磷酸(GPP-C10)均为TPS的底物(合成途径),萜烯合成酶通过催化GPP生成单萜(C10),催化GGPP生成双萜(C20),催化叶绿体中异戊基焦磷酸生成半萜(C5),催化胞浆中的FPP生成倍半萜,参与萜类物质的合成.
近年来,高通量测序技术的发展使得转录组学在植物生理研究中发挥越来越重要的作用[6],已有试验对水稻(Oryzasativa)[7]、杨树(Populustrichocarpa)[8]、葡萄(VitisviniferaL.)[9]等植物中TPS基因家族成员进行了鉴定和研究.其中在番茄(LycopersiconesculentumMill.)[10]中得到31个TPS基因完整编码序列,中粒咖啡(CoffeacanephoraPierreex Froehn.)[11]鉴定出43个萜烯合成酶全长基因.TPS基因分成TPS-a至TPS-h共7类,并且将7类划分为3个家族,不同类基因调控不同产物的生成.其中,调控古巴焦磷酸和对映贝壳杉烯合成的TPS-c、调控对映贝壳杉烯和其他二萜丹萜合成的TPS-e/f和属于卷柏特异家族的TPS-h聚为亚家族Ⅰ;只在裸子植物中被发现的TPS-d被分类为亚家族Ⅱ;TPS-a、TPS-b和TPS-g聚为亚家族Ⅲ,其中属于被子植物中特有的特异分支TPS-a调控倍半萜与二萜合成,TPS-b调控环状单萜和半萜合成,TPS-g调控非环单萜合成且只在石门松属的江南卷柏中被发现[12].
植物受到外界伤害后,参与控制萜烯化合物合成的基因表达上调,以发挥防御作用.黄欣蒸等[13]研究表明,玉米被草地贪夜蛾取食18 h后会诱导15个萜烯挥发物生物合成,并控制14个基因上调表达,其体内以抗虫代谢物合成为主的防御反应被激活.有研究表明[14,15],遭到象鼻虫取食后的北美云杉(SitkaSpruce)在第1天内控制α-蒎烯合成的基因转录水平升高到原来的2倍,在第2~4天内基因表达上升水平更加显著,对北美云杉用钻孔的方式模拟象鼻虫取食情况,转录组测序发现其单萜烯合成酶基因在受伤6 h后转录开始增加,转录水平在受伤后的4~7 d达到最高.
2018年云南省核桃种植面积、产量和综合产值均位居全国首位[16],是中国核桃的主要产区,其种质资源具有重要研究价值.深纹核桃(Juglanssigillata)是中国西南地区主要栽植的核桃种类,对深纹核桃进行环剥,通过分析转录组变化可探究萜烯合成酶基因与防御机制的关系.本试验利用生物信息学技术对深纹核桃TPS基因家族成员进行鉴定,并分析其成员的蛋白理化性质、系统进化特征、蛋白结构及在不同状况下的表达模式,对研究萜烯合成酶调控植物防御活动机制、萜类化合物合成途径具有一定意义,为深纹核桃良种选育提供依据.
1 材料与方法
1.1 植物材料获取
在云南腾冲滇滩核桃种植园(25°53′N、98°40′E),随机选择生长条件一致、未结果的6年生J.sigillatacv. Xixiang嫁接树3株(砧木为实生铁核桃,接穗是Xixiang枝条),每株选择生长情况相似的2个主枝,于2018年5月20日,对其中1个主枝的枝干进行螺旋环剥处理,环剥位置为主枝基部,深度至树干韧皮部,环剥宽度10 mm,长度为螺旋状1圈,另1个未环剥主枝作为对照,每棵树体作为1个重复.环剥60 d后,深纹核桃处于果实成熟期,分别取环剥和未环剥主枝1年生枝条的嫩叶、嫩茎,取树龄12年、结实稳定处于盛产期的Xixiang老树1年生结果枝的嫩叶和嫩茎,在液氮中速冻,并贮存在-80 ℃冰箱中,直至RNA提取.
1.2 JsTPS基因序列获取和蛋白理化性质分析
通过NCBI(https://www.ncbi.nlm.nih.gov/)获得深纹核桃全基因组序列,利用在线工具(http://www.ncbi.nlm.nih.gov/cdd)进行蛋白结构域的筛选,剔除无TPS结构域的序列,最终获得65个深纹核桃TPS基因序列.利用在线软件ExPASy protparam tool分析JsTPS蛋白理化性质,使用signaIP-5.0(http://www.cbs.dtu.dk/cgi-bin/)分析JsTPS蛋白信号肽,使用Prabi在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/)分析JsTPS蛋白二级结构,使用Euk-mPLoc 2.0 server(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)分析JsTPS蛋白亚细胞定位,使用TMHMM(http://www.cbs.etu.dk//cgi-bin/)分析JsTPS蛋白跨膜结构.
1.3 JsTPS保守结构域分析与进化树构建
利用DNAMAN对已筛选的深纹核桃TPS氨基酸序列进行比对,分析其保守亚结构域,使用MEME(http://meme.nbcr.net/meme/tools/meme)对65个深纹核桃TPS基因的蛋白保守结构域进行预测,具体参数设置为:基序位点分布情况,选择重复次数不限制;保守性基序的数目限制选择4,其他参数不变,均采用默认值.使用MEGA6.0软件及Figtree软件对深纹核桃TPS基因蛋白进行系统进化树构建及修饰,执行参数为None.
1.4 转录组测序、JsTPS基因表达分析和RT-qPCR验证
样品送上海派森诺生物科技股份有限公司进行转录组测序(RNA-seq),基于Illumina测序平台,利用双末端测序(Paired-End)方法,每个样品3个生物学重复,共18组转录组数据.使用DESeq2软件对环剥处理、无环剥处理和结果老树条件下深纹核桃测序数据进行分析,筛选阈值为Padj<0.05且|log2Fold Change|>1,划分上调DEG和下调DEG,通过R语言和Origin85进行绘图.利用派森诺基因云在线软件(https://www.genescloud.cn/login)上传基因表达谱数据,并制作基因表达交互热图.使用HTSeq统计比对,将每个基因的Read Count值作为基因原始表达量.Reads计数与基因真实表达水平、基因长度与测序深度呈正相关.为了使不同基因与不同样本之间的基因表达量具有可比性,采用FPKM值对表达量进行标准化.对挑选出的6个JsTPS基因进行RT-qPCR验证,3个生物学重复.
2 结果与分析
2.1 JsTPS成员鉴定
在NCBI网站获得深纹核桃全基因组序列,初步筛选得到78个萜烯合成酶基因家族候选蛋白序列.利用网站Pfam和blastp检测其序列的保守结构域,删除不含有萜烯合成酶典型结构域PF01397(萜类合成酶N末端结构域)、PF03936(金属离子结合结构域)的蛋白序列,最终得到65个JsTPS家族成员(表1).依据命名规则将其在NCBI上注册为JsTPS1-10、JsTPS12-21、JsTPS23-47、JsTPS49-67和JsTPS70.JsTPS蛋白家族所含氨基酸176~852 个,其中蛋白氨基酸数目为176~300 个的占比6.1%,300~450 个的占比13.8%,450~650 个的占比78.8%,650~852 个的占比1.0%.平均分子质量为62 228.理论等电点分布在4.70(JsTPS40)~10.28(JsTPS45),平均理论等电点(pI)为5.72.除JsTPS16、JsTPS17、JsTPS19、JsTPS30、JsTPS38、JsTPS47、JsTPS49、JsTPS55、JsTPS58不稳定系数(Innstability index)小于40,其余不稳定系数均大于40,说明大部分JsTPS蛋白处于不稳定状态.除JsTPS7蛋白序列脂肪系数(aliphatic index)大于100,其余蛋白序列脂肪系数均小于100.

表1 深纹核桃萜烯合成酶理化性质分析Table 1 Physical and chemical properties of terpene synthase in J.sigillata

续表1
2.2 JsTPS蛋白理化性质分析
利用ProtParam软件预测深纹核桃萜烯合成酶蛋白理化性质(表1),signalp在线工具分析表明,65个JsTPS蛋白均不具有信号肽,TMHMM在线工具分析表明,除JsTPS8外,其余JsTPS家族蛋白均不具有跨膜结构.利用Euk-mPLoc 2.0在线工具预测亚细胞定位,结果表明,除JsTPS6、JsTPS23、JsTPS56分布于叶绿体和细胞质内,其余均定位于叶绿体.二级结构预测结果表明,在65个JsTPS蛋白二级结构中,α-螺旋所占比例均大于无规则卷曲,前两者均大于β-转角、延伸链,其中,有61.5%的JsTPS蛋白延伸链所占比例≥β-转角.65个JsTPS蛋白中α-螺旋在二级结构中占比41.01%(JsTPS55)~73.86%(JsTPS61).α-螺旋、无规则卷曲占比较大有利于蛋白保持稳定性.
2.3 JsTPS进化树构建
利用MEGA6.0软件对深纹核桃65个TPS蛋白和其他植物中已被研究的萜烯合成酶基因[拟南芥24个TPS基因蛋白、玉米ZmTPS2(AY928081.1)、ZmTPS6(AY518315.1)、ZmTPS11(EU518315.1)、喜旱莲子草ApTPS19(XP_010686917.1)、毛竹中克隆毛竹(E)-橙花醇合成酶MoTPS6(Chen, 2016)(KP097715.1)、茶叶CsTPS3(XP_028062770.1)、葡萄VvTPS7(XP_001268216.1)、咖啡CaTPS10(XP_027103337.1)、CaTPS11(XP_027155596.1)、CaTPS20(XP_027101405.1)]编码的蛋白进行进化树构建分析(图1),结果与65条JsTPS蛋白序列分类结果相同,说明结果较为可信.系统进化树分为5个分支,其中ApTPS19与JsTPS70分类距离最近,JsTPS66与MoTPS6分类距离最近.

颜色相同表示同一亚家族.图1 TPS蛋白进化树构建分析Fig.1 Phylogenetic tree of TPS proteins
2.4 JsTPS保守元件分析
深纹核桃TPS蛋白序列比对结果表明,大部分蛋白存在DDXXD、RXR和RRX(8)W保守结构域(图2).其中,DDXXD是萜类合成酶所含有的最典型的保守结构域,该结构域富含天冬氨酸残基.该残基对金属离子具有结合作用,从而在引导底物催化时发挥重要功能.除JsTPS1、JsTPS2、JsTPS3、JsTPS6、JsTPS23、JsTPS24、JsTPS34、JsTPS52、JsTPS53、JsTPS55、JsTPS56、JsTPS61外,81.5%JsTPS蛋白序列含有DDXXD保守结构域,除JsTPS1、JsTPS2、JsTPS3、JsTPS6、JsTPS7、JsTPS23、JsTPS24、JsTPS26、JsTPS27、JsTPS28、JsTPS34、JsTPS42、JsTPS55、JsTPS56、JsTPS61、JsTPS65、JsTPS66、JsTPS67、JsTPS70外,70.8%JsTPS蛋白序列含有RXR保守结构域,除JsTPS1、JsTPS2、JsTPS3、JsTPS16、JsTPS17、JsTPS18、JsTPS19、JsTPS23、JsTPS24、JsTPS26、JsTPS27、JsTPS28、JsTPS30、JsTPS34、JsTPS35、JsTPS36、JsTPS38、JsTPS40、JsTPS42、JsTPS45、JsTPS47、JsTPS49、JsTPS52、JsTPS53、JsTPS55、JsTPS61、JsTPS65、JsTPS66、JsTPS67、JsTPS70外,53.8%JsTPS蛋白序列含有RRX(8)W保守结构域.其中JsTPS1、JsTPS2、JsTPS3、JsTPS23、JsTPS24、JsTPS55、JsTPS61均不具备DDXXD、RXR和RRX(8)W保守结构域,JsTPS6、JsTPS26、JsTPS27、JsTPS28、JsTPS34、JsTPS42、JsTPS53、JsTPS65、JsTPS66、JsTPS67、JsTPS70只具有1个保守结构域.

不同字母表示不同氨基酸,蛋白质中保守结构域重复氨基酸使用同种颜色并框出.图2 深纹核桃TPS基因保守结构域蛋白序列Fig.2 Protein sequence alignment of conserved domain of TPS in J.sigillata
2.5 测序数据
共有18个样本进行测序[环剥处理的试验株的茎(HJ1/HJ2/HJ3)、叶(HY1/HY2/HY3),未经过环剥处理的试验株的茎(WJ1/WJ2/WJ3)、叶(WY1/WY2/WY3)以及结果老树状态的试验株的茎(LJ1/LJ2/LJ3)和叶(LY1/LY2/LY3)],对测序得到的图像使用测序平台自带软件进行转化得到下机数据(表2),各样品Reads总数39 977 308~46 108 774,碱基总数6 036 573 508~6 962 424 874 bp,Q30长度5 716 781 952~6 612 601 369 bp.Q20碱基百分比均≥97.62%,Q30碱基百分比均≥94.38%.
2.6 JsTPS表达谱
通过派诺森基因云在线软件上传无环剥、环剥和结果老树的茎、叶基因表达谱数据,依据其FPKM值,在线绘制JsTPS家族基因表达交互热图(图3).聚类结果表明,gJsTPS2、JsTPS20、JsTPS21、JsTPS23、JsTPS41、JsTPS53、JsTPS54、JsTPS56、JsTPS58、JsTPS61、JsTPS67不表达,另外JsTPS8、JsTPS63、JsTPS44、JsTPS6、JsTPS18、JsTPS5、JsTPS60、JsTPS12、JsTPS59基因只在无环剥处理试验株的茎和结果老树的茎中高表达,JsTPS34、JsTPS9只在结果老树的茎中高表达,JsTPS43、JsTPS64、JsTPS62只在无环剥处理试验株的茎中高表达,JsTPS57、JsTPS50、JsTPS31、JsTPS42、JsTPS52、JsTPS45、JsTPS51、JsTPS25、JsTPS15、JsTPS13、JsTPS19基因只环剥处理试验株的茎中高表达,JsTPS66、JsTPS24、JsTPS30、JsTPS3、JsTPS31、JsTPS1基因只在环剥处理试验株的叶中高表达,JsTPS4、JsTPS55、JsTPS49、JsTPS47基因只在结果老树的叶中高表达,JsTPS17、JsTPS16基因只在无环剥处理试验株的叶和结果老树的叶中高表达,另外,也有基因同时在茎叶中表达,JsTPS10、JsTPS7只在结果老树的茎、叶中表达,JsTPS70同时在环剥处理试验株的茎和结果老树的叶中表达,且前者中表达量高于后者.JsTPS27、JsTPS40、JsTPS28同时在环剥处理试验株的茎、叶和无环剥处理的茎中表达,JsTPS27在环剥处理试验株的茎中表达量高于另外两种条件.JsTPS3g在环剥处理试验株的茎和无环剥处理试验株的茎和叶中表达,且在前者中表达量高于后两者.
2.7 JsTPS基因的RT-qPCR验证
经特异引物检测反转录得到深纹核桃cDNA,采用RT-qPCR分析在深纹核桃环剥与不环剥以及结果老树3种条件下,6个表达差异较大的JsTPS基因在叶和茎中的具体表达情况,试验重复3次并进行显著性检验和标准差分析(图4).结果表明,基因相对表达量的标准差较小,JsTPS6、JsTPS39、JsTPS37基因只在茎中表达而不在叶中表达,JsTPS32只在叶中表达而不在茎中表达,JsTPS49只在老叶片中高表达,JsTPS66只在环剥处理的试验株叶片中高表达,RT-qPCR分析结果和交互热图分析结果一致.
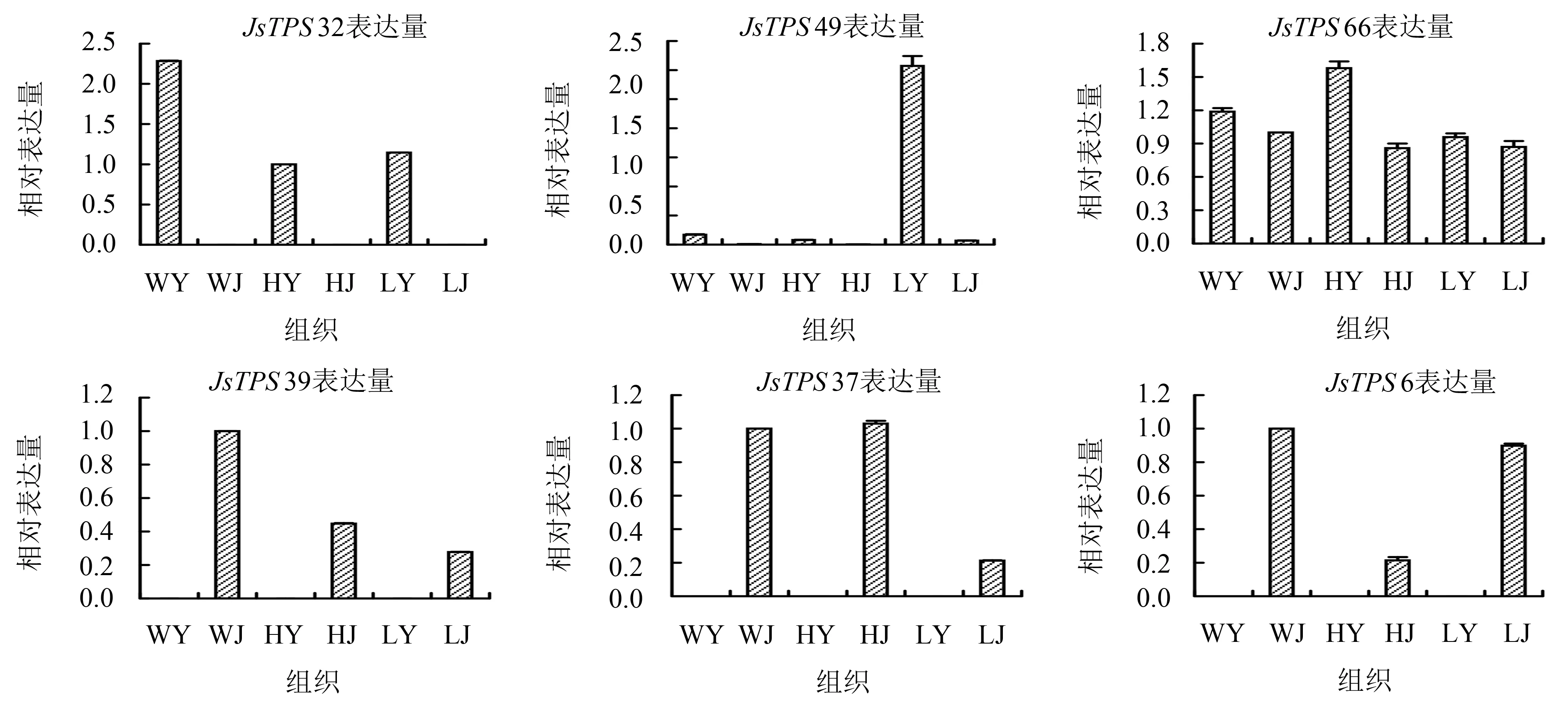
HJ:环剥植株的茎;HY:环剥植株的叶;WJ:不环剥植株的茎;WY:不环剥植株的叶;LJ:结果老树的茎;LY:结果老树的叶.图4 部分萜烯合成酶基因RT-qPCR验证Fig.4 RT-qPCR verification of JsTPSs family members in different treatments
3 讨论
比较基因组学是植物基因家族鉴定及功能研究的重要手段[17].相关研究为深纹核桃TPS基因家族的研究提供了依据,植物中TPS基因数量20~150条,除了小立碗藓基因组只含有1个TPS基因.深纹核桃基因组有65条TPS基因,属于中等数量.
本试验对于65个深纹核桃TPS蛋白的理化性质进行研究,结果表明,在所有蛋白的二级结构中,α-螺旋和无规则卷曲都占主要部分,其中α-螺旋所占比例大于无规则卷曲,这与前人对于烟草[5](Nicotianatobacum)和苹果[18](Maluspumila)的TPS蛋白序列二级结构的研究结果相同;毛竹[19](Phyllostachysedulis)和梨[1](Pyrusbretschneideri)的TPS基因家族蛋白的二级结构中,α-螺旋和无规则卷曲占据主要部分,其中大部分α-螺旋所占比例大于无规则卷曲;旁强强等[20]研究表明,大白菜(BrassicacampestrisL.)有15个BrTPS蛋白结构为无规则卷曲(占二级结构比例最高).在TPS基因家族蛋白的二级结构中,不同构造所占比例不同对植物造成的影响需要进一步研究.
赵荣荣等[1]研究表明,梨中33条TPS蛋白大部分定位于细胞质,也有少数定位于内质网、叶绿体、细胞核等部位.吕婧等[5]研究表明,普通烟草68个NtTPS蛋白中有34个定位于叶绿体,从侧面证明了烟草萜类物质主要从叶片分泌.本试验的结果表明,除JsTPS6、JsTPS23、JsTPS56蛋白分布于叶绿体和细胞质外,其余的62个JsTPS蛋白均位于叶绿体,这与普通烟草的研究结果相一致.有研究表明[21],萜类合成部位主要位于叶茎的腺毛中,此结果是否适用于深纹核桃,有待进一步试验验证.
松脂是多种萜烯类物质的混合物,对包括树皮甲虫(鞘翅目:Scolytidae)在内许多的食草动物有害,这可能是由植物防御机制所引起[22].Lombardero et al[23]研究表明,松树的本构松脂流在树木快速生长时期最少,而在限制生长时(干旱条件)最多,树木在生长速度较快的季节,树脂流量最高,松脂的形成与构成性防御和诱发性防御相关.Viiri et al[24]研究表明,挪威云杉被人工感染蓝变真菌(Ceratocystispolonica)后,萜烯化合物产生了较强的定量反应,韧皮部总萜烯化合物浓度显著升高,与本构值相比,接种点附近的总萜烯化合物浓度升高近100倍.这些研究表明,外界伤害诱导植物TPS基因表达上调.本试验结果表明,在3种状况下(环剥处理、未环剥处理的6年生嫁接树和结果老树),仅在茎中表达的JsTPS基因占61.1%,仅在叶中表达的JsTPS基因占20.4%,这说明深纹核桃中的TPS基因可能主要调控茎的生理活动,在组织中的表达具有特异性,此特征在中粒咖啡[11]、毛竹[19]、梨[1]等植物中均有出现.
研究表明[25],喜旱莲子草ApTPS19与JsTPS70蛋白分类最近,均具有DDXXD结构域,均无RXR、DDX(8)W结构域.当喜旱莲子草遭到昆虫取食或植株受损时,ApTPS19基因的表达量分别升高12.41和4.36倍,说明此基因具有即时防御功能.而JsTPS70基因在环剥处理的试验株的茎条中出现高表达现象,表达量高于老叶和其他状态,因此推测JsTPS70参与茎条中防御相关生理活动.而JsTPS66只在环剥处理试验株的叶片中高表达,因此推测JsTPS66参与叶片中防御相关生理活动.本试验结果可为JsTPS基因家族的功能研究和深纹核桃良种选育提供依据.
