烟草灰霉病菌对3种杀菌剂的敏感性
2021-11-18李鸿浩林智慧梁颁捷陈承亮刘国坤
李鸿浩, 徐 超, 林智慧, 顾 钢, 周 挺, 梁颁捷, 陈承亮, 石 妍, 刘国坤, 肖 顺
(1.福建农林大学植物保护学院,福建 福州 350002;2.福建省烟草公司三明市公司,福建 三明 365000;3.福建省烟草公司烟草科学研究所,福建 福州 350003)
福建省是我国重要植烟区.邓真等[1]于2009—2011年对福建省烟区病害进行调查发现,烟草灰霉病在各烟区普遍发生,个别地区发病严重,其病原菌为害烟株的茎、叶和花器,对烟草产量及品质均造成影响.据三明烟草公司统计,仅2015年三明烟区发生灰霉病的面积就达5.64 hm2,累计产量损失约1.5×106kg.
目前,对于灰霉病的防治主要依赖于化学药剂.许多学者对不同类型药剂对烟草灰霉病的防治效果进行了研究.例如:宫飞燕等[2]研究发现,咪鲜胺、多氧霉素、异菌脲、多菌灵、腐霉利、乙烯菌核利、嘧霉胺和代森锰锌对灰霉病菌菌丝生长的有效抑制中浓度(EC50)值分别为0.03、2.21、3.48、6.79、23.21、24.74、34.94和621.36 mg·L-1;周浩等[3]研究发现,多菌灵、丙环唑、嘧霉胺和异菌脲对4株烟草灰霉病菌菌丝生长的EC50平均值分别为0.06、0.36、0.53和0.60 mg·L-1;汪汉成等[4]研究发现,氟啶胺、咪鲜胺、苯醚甲环唑和代森锰锌对烟草灰霉病菌菌丝生长的EC50值分别为0.02、0.03、0.39和7.86 mg·L-1.由此可见,不同研究中相同药剂对烟草灰霉病菌的抑制作用存在一定差异,这可能与菌株不同有关.
腐霉利和异菌脲属于二甲酰亚胺类杀菌剂,是生产中用于防治灰霉病的重要杀菌剂;嘧霉胺属于苯氨基嘧啶类杀菌剂,对灰霉病具有特效[5-7].本研究从福建省6个烟区采集灰霉病样品,经分离鉴定后,选择30株菌株作为供试菌株,检测其对腐霉利、异菌脲及嘧霉胺的敏感性,以明确这些药剂对福建省烟区灰霉病菌的抑制作用,为今后烟区合理用药提供理论基础.
1 材料与方法
1.1 材料
烟草灰霉病样品:2016年4—5月采集于福建省6个植烟区烟草站,包括泰宁县下渠烟草站、沙县富口村烟草站、建宁县烟草站、清流县烟草站、大田县太华镇万湖村烟草站及永安市大湖烟草站,每个站点随机采集发病叶片10片.
分离培养基:马铃薯葡萄糖(PDA)培养基,制备方法参考文献[8].
杀菌剂:腐霉利[procymidone,50%水分散粒剂,兴农药业(中国)有限公司],异菌脲[iprodione,500 g·L-1悬浮剂,拜耳作物科学(中国)有限公司],嘧霉胺(pyrimethanil,50%可湿性粉剂,寿光晨阳农化有限公司).所有药剂用无菌水配成质量浓度为100 μg·mL-1的母液备用.
1.2 方法
1.2.1 菌株分离 采用组织分离法[8]分离菌株:取病健交界处小块组织于体积分数为70%的乙醇中浸泡2 s,然后转入体积分数为5%的次氯酸钠溶液再次消毒10 min,无菌水漂洗3次,再用无菌滤纸吸去表面水分后接于PDA平板中央,25 ℃黑暗培养3 d,挑取新鲜菌丝培养直至纯化.每个采集地随机选择5株菌株进行后续试验.
1.2.2 病原菌形态观察 将分离到的30株菌株接种于PDA平板上,25 ℃黑暗培养7 d,记录菌落与菌核的颜色和形态.在光学显微镜(Nikon ECLIPSE Ni-U)和体式显微镜(Nikon SMZ18)下观察病原菌分生孢子梗及孢子形态特征并拍照.
1.2.3 病原菌分子鉴定 收集0.5~1.0 g菌丝于2 mL离心管中,盖紧后投入液氮中快速冷却1 min,取出离心管并用研磨棒粉碎菌丝,然后根据Biospin真菌基因组DNA提取试剂盒说明书进行DNA提取.
以表1的引物扩增目的基因.ITS区PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min[9]. HSP60、RPB2基因PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环,72 ℃ 10 min,4 ℃终止反应[10].扩增G3PDH基因的退火温度为64 ℃,其他程序同HSP60、RPB2序列的扩增.所有PCR扩增体系:ddH2O 9.5 μL,引物ITS1和ITS4各1 μL,DNA模板 1 μL,PremixTaqTM(TAKARA)12.5 μL.引物由上海生物工程技术服务有限公司合成.反应完成后,取4 μL PCR产物于质量分数为1%的琼脂糖凝胶上进行电泳检测.将扩增产物送至上海生物工程技术服务有限公司进行双向测序,采用软件DNAMAN 7.0 (Lynnon BioSoft,魁北克,加拿大) 对获得的序列进行比对拼接,最后将序列在NCBI数据库(http://www.ncbi.nlm.nih.gov/blast/)中进行对比鉴定.

表1 PCR扩增和测序所用引物[10-11]Table 1 Primers for PCR amplification and sequencing
1.2.4 药剂敏感性测定 采用菌丝生长速率法[12]测定30株菌株对杀菌剂腐霉利、异菌脲和嘧霉胺的敏感性.在菌落边缘打取菌饼(Ø=50 mm),分别接种于含不同浓度药剂的PDA平板上,以不含药剂的PDA平板为对照,每个处理4次重复.将所有接种平板置于23 ℃黑暗培养7 d,待对照菌落直径约为培养皿的2/3时,用十字交叉法测量各浓度处理的菌落直径,计算各浓度药剂对菌株生长的抑制率.试验中腐霉利的终浓度分别为0.010、0.025、0.030、0.050和0.100 μg·mL-1;异菌脲的终浓度分别为0.04、0.05、0.07、0.10和0.20 μg·mL-1;嘧霉胺的终浓度分别为0.047、0.056、0.070、0.090和0.140 μg·mL-1.
1.2.5 数据分析 采用Excel 2016和DPS V7.05软件对试验数据进行统计分析.
2 结果与分析
2.1 烟草灰霉病病原菌形态特征
所有菌株的菌丝和菌落形态均相似:菌丝在生长初期为无色或浅色,生长中后期颜色加深,为浅褐色或深褐色;菌落生长初期均为灰白色,且多数菌落呈棉絮状或匍匐状,后期气生菌丝较发达且致密(图1A);分生孢子梗细长、直立,具分隔且有分枝,分生孢子梗底部略微膨大,顶端的产孢细胞膨大呈球状,其上生长小柄并产生大量分生孢子,呈葡萄穗状,分生孢子为单细胞,呈卵圆形,长 7.17~10.23 μm,平均(8.44±0.75) μm,宽5.21~6.31 μm,平均(5.75±0.34) μm(图1B,1C);培养7 d后,菌落开始产生菌核(图1D),菌核初期呈白色,后颜色逐渐加深,变黑变硬.由此初步判断该病原菌为灰葡萄孢(BotrytiscinereaPers.).
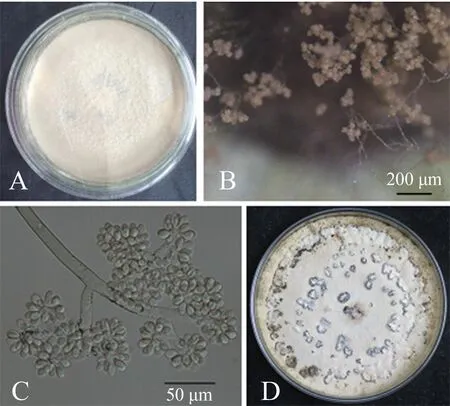
A.菌落;B.分生孢子;C.孢子梗;D.菌核.图1 烟草灰霉病病原菌的形态特征Fig.1 Morphological characteristics of tobacco gray mold pathogen
2.2 rDNA-ITS序列分析
采用真菌通用引物ITS1和ITS4对30株菌株进行PCR扩增,均获得约540 bp的片段.测序后将所有序列于NCBI中进行BLAST比对,结果表明,30株菌株与灰葡萄孢的同源性在97.35%~99.63%之间.选取其中同源性最高(99.63%)的一个序列上传,该序列名称为fafu01,登录号为MW629853.1. RPB2、G3PDH、HSP60基因扩增分别获得约1 100、900、1 000 bp的片段,与目的片段大小一致.综合病原菌形态特征及ITS序列比对结果,可确定本研究分离的烟草灰霉病病原菌均为灰葡萄孢.
2.3 30株菌株对腐霉利的敏感性
供试的30株灰霉病菌菌株对腐霉利的敏感性无显著差异,其EC50平均值在0.73~1.11 μg·mL-1之间.不同植烟区的菌株对腐霉利的敏感性差异倍数有所不同:来自大田县的菌株差异最大,差异倍数为5.44;其他采集地的菌株差异倍数均小于2.00 .敏感性最低和最高的菌株均来自大田县(表2).

表2 不同植烟区烟草灰霉病菌对腐霉利的敏感性1)Table 2 Sensitivity of B.cinerea collected from different planting regions to procymidone
1)差异倍数为EC50最大值与最小值的比值.
2.4 30株菌株对异菌脲的敏感性
供试的30株菌株对异菌脲的敏感性无显著差异,其EC50平均值在0.41~1.01 μg·mL-1之间.不同植烟区的菌株对异菌脲的敏感性差异有所不同:来自大田县的菌株差异最大,差异倍数为3.17;来自沙县的菌株次之,差异倍数为2.49;其他采集地的菌株差异倍数均小于2.00.敏感性最低的菌株来自沙县和清流县,敏感性最高的菌株来自大田县(表3).

表3 不同植烟区烟草灰霉病菌对异菌脲的敏感性1)Table 3 Sensitivity of B.cinerea collected from different planting regions to iprodione
2.5 30株菌株对嘧霉胺的敏感性
供试的30株菌株对嘧霉胺的敏感性无显著差异,其EC50平均值在0.77~1.18 μg·mL-1之间.不同植烟区的菌株对嘧霉胺的敏感性差异有所不同:来自泰宁县的菌株差异最大,差异倍数为3.55;来自大田县的菌株次之,差异倍数为3.17;其他采集地的菌株差异倍数均小于3.00.敏感性最低的菌株来自建宁县和永安市,敏感性最高的菌株来自泰宁县(表4).

表4 不同植烟区烟草灰霉病菌对嘧霉胺的敏感性1)Table 4 Sensitivity of B.cinerea collected from different planting regions to pyrimethanil
3 讨论
本研究对福建省6个植烟区的烟草灰霉病病原菌进行了分离,结合形态学和分子生物学手段对其中30株菌株进行了鉴定,结果表明所有菌株均为灰葡萄孢.
腐霉利对30株烟草灰霉病菌菌丝生长的EC50值范围为0.38~2.06 μg·mL-1.已有研究表明,腐霉利对来自草莓和蓝莓的灰霉菌菌株的EC50值为0.07~5.76 μg·mL-1[13].可见,腐霉利对不同灰霉菌菌株的EC50值差异很大.
异菌脲对30株烟草灰霉病菌菌丝生长的EC50值范围为0.23~1.17 μg·mL-1.Avenot et al[14]通过对来自葡萄、开心果和石榴的灰霉病菌进行研究认为,当异菌脲对菌丝生长的EC50值小于1 μg·mL-1时,菌株为敏感菌株;Baggio et al[15]研究表明,当异菌脲对草莓灰霉病菌菌丝生长的EC50值大于1.2 μg·mL-1时,菌株为抗性菌株;Chen et al[16]研究也表明,异菌脲对黑莓灰霉病菌菌丝生长的EC50值为2.596 μg·mL-1,其对灰霉病的防效大幅降低.由此推测福建烟草灰霉病菌可能有部分菌株出现了一定抗性,但抗性比较低.
嘧霉胺对30株烟草灰霉病菌菌丝生长的EC50值范围为0.33~1.22 μg·mL-1.已有研究表明,当嘧霉胺对草莓灰霉病菌菌丝生长的EC50值大于5.0 μg·mL-1时,菌株为抗性菌株[15].由此推测本研究中的供试菌株尚未对嘧霉胺产生抗性.
综上所述, 3种药剂对30株烟草灰霉病菌菌株的抑制效果都比较好,但从EC50平均值来看,效果最好的是异菌脲(0.71 μg·mL-1),腐霉利(0.91 μg·mL-1)次之.
致谢:感谢福建农林大学植物保护学院陈凤平博士在论文写作过程中给予的帮助!
