猴头菇三萜提取工艺优化及其抗氧化活性分析
2021-11-14李英迪夏其乐毛荣良
李英迪,曹 艳,夏其乐, ,杨 开,毛荣良
(1.浙江省农业科学院 食品科学研究所,农业农村部果品采后处理重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,浙江杭州 310021;2.浙江工业大学食品科学与工程学院,浙江杭州 310014;3.常山县豪锋农业发展有限公司,浙江常山 324207)
猴头菇,又名猴头菌、刺猬菌等,属担子菌门、齿菌科、猴头属,是药食两用真菌和野生美味佳肴,是中国著名的四道菜之一[1-2]。猴头菇中含多糖类、甾醇类、萜类、酚类等活性成分,具有抗氧化、降血脂、增强免疫力、抗癌、抗肿瘤、延缓衰老等功效[3-5]。石凤敏等[6]指出可以通过多糖和三萜类化合物的含量评价灵芝药用价值和品质。萜类化合物是由甲戊二羟酸衍生而成的天然产物,由多个异戊二烯结构单位构成,其中三萜类固醇和皂苷在细胞质中利用甲羟戊酸途径中的IPP合成[7-8],是一类重要的次级代谢产物,除了具有抗肿瘤、抗炎、抗菌、抗病毒、降血糖等功能外,还具有其他活性,如免疫调节、抗氧化、抗衰老、神经保护等生物学和药理学作用,具有广阔的开发应用前景[7,9]。Bourgou等[10]从精油中分离出四种萜类化合物,通过氧自由基吸收能力评估萜类化合物的生物活性,发现其在体外均表现出抗氧化活性。凡芸等[11]以杏鲍菇为原料,采用超声辅助法提取三萜化合物,最佳条件为:乙醇体积分数70%、料液比1:30 g·mL-1、超声时间25 min、提取温度60 ℃,在此条件下,杏鲍菇中总三萜化合物的提取率达到1.140%。邓春萌等[12]研究牛樟芝固态发酵菌丝体中三萜的最佳提取工艺条件为:浸提时间3 h、料液比1:30(g·mL-1)、温度70 ℃,在此条件下,得率为3.43%。杨开等[13]对牛樟芝总三萜超声辅助提取的最佳工艺条件为:提取时间41 min、提取功率80 W、料液比1:20,总三萜得率为3.84%±0.18%。牛樟芝三萜提取物具有较强的还原能力,并能有效清除DPPH自由基、ABTS自由基和超氧阴离子自由基,其半清除浓度(EC50)分别为0.29、0.50、0.33 mg·mL-1。邹思等[14]采用回流提取法提取虎奶菇菌核总三萜最佳工艺参数为:乙醇浓度95%、提取时间2 h、提取温度90 ℃、料液比1:15( g·mL-1),提取率为(2.29±0.06)mg·g-1。菌核醇提物对羟自由基、DPPH自由基清除活性和ABTS自由基的清除能力半数抑制浓度(IC50)分别为(0.425±0.01)、(3.25±0.05)和(18.35±2.32)mg·mL-1,其表现出较强的羟自由基和良好的DPPH自由基清除活性,对ABTS自由基的清除能力相对较弱。萜类化合物具有非常好的应用前景,目前还没有关于猴头菇三萜类的研究。
本文以猴头菇为原料,利用响应面法优化猴头菇三萜提取工艺,以三萜得率为评价指标,并初步探索猴头菇三萜的体外抗氧化活性,以期为开发天然抗氧化剂和功能性食品提供参考。
1 材料与方法
1.1 材料与仪器
猴头菇 常山县豪锋农业发展有限公司提供干制品;1, 1-二苯基-2-苦基肼(DPPH)、2, 2'-氨基-双(3-乙基苯并噻唑胶-6-磺酸)二铵盐(ABTS)、铁氰化钾 均购自上海源叶;乙醇、香草醛、冰乙酸、三氯乙酸、三氯化铁、高氯酸 均为分析纯,上海凌峰化学试剂有限公司。
UV-1800紫外/可见分光光度仪 日本岛津公司;SCIENTZ-18N冷冻干燥机 宁波新芝生物科技股份有限公司;R1002B旋转蒸发器 上海申生科技有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;LXJ-HB飞鸽低速大容量离心机 上海安亭科学仪器厂;BJ-300多功能粉碎机 德清拜杰电器有限公司。
1.2 实验方法
1.2.1 原料预处理 将猴头菇干制品粉碎机粉碎,过100目筛,密封后置于4 ℃冷藏,备用。
1.2.2 三萜提取响应面实验 在前期预实验的基础上,进行提取工艺的优化。称取一定量的猴头菇干粉,按照不同料液比(1:10、1:20、1:30 g·mL-1)和乙醇浓度(40%、60%、80%)进行超声辅助(40、60、80 ℃)提取30 min(保鲜膜覆盖,防止挥发)。所得提取液4000 r·min-1离心10 min,收集上清液,即猴头菇三萜提取液。将所得上清液旋蒸浓缩,冷冻干燥得提取物粉末。
采用Design Expert 10.0.3软件进行三因素三水平试验确定超声辅助(功率500 W,频率40 kHz,30 min)提取猴头菇三萜的最佳工艺参数,中心组合试验因素和水平见表1。

表1 猴头菇三萜提取试验的因素和水平Table 1 Factors and levels of extraction experiment triterpenoids from Hericium erinaceus
1.2.3 猴头菇三萜含量的测定
1.2.3.1 标准曲线的绘制 参照王豪等[15]方法,三萜测定以齐墩果酸为标准品,依次吸取0.2 mg·mL-1齐墩果酸标准品溶液0、0.1、0.2、0.3、0.4、0.5 mL于25 mL比色管中,氮吹仪吹干溶剂,加入0.5 mL 50 g·L-1的香草醛-冰乙酸和1.0 mL高氯酸,混合后60 ℃水浴20 min,冰水冷却15 min后加入3.0 mL冰乙酸,室温反应10 min,最后于547 nm处测吸光值,以齐墩果酸标准品浓度W(mg·L-1)为横坐标,吸光值A为纵坐标,绘制三萜含量标准曲线,并得线性回归方程。
1.2.3.2 三萜得率的计算 取150 μL提取液,用氮吹仪吹干样品,按1.2.3.1标曲操作测定样品浓度。根据标曲方程计算样品三萜含量。三萜得率可根据公式计算:

式中:M表示猴头菇三萜得率(%);C表示齐墩果酸浓度(mg·mL-1);V表示提取液的总体积(mL);N表示稀释倍数;m表示猴头菇质量(g)。
1.2.4 抗氧化实验 抗氧化实验测定时,用60%乙醇将猴头菇三萜提取物配制成0.1~2.5 mg·mL-1浓度的样品待测液。
1.2.4.1 DPPH·清除能力测定 将猴头菇三萜提取液旋蒸浓缩并冷冻干燥成粉末,加60%乙醇配制成0.5、1.0、1.5、2.0、2.5 mg·mL-1浓度的样品待测液。参照杜丽娟等[16]方法,并据实验情况稍作修改。取各浓度样品溶液0.8 mL,加入3.8 mL浓度为0.1 mmol·L-1的DPPH 溶液(无水乙醇配制),摇匀后黑暗放置30 min,并于517 nm处测吸光值。VC为阳性对照,计算DPPH·清除率公式如下:

式中:Ax为不同浓度样品溶液的吸光值;Ax0为0.8 mL不同浓度样品溶液和3.2 mL无水乙醇的吸光值;A0为0.8 mL蒸馏水和3.2 mL DPPH溶液的吸光值。
1.2.4.2 还原力测定 将猴头菇三萜提取液旋蒸浓缩并冷冻干燥成粉末,加60%乙醇配制成0.5、1.0、1.5、2.0、2.5 mg·mL-1浓度的样品待测液。参照林源等[17]方法,并据实验情况稍作修改。取各浓度样品溶液2.0 mL,加入2.0 mL浓度为0.2 mol·L-1磷酸盐缓冲液(pH6.6)和2.0 mL 1%铁氰化钾溶液混合均匀后于50 ℃水浴20 min,再加入2.0 mL 10%三氯乙酸溶液后离心(3000 r·min-1,5 min),取2.0 mL上清液,加入2.0 mL蒸馏水、0.4 mL 0.1%FeCl3溶液混匀,50 ℃水浴10 min后在700 nm处测吸光值。蒸馏水代替样品溶液作为空白对照,VC为阳性对照。
1.2.4.3 ABTS+·清除能力测定 将猴头菇三萜提取液旋蒸浓缩并冷冻干燥成粉末,加60%乙醇配制成0.1、0.2、0.3、0.4、0.5 mg·mL-1浓度的样品待测液。参照吴美媛等[1]方法,并据实验情况稍作修改。将7 mmol·L-1ABTS+·溶液与2.45 mmol·L-1过硫酸钾溶液等量混合反应,室温避光放置12~16 h得到ABTS+·储备液。在734 nm波长处,用磷酸盐缓冲液(10 mmol·L-1,pH7.4)将ABTS+·储备液稀释至吸光值达到0.70±0.02,得到ABTS+·测定液。取各浓度样品溶液1.0 mL与2.0 mL上述ABTS+·测定液混合均匀,室温避光反应6 min后于734 nm波长处测定吸光值。VC为阳性对照,计算ABTS+·清除率公式如下:

式中:Ai为不同浓度样品溶液的吸光值;Aj为不同浓度样品溶液和磷酸盐缓冲液的吸光值;A0为蒸馏水和ABTS+·测定液的吸光值。
1.3 数据处理
平行实验3次,结果以均值±标准差(means±SD)表示,数据采用SAS 8.1进行显著性分析,使用Microsoft Excel绘图,Design Expert 10.0.3软件得到响应面图。
2 结果与分析
2.1 标准曲线的绘制
根据1.2.3.1标曲测定方法,分别以齐墩果酸标准品浓度为横坐标,547 nm处吸光值为纵坐标绘制标准曲线,得线性回归方程为:y=0.0349x+0.0018,R2=0.9907。结果表明三萜含量在0~25 mg·L-1范围内线性关系良好。标准曲线如图1所示。

图1 齐墩果酸标准曲线Fig.1 Standard curve of oleanolic acid
2.2 响应面优化结果
乙醇浓度、温度和料液比对三萜提取均有影响,为探究各因素之间的相互作用,确定最优条件,由Box-Behnken法设计试验[18],有5个试验中心点,共17个试验点,以三萜得率为响应值,响应面法对猴头菇三萜类化合物提取工艺优化的试验方案及真实值如表2所示。与传统的多因素单变量优化实验相比,响应曲面法可以研究各因素之间的相互作用,具有试验次数少、省时省力、精确等优点[19]。
对表2实验数据进行回归拟合,得到三萜得率的二次多项回归模型为:

表2 猴头菇三萜类化合物提取试验设计与试验结果Table 2 Experimental design and results of triterpenoid extracts from Hericium erinaceus

其中,Y代表三萜得率的预测响应值,X1代表乙醇浓度(%)的编码值,X2代表温度(℃)的编码值,X3代表料液比(g/mL)的编码值。
对试验结果进行方差分析结果见表3,回归模型具有较高的F值(150.87)和极低的P值(<0.0001),表明该模型是高度显著的。复决定系数R2=0.9949,表明料液比、乙醇浓度和提取温度存在良好线性关系,模型误差小、拟合度较高。决定系数R2Adj为0.9883,说明该模型可信度较高,能够解释98.83%的响应值变化。信噪比Adeq Precision为38.837>4,表明方程的拟合度和可信度极高,可用此模型对猴头菇三萜类化合物提取的影响因素进行可靠分析和预测。由表3各因素F值可知,各个因素对三萜类化合得率的影响程度为乙醇浓度(X1)>温度(X2)>料液比(X3)。

表3 三萜类化合物回归模型方差分析Table 3 Analysis of variance in regression model of triterpenes
2.3 三萜提取工艺的响应曲面分析、最佳工艺参数确定
Design Expert 10.0.3软件得到响应面图(图2~图4)显示了不同试验因素(乙醇浓度、温度以及料液比)对猴头菇三萜类化合物提取的影响。由图2~图4可以看出各因素及其相互作用的影响,在试验水平范围内出现了一个最高点,即为三萜得率较高点,响应面图所示最大响应值与回归方程所得结果一致。黑育荣等[20]对桦菌芝三萜最佳提取工艺参数为:乙醇浓度70%,超声温度70 ℃,时间15 min,料液比1:15,提取率为3.87 mg·g-1。温慧萍等[21]对灵芝孢子粉三萜最佳提取条件:乙醇浓度80%,固液比1:23,超声功率540 W,提取温度40 ℃,提取时间15 min,提取率7.054 mg·g-1。由于原材料不同,最优提取条件下的得率也会有所差别。由Design Expert 10.0.3软件分析结果可知,猴头菇三萜类化合物超声波辅助提取的最佳工艺参数为:乙醇浓度58.57%,温度57.25 ℃,料液比1:14.61(g:mL)。工艺参数预测的三萜得率为0.28%。为了操作方便,将最佳工艺参数设定为乙醇浓度60%,温度55 ℃,料液比1:15(g:mL)。为检验响应面分析法可靠性,采用上述最优条件3次重复试验得率为0.28%,与预测值较为接近,表明该模型对猴头菇三萜类化合物的提取工艺参数准确可靠,具有实际应用价值。
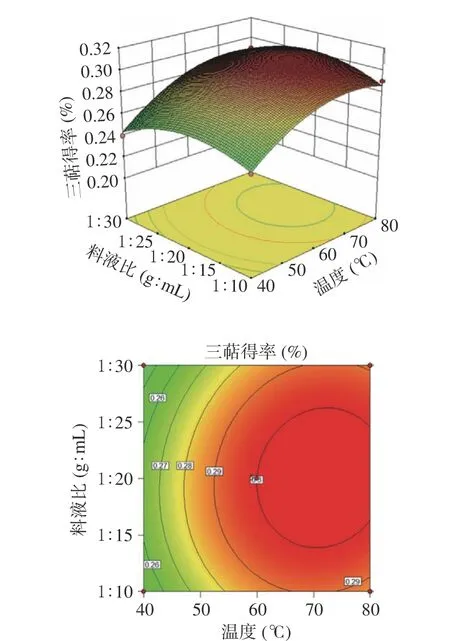
图2 提取温度与料液比对猴头菇三萜得率影响的响应曲面图和等高线图Fig.2 Response surface graph and contour plot of the effect of extraction temperature and material-liquid ratio on the yield of Hericium erinaceus triterpenes

图3 乙醇浓度与料液比对猴头菇三萜得率影响的响应曲面图和等高线图Fig.3 Response surface graph and contour plot of the effect of ethanol concentration and material-liquid ratio on the yield of Hericium erinaceus triterpenes

图4 乙醇浓度与提取温度对猴头菇三萜得率影响的响应曲面图和等高线图Fig.4 Response surface graph and contour plots of the effect of ethanol concentration and extraction temperature on the yield of Hericium erinaceus triterpenes
2.4 猴头菇三萜抗氧化活性
2.4.1 DPPH·清除能力 如图5所示,当提取物浓度在0.5~2.5 mg·mL-1范围时,随着提取物浓度的增加对DPPH·清除率逐渐增加,提取物浓度与DPPH·清除率呈正相关量效关系。在质量浓度为2.5 mg·mL-1时,对DPPH·清除率为25.4%,清除率相对较低。帅良等[22]研究百香果果皮多糖对DPPH·清除能力时,也发现其清除率相对较低,质量浓度为2.0 mg·mL-1时,清除率为32.8%。而VC质量浓度在0.01~0.05 mg·mL-1范围内增加显著,超过0.03 mg·mL-1时,对DPPH·清除率趋于平缓,0.05 mg·mL-1时达到95.2%。由图5可知,猴头菇三萜对DPPH·具有一定的清除能力,其中,IC50值(6.375±0.020) mg·mL-1明显高于VC的IC50值(0.0194±0.0060) mg·mL-1,说明猴头菇三萜抗氧化能力相比VC较弱,这与张意笠等[23]研究结香花总黄酮对DPPH·清除率弱于VC的结果一致。

图5 猴头菇三萜对DPPH·清除率Fig.5 DPPH· scavenging rate of Hericium erinaceus triterpenes
2.4.2 还原能力 样品的抗氧化能力与还原性有关,还原力越强,抗氧化能力越强。由图6可知,样品浓度为0.5~2.5 mg·mL-1时,提取物还原能力随样品浓度的增加呈明显的量效关系,测得700 nm处的吸光值由0.107增加到0.553。其中,2.5 mg·mL-1提取物还原力与0.05 mg·mL-1的VC相当,虽然提取物还原力较VC弱,但也表现出一定的还原能力。
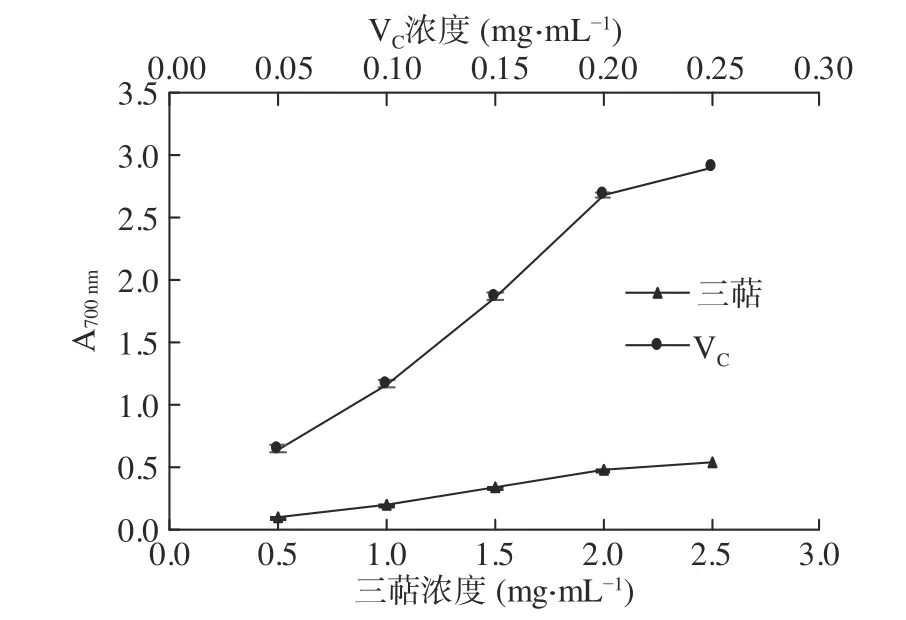
图6 猴头菇三萜还原能力Fig.6 Reducing power of Hericium erinaceus triterpenes
2.4.3 ABTS+·清除能力 如图7所示,当提取物浓度在0.1~0.5 mg·mL-1范围时,对ABTS+·清除率随着提取物浓度的增加而增加,具有良好的线性关系和剂量关系。当浓度达到0.5 mg·mL-1时,对ABTS+·清除率达到64.4%,其IC50值为(0.355±0.040)mg·mL-1,表明猴头菇三萜对ABTS+·具有良好的清除作用。结合参考文献[24]及前期实验浓度VC浓度在0.01~0.05 mg·mL-1范围时,对ABTS+·清除率稳定在97%左右,由此可见,猴头菇三萜与VC相比对ABTS+·清除能力较弱。分 的 分 离 与 鉴 定[J]. 食 品 工 业 科 技,2019,40(21):32-37.[ZHOU C H, HUANG Y, LIU T T, et al. Isolation and identification of the components of the fractions in ethyl acetate phase from ethanol extract ofHericium erinaceus[J]. Food Industry Technology,2019,40(21):32-37.]

图7 猴头菇三萜对ABTS+·清除率Fig.7 ABTS+· scavenging rate of Hericium erinaceus triterpenes
3 结论
本研究通过Box-Behnken试验设计结合响应面法优化猴头菇三萜提取的影响因素乙醇浓度、提取温度、料液比,最终确定最佳提取工艺条件为:乙醇浓度60%,温度55 ℃,料液比1:15(g:mL),三萜得率相对较高,为0.28%,与预测值接近,说明响应曲面法准确可靠,能合理优化猴头菇三萜的提取工艺,为进一步开发利用提供理论参考。以DPPH·自由基清除率、还原力、ABTS+·自由基清除率为指标测定抗氧化活性,DPPH和ABTS+的IC50值分别为(6.375±0.020)和(0.355±0.040) mg·mL-1,说明猴头菇三萜具有一定的抗氧化性。
