NO延缓新鲜果蔬成熟衰老和提高抗性效果及作用机制研究进展
2021-11-14朱丽娟侯佳迪王军萍刘少伟郁志芳
朱丽娟,侯佳迪,王军萍,刘少伟,郁志芳
(南京农业大学食品科技学院,江苏南京 210095)
成熟衰老是新鲜果蔬的重要生物学过程,伴随诸多新陈代谢和外观的快速变化,通常与细胞壁的软化[1]、叶绿素的降解[2]、新色素的合成(如类胡萝卜素、叶黄素、类黄酮)[1-3]、挥发性有机物的积累和释放[4]、蛋白质的合成以及可溶性物质含量的改变[3-5]等密切联系。与果蔬成熟衰老相关的代谢则与其体内许多重要的酶促和非酶促抗氧化系统有关,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)及谷胱甘肽还原酶(GR)、抗坏血酸(ASA)和酚类物质等[6]。虽然上述抗氧化系统能够使果蔬在成熟衰老初期保持氧化还原平衡,但在成熟衰老的代谢和结构分解过程中,果蔬仍会发生不可逆的氧化应激反应[7]。新鲜果蔬根据其成熟期间是否出现呼吸跃变,可分为呼吸跃变型(如苹果、桃、香蕉、芒果等)和非呼吸跃变型(如甜橙、草莓、杨梅、黄瓜等)两类。一般认为,果蔬呼吸高峰的出现与植物体内乙烯含量的迅速增加有关。
NO作为一种可自由扩散的膜透性信号分子[5],参与了果蔬成熟和衰老过程。Leshem等[8]于1996年提出NO可以通过抑制乙烯的生成,调控成熟与衰老进程。有研究发现,果蔬成熟过程发生的变化不仅与活性氧(ROS)和抗氧化物代谢有关,同时也与NO有关,并提出在呼吸跃变型和非呼吸跃变型果实中都存在着硝基-氧化应激反应[9]。近年来,多数研究主要集中于NO对果实成熟的影响和调控机制及其它与成熟相关的方面,如贮藏期间的冷害及病原微生物的侵染对果蔬品质产生的影响。利用外源NO调控果蔬的成熟并应用于保鲜,已成为当前采后生物学领域的研究热点之一。
本文总结了近年来NO在果蔬采后延缓成熟衰老、增强冷害和病害抗性方面的效应和作用机制,提出了NO在果蔬采后应用的未来研究方向。
1 NO对果蔬成熟衰老的影响
1.1 延缓果蔬成熟
NO已被证明在各类果蔬中都起到了延缓成熟衰老的作用。目前,许多研究表明NO可通过与乙烯的拮抗作用来延缓果蔬成熟并提高果蔬贮藏过程中的抗逆性,改善采后品质、延长货架期。Singh等[10]研究发现,10 μL/L的NO熏蒸日本李果实2 h,可显著抑制21 ℃贮藏下果实的呼吸速率和乙烯释放速率,并延缓果实迟熟3~4 d及其可滴定酸的下降。Han等[11]利用10 μL/L的NO熏蒸‘霞晖6号’桃果实3 h并置于4 ℃下24 d,与对照相比,处理果实乙烯的释放速率显著降低且保持较高硬度,NO处理还提高了果实蔗糖磷酸合成酶的活性,使贮藏期间的果实在延缓衰老的同时仍保持了较高的蔗糖含量。NO也能在非呼吸跃变型果蔬成熟的过程中发挥作用。Zhao等[12]利用20 μL/L外源NO熏蒸冬枣3 h并在0 ℃下贮藏75 d,结果表明,NO可显著降低冬枣的失重率与腐烂率,使其保持较高的硬度和较低的呼吸速率,抑制丙二醛(MDA)含量和细胞膜通透性的增加,延缓冬枣衰老。300 μL/L的NO熏蒸葡萄2 h,可减轻0 ℃下贮藏葡萄ROS的积累和膜脂过氧化程度,贮藏结束时,处理果实的失重率和和褐变指数分别比对照低133.82%和34.20%[13]。
除NO气体外,也可利用硝普钠(SNP)作为外源NO供体。以0.2 mmol/L的SNP浸泡处理猕猴桃10 min并置于20 ℃下贮藏,可有效延缓贮藏期间猕猴桃果实硬度和维生素C(VC)含量的下降,抑制可溶性固形物(SSC)的上升和可滴定酸(TA)的下降速率,降低代谢强度,有效延缓其成熟,有利于果实品质的保持[14]。‘台农’芒果经0.25 mmol/L的SNP浸泡2 min后,可有效抑制呼吸速率和失重率、保持硬度、延缓颜色转变,使其保持良好的果品品质[15]。有关内源NO在果蔬成熟过程的作用也有所研究,15 kJ/m2的UV-B照射处理芒果4 h后,可提高果实在6 ℃冷藏期间内源性NO的含量,令其保持较高的硬度并减少冷害[16]。
果蔬成熟过程中,NO在很大程度上调节包括乙烯在内的多种植物激素的活性。无论是外源施用NO还是提高内源性NO,都能起到延缓果蔬成熟衰老的作用。对于常温贮藏的果蔬,NO能降低呼吸强度与乙烯释放速率以延缓成熟,延长货架期并保持良好的品质。对于低温贮藏的果蔬,NO可通过提高抗氧化能力使其产生良好的抗逆性,降低氧化损伤并减少冷害。
1.2 延缓果蔬成熟机理
NO是一种有效调节植物生长的信号分子且具有双重影响,低浓度的NO帮助植物延缓衰老并抵御胁迫,高浓度则抑制生长,加速衰老[8]。植物组织中,NO可通过质外体作用于细胞壁组分,NO氧化产生的自由基(NO·、NO+、NO)可与细胞壁组分作用促进细胞的扩展,进而促进生长[17]。随浓度升高,NO进一步作用于细胞膜的磷脂双分子层,增强膜的流动性;当NO浓度更高时,它会与过氧亚硝酸盐、超氧阴离子作用导致膜渗漏,甚至还会扩散进入细胞质,攻击关键酶类加速组织衰老[17]。
乙烯是植物体内的重要激素,从果实的成熟与软化到叶片的衰老等都受其调控。乙烯的生物合成过程包括两步骤(图1)[1]。如图1所示,NO对乙烯代谢的调节存在三个作用位点。首先,NO可对SAM合成酶(SAMS)的蛋白质巯基进行可逆的S-亚硝基化修饰而令其失活[18],进而抑制SAM的合成并使乙烯产量减少。Lindermayr等[19]曾对拟南芥进行了全面的蛋白质组学研究,鉴定了100多个S-亚硝基化蛋白,其中包括甲硫氨酸腺苷转移酶(MAT)。Lindermayr等[18]根据上述结果进行了相关分子机制的研究,发现在拟南芥主导S-腺苷甲硫氨酸(SAM)生物合成的三种MAT亚型(MAT1-MAT3)中,只有在Cys-114位的MAT1蛋白质巯基亚S-硝基化修饰才会引起SAMS活性的抑制。NO可以通过降低乙烯合成两个关键的限速酶——ACC合成酶(ACS)和ACC氧化酶(ACO)活性来抑制乙烯的生物合成,进而调控成熟与衰老进程[5]。如利用15 μL/L的NO熏蒸‘Dahong’桃果实20 min,可通过降低ACS和ACO的活性来抑制乙烯的生物合成,保持果实品质[20]。有关NO抑制乙烯合成的机制也有不同的解释。10 μL/L的NO熏蒸‘霞晖5号’桃果实3 h并置于室温下贮藏,该处理使SAMS活性上调并促进SAM和1-氨基环丙烷-1-羧酸(ACC)的积累,导致ACC-ACO-NO三元复合体的形成,最终抑制乙烯的生物合成[21]。Lv等[22]利用拟南芥探究了NO和乙烯在其叶片衰老中的相互作用关系,结果表明NO的积累阻止了ACS1诱导的叶片衰老发生。
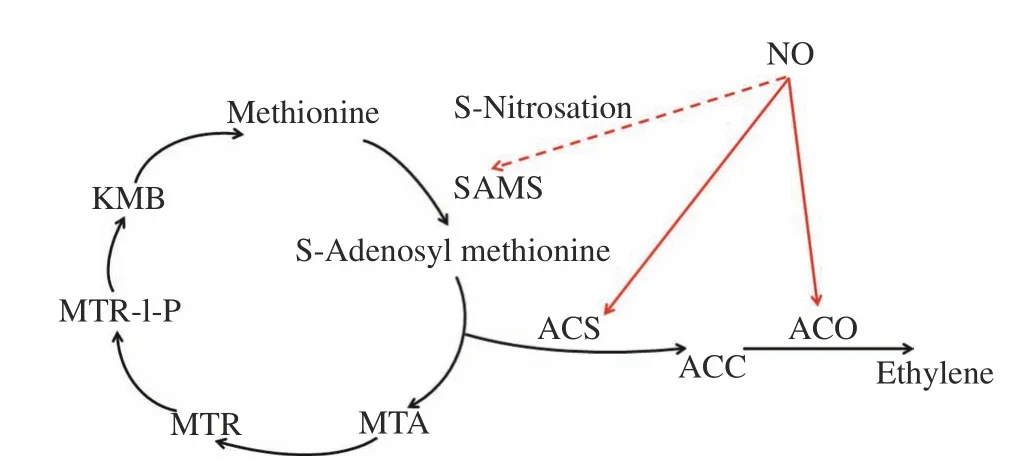
图1 植物乙烯合成途径与甲硫氨酸循环Fig.1 Ethylene biosynthesis pathway and methionine recycling in plants
近期许多研究表明,果实成熟期间H2S和褪黑素也可以参与到NO和乙烯的相互作用之中。根据外源施用量的不同,NO和H2S之间既能产生协同作用也能发生拮抗作用,但NO-H2S在抑制乙烯诱导的果实成熟方面主要表现出协同作用[5]。Zhu等[20]比较了NO(15 μL/L、20 min)和H2S(20 μL/L、20 min)复合处理‘Dahong’桃果实与NO/H2S单独处理延缓果实成熟的效果,复合处理较单独处理显著降低了ACC含量、ACS和ACO活性,抑制水溶性和环己二胺四乙酸(EDTA)溶性细胞壁组分的增加,延缓Na2CO3溶性组分的下降,降低果实软化相关酶的活性,二者之间存在协同作用,通过抑制乙烯生物合成和细胞壁降解维持果品品质。类似的协同效应在草莓中也有发现,H2S(0.8 mmol/L NaHS溶液)和NO(5 μmol/L SNP 溶液)复合处理显著抑制了草莓的呼吸速率和腐烂,增加了几丁质酶和β-1,3-葡聚糖酶的活性,使草莓保持了较高的硬度及抗病性[23]。有关褪黑素与NO在果蔬成熟期间的相互作用在梨中有报道。Liu等[24]研究了外源施用褪黑素和NO对三种不同品种欧洲梨成熟和软化的影响,将不同品种的梨分别浸泡在SNP溶液(100 μmol/L)、褪黑素溶液(100 μmol/L)、L-NAME溶液(200 μmol/L)及褪黑素(100 μmol/L)+ L-NAME溶液(200 μmol/L)中各12 h,结果表明,褪黑素和SNP处理均降低了果实纤维素酶基因(PcCel)和多聚半乳糖醛酸酶基因(PcPG)的表达,抑制了乙烯合成相关基因(PcACS和PcACO)的表达,并降低了呼吸和乙烯的产生速率,但其他两种处理无显著效果。通过比较上述四种处理结果发现,褪黑素可通过上调NO合酶基因(PcNOS)的表达提高NOS的活性,增加NO含量;但当NO合成受到抑制时,褪黑素对果实成熟衰老的延缓作用几乎被消除。
综上,NO处理与延缓果蔬成熟存在着一定的剂量关系。NO可通过抑制SAMS、ACS以及ACO的活性来抑制乙烯的生物合成。其他因子如H2S和褪黑素也参与了NO与乙烯的互作并发挥了一定作用。
2 NO对果蔬冷害的影响
2.1 增强果蔬耐冷性
低温贮藏是果蔬采后常用的一种保鲜方法,可用于保持果蔬采后品质并延缓其衰老,延长货架期。然而,对低温敏感的果蔬,冷藏期间往往伴随冷害现象的发生,微观结构上会使细胞中的线粒体和叶绿体产生功能紊乱和肿胀,叶绿体内脂滴积累以及染色质聚集,细胞膜渗透性增加;宏观上则会令果蔬表皮呈现凹陷和水渍状、发生褐变,降低果蔬品质[25]。与冷害相关的症状,可施用外源NO缓解。有报道称,50 μmol/L的SNP溶液喷淋‘G.H. Hill’桃果实,可减轻4 ℃贮藏条件下桃的冷害,该处理主要通过减少贮藏期间活性氧的积累,增强抗氧化活性来减轻果实的氧化损伤,并抑制了乙烯产生、保持硬度及VC含量[26]。研究发现,采用0.5 mmol/L的SNP浸泡脐橙5 min并置于3 ℃贮藏,能够提高果实SOD、POD、CAT等抗氧化酶的活性,降低果皮中脂质过氧化程度和过氧化氢(H2O2)含量,维持细胞膜的完整性以提高果实的耐冷性[27]。以0.07 mmol/L的SNP中浸泡竹笋30 min并在1 ℃贮藏56 d,竹笋的丙二醛(MDA)含量和冷害发生率分别比对照降低了8.8%和37.9%,冷害程度明显减轻[28]。
低温贮藏可能还会造成果蔬成熟受阻以及风味丧失等问题。Cai等[29]研究了10 μL/L的NO熏蒸‘霞晖6号’桃果实3 h,对桃低温(4 ℃)和常温货架期(20 ℃)贮藏过程中果实品质和香气物质的影响,结果表明,NO处理增加了冷藏后果实主要香气物质(C6醛、C6醇、直链酯和内酯)的排放,减轻了处理组果实冷害的发生(比对照组平均低20%),并促进了处理组果实在常温货架期呼吸速率和乙烯生成量的恢复。
国内外有关施用外源NO减轻果蔬冷害的研究较多,表1总结了外源NO处理对不同类型果蔬冷藏期间生理特性、抗氧化系统和ROS代谢的影响,两种代谢主要涉及到等活性氧和VC、GR、酚类等抗氧化物质,以及SOD、CAT、APX等酶。
2.2 NO抑制采后冷害的机理
关于NO抑制果蔬采后冷害,国内外的学者从分子生物学的角度出发、应用基因组、转录组、蛋白组、代谢组学等技术开展了大量的研究,初步揭示了NO增强果蔬抗冷性的机制。
2.2.1 激活抗氧化体系 活性氧自由基的积累和爆发是引起果蔬采后发生冷害的主要原因,果蔬在遭受低温胁迫后会发生过氧化反应,最终干扰生物膜的结构与功能诱发冷害产生[25]。能够引起果蔬冷害发生的主要自由基包括及·OH等[26]。果蔬中存在着酶和非酶的自由基清除系统,活体果蔬组织中最重要的ROS清除酶系统成员包括SOD、APX、CAT、POD和GR等酶类[6]。表1可见,通过适宜浓度的NO或SNP处理,可显著提高抗氧化酶及抗氧化物质的活性,从而增强果蔬组织的氧化应激能力并减轻冷害。Zhang等[31]利用60 μL/L的NO熏蒸哈密瓜3 h,探究了在低温(1±0.5)℃贮藏下NO提高果实抗冷性的机理,发现NO大大提高了处理果实抗氧化系统酶(SOD、CAT、APX和POD)的活性,贮藏结束时处理果实的SOD活性比对照高53.42%,相应的含量也显著降低。NO增强抗氧化酶活性的作用可能是通过S-亚硝基化产生的,研究表明,NO可使APX1的第32位半胱氨酸发生S-亚硝基化从而增强该酶的活性,以提高植物将H2O2还原成H2O的速度[33]。除上述直接的酶促抗氧化系统外,植物体内还存在着间接的抗氧化系统,如抗坏血酸-谷胱甘肽(ASA-GSH)循环。10 μL/L NO熏蒸桃果实3 h,显著提高了果实低温贮藏期间AsA/DHA比值(贮藏第3周为对照的3.3倍),同时在贮藏2周后,处理果实的总谷胱甘肽和还原型谷胱甘肽显著增加,GR活性显著增强,NO处理促进冷藏期间桃果实ASA-GSH循环的再生机制,减轻桃果实的冷害与衰老[7]。

表1 NO处理对呼吸跃变型和非呼吸跃变型果蔬生理特性及氧化代谢的影响Table 1 Effects of NO treatment on physiological traits and oxidative metabolism in some climacteric and non-climacteric fruit and vegetables
2.2.2 维持能量水平 低温胁迫条件下,果蔬组织的ATP合成受阻、能量下降,令细胞结构遭到破坏、生物膜功能损伤,同时也影响果蔬自身的活性氧清除功能[25]。植物体的耐冷性与其能量高低有关,维持较高的能量水平有利于降低冷藏的危害[34]。Wang等[35]研究了不同成熟阶段的‘红阳’猕猴桃在0 ℃冷藏下的冷害情况,结果表明,高成熟度果实有着更高的抗氧化能力以及能量水平,且H+-ATP酶、Ca2+-ATP酶、琥珀酸脱氢酶(SDH)和细胞色素C氧化酶(CCO)等与能量代谢有关的酶活力显著增强,减轻了冷害的发生。有文献报道,用0.05 mmol/L的SNP处理香蕉并在7 ℃下贮藏20 d,处理香蕉的ATP含量和能荷显著高于对照,且与能量代谢有关的H+-ATP酶、Ca2+-ATP酶、SDH和CCO活性较对照显著增强,果糖激酶、葡萄糖激酶、葡萄糖-6-磷酸脱氢酶和6-磷酸葡萄糖酸脱氢酶的活性也显著提高,说明NO可通过维持冷藏期间果实内较高的能量状态和提高能量代谢相关酶的活性来提高果实的耐冷性[36]。另有报道称,将‘肥城’桃果实置于15 mmol/L的NO溶液中浸泡10 min后,可显著抑制桃果实0 ℃冷藏期间ATP、ADP、能荷含量及能量代谢酶活性的降低,延缓膜脂过氧化过程,提高果实的抗冷性[37]。
2.2.3 保护细胞膜 细胞膜结构的改变是植物发生低温冷害时最初的反应。受到低温胁迫后,细胞膜会发生由液晶态向凝胶态的膜相变,膜脂的不饱和脂肪酸含量下降,随后膜的通透性增加,与细胞膜稳定性相关的酶活性发生改变,导致细胞结构和功能的紊乱,如细胞膨压丧失,细胞液化,胞质流动性减少,最终造成冷害[34]。提高膜脂不饱和脂肪酸的含量可增加细胞膜的流动性,从而提高果蔬的耐冷性。关于耐冷性与不饱和脂肪酸含量的关系在多种果蔬中均有报道。以10 μL/L的NO处理肥城桃,可通过增加线粒体膜及细胞膜不饱和脂肪酸(如亚麻酸、亚油酸)含量,来维持膜组织较低的相变温度以减少膜组织损伤,维持细胞膜的流动性及果实耐冷性[38]。Li等[39]用0.1 mmol/L的SNP处理生姜幼苗,处理幼苗的保持了较高的不饱和脂肪酸含量,特别是C16:1、C18:2和C18:3的含量显著增高,提高了植株的耐冷性。MDA是脂膜过氧化的最终产物,它会损伤生物膜结构,改变膜的通透性,进而损伤细胞。Wu等[30]利用60 μL/L的NO熏蒸香蕉3 h,该处理提显著降低了香蕉在低温冷藏期间MDA的含量,并减少了组织的电解质渗漏率,使香蕉保持了更好的果品品质。其他相似的结果在桃[7]、冬枣[12]和黄瓜[32]中也有所发现。
2.2.4 CBF抗冷途径 冷害诱导的相关抗冷基因表达研究中,CBF(C-repeat binding transcription)抗冷途径被认为是最关键的一条低温响应调控途径。CBF调控着下游抗冷基因的表达:植物细胞膜上的受体感受到环境的低温信号并将其传送至细胞核,Ca2+和MAPKs等感知和传导该信号,激活相关酶类并诱导CBF转录因子表达,从而启动冷诱导功能基因(COR)的表达,触发冷响应答[37]。Costa-Broseta等[40]通过野生型拟南芥与三倍突变体nia1nia2noa1-2拟南芥在4 ℃时CBF基因相对表达量的对比得出,NO的积累能显著提高低温条件下拟南芥CBF基因的表达量。利用60 μL/L的NO处理哈密瓜,在冷藏期间与对照组相比,哈密瓜的CmCBF1和CmCBF3表达量显著提高,减轻哈密瓜的冷害[31]。Jiao等[41]用15 mmol/L的SNP浸泡处理‘金秋红蜜’桃果实10 min,并研究了CBF基因在其4 ℃贮藏期间的表达情况,结果表明,处理果实的CBF的相对表达量(5.9)在冷藏第21 d达到最大值,是对照的2.9倍,该处理显著降低了果实的冷害指数。以15 mmol/L的NO溶液中浸泡10 min的‘肥城’桃置于0 ℃冷藏,果实CBF家族基因的荧光定量分析发现,冷藏期间处理桃果实CBF1/5/6基因表达量较对照升高迅速,且均维持在较高的水平,说明NO能通过上调CBF转录因子的表达量来提高植物抗冷能力[37]。
以上研究结果提示,NO主要通过激活果蔬组织抗氧化系统来减轻氧化应激的伤害、维持较高能量水平及降低脂膜的过氧化程度,从而保持细胞的完整性和诱导CBF抗冷基因表达,激活果蔬组织对低温的响应,减轻冷害症状,并保持良好的品质性状。
3 NO对果蔬抗病性的影响
3.1 提高果蔬抗病性
采后果蔬贮藏期间易受到病原菌(主要是真菌)的侵染而造成腐烂变质,这是导致果蔬采后大量损耗的重要因素之一。大量的研究结果表明,NO在抑制果蔬侵染性病害方面有着积极的作用,表2总结了NO处理对不同类型果蔬抗病性的影响。

表2 NO处理对呼吸跃变型和非呼吸跃变型果蔬抗病性的影响Table 2 Interactions between NO and the defense responses of some climacteric and non-climacteric fruit and vegetables
Yan等[44]研究了60 μL/L NO熏蒸甜瓜对采后黑斑病的防治效果,NO处理明显降低了接种链格孢菌(Alternaria alternata)甜瓜果实的病斑直径(减小了23.25%)和病斑深度(减小了9.67%),网纹组织中菌丝的数量也明显减少,提高了果实的抗病性。研究表明,利用100 μL/L NO熏蒸接种了粉红单端孢(Trichotheciu roseum)的哈密瓜2 h,可降低贮藏21 d中处理果实的发病率,且NO能够抑制病斑直径的扩大,降低细胞薄膜渗透率,使处理果实保持较高的硬度[48]。炭疽病是柑橘果实贮藏中常见的病害之一,Zhou等[46]利用50 μmol/L的SNP溶液浸泡甜橙10 min后对其进行病原菌接种,结果表明,外源NO处理显著降低了由C. gloeosporioides引起的炭疽病发生,且20 ℃贮藏28 d后处理果实的病斑直径减小了(仅为对照的)40.58%。将NO应用在猕猴桃中也能抑制猕猴桃灰霉病和软腐病的发生[45]。
3.2 提高抗病性的机理
NO作为一种化学激发因子能够通过多种途径诱导果蔬的抗病性,现有文献的研究表明其作用机理包括以下几方面。
3.2.1 杀伤病原菌 新鲜果蔬正常细胞中的活性氧会处于一个相对平衡的状态,但其在受到病原菌侵染后活性氧便会大量积累,NO则会和活性氧中的反应生成过氧亚硝酸阴离子(ONOO-)。ONOO-是一种细胞毒性物质,可使核酸亚硝酰化并令DNA断裂,也可与酶的Fe-S中心结合抑制酶活性,对蛋白质、脂类都有很强的破坏作用[49]。因此,果蔬遭受病原菌侵染后,生成的ONOO-可直接杀死病原菌,从而提高自身的抗病性。Gaupels等[50]用携带AvrB无毒基因的病原体感染拟南芥,发现与对照相比,被感染的拟南芥产生了大量的ONOO-以提高机体的抗病性。
NO还具有提高ROS清除系统酶活性的作用,可避免ROS过量积累对膜脂产生过氧化作用。利用60 μL/L的NO熏蒸香蕉3 h可提高香蕉中各类抗氧化酶(SOD、CAT、APX和POD)的活性,处理果实中的显著降低,且保持了更低的MDA含量和电解质渗漏率[30]。Abramowski等[51]利用致病疫霉(Phytophthora infestans)无毒小种(avr)和致病小种(vr)分别感染马铃薯叶片,结果显示,非亲和互作中叶片早期产生的和NO会反应生成大量ONOO-,同时SOD活性也显著提高,增强叶片对病原菌的防御。
3.2.2 苯丙烷代谢 苯丙烷代谢是果蔬采后抗病的重要途径之一,该代谢过程可产生重要的抗菌物质木质素,木质素可以保护细胞壁不受病原菌分解并阻碍病原菌扩散,能够抑制真菌生长[52]。合成木质素的各前体物质(如阿魏酸、松柏醇、咖啡酸等)也有抑菌效果。丙氨酸解氨酶(PAL)、肉桂酸-4-羟基化酶(C4H)、4-香豆酸-CoA-连接酶(4CL)和查尔酮异构酶(CHI)等为苯丙烷代谢过程的关键酶。其中PAL与类黄酮和木质素的积累有关,C4H与咖啡酸、阿魏酸等前体物质的合成相关,4CL能够催化各种CoA酯合成;CHI是异黄酮合成过程中的关键酶。因此,苯丙烷代谢过程中关键酶的活性可以作为果蔬抗病性强弱的指标之一[44]。Li等[43]研究了NO诱导桃果实抗病性与苯丙烷途径的关系,15 μmol/L的NO溶液浸泡处理果实后,PAL、C4H、4CL和CHI的活性及基因表达均显著提高,苯丙烷代谢产物木质素、总酚和类黄酮的含量也显著增加。另外,NO处理对接种炭疽病菌(Colletotrichum gloeosporioides)的芒果[42]和火龙果[47]也可增强苯丙烷代谢途径中关键酶活性,并增加木质素等物质的积累,抑制果实上病原菌的生长,增强其抗病性。
3.2.3 病程相关蛋白和抗病基因的表达 病程相关蛋白(PRs)受病原菌或其他外界因子的胁迫而诱导表达,是植物在病理或病理相关的环境下产生的一类可以参与植物防御的蛋白,根据血清关系和生物学活性可将其分为17个家族(PR1-PR17)[53]。一些具有酸性特征的PR位于胞间,在组织渗透之前作用于入侵的病原菌;另一些碱性蛋白则是位于液泡之中,可以在组织损伤后发挥作用[53]。目前研究比较透彻的PRP主要包括几丁质酶(CHT)和β-1,3-葡聚糖酶(GLU)等。CHT和GLU能够降解病原菌细胞的细胞壁,抑制真菌的生长,两种酶存在协同作用。Hu等[42]研究了外源施用SNP对‘贵妃’芒炭疽病的抑制效果,0.1 mmol/L SNP浸泡‘贵妃’芒果实5 min后能显著提高期CHT、GLU以及苯丙烷代谢途径相关酶的活性,降低了果实发病率和病斑直径。其它有关NO处理提高CHT和GLU活性的研究详见表2。Gu等[54]研究了NO溶液对桃果实褐腐病的防治效果,15 μmol/L的NO溶液处理显著减小了果实的发病率和病斑面积,实时荧光定量PCR(RT-PCR)分析显示,PR-1和PR-10两个基因在NO处理组均表达上调。近年来,学者们对植物抗病相关的酶基因的研究越来越多,通常采后果蔬抗病性的强弱与这些基因的表达量呈正相关。利用NO对猕猴桃果实处理的研究中,有关抗病酶的基因AdPAL、AdPOD和AdCHT的表达均显著提高,猕猴桃的抗病性在室温贮藏条件下增强[45]。
因此,NO诱导采后果蔬抗病性主要通过与O2-反应生成的ONOO-来杀伤病原菌、激活苯丙烷代谢相关酶类的活性以及诱导病程相关蛋白和抗病基因的表达来提高果蔬组织的抗病性。
4 展望
关于NO对果蔬生理和品质方面的影响,国内外的学者已经做了大量的研究,取得了较为显著的成果,但对NO延缓果蔬成熟衰老、提高抗性作用的相关机制研究还不全面和深入,仅局限于果蔬的生理和新陈代谢等方面,分子层面的机理了解不多。今后的研究可利用转录组学、蛋白质组学和代谢组学等方法进行研究,这将有助于、充分理解NO在果蔬体内的作用机理。另外,关于NO在果蔬体内的相关作用位点尚不清楚,可借助基因编辑的方法(如CRISPR/Cas9)来找到相关作用的靶点,并应用到未来的优良品种的育种工作中。虽然利用NO处理果蔬在实验室中的技术比较成熟,但商业实践中利用NO气体处理大规模的果蔬产品还存在许多问题(比如NO易被氧化成NO2、价格昂贵等),阻碍其NO的商业推广。因此,需要找寻稳定的NO释放剂或其替代品,比如经济且易于处理的天然来源的NO诱导剂。
