Mg(BH4)2储氢材料及性能研究进展
2021-11-13王玉放庞越鹏郑时有
王玉放, 庞越鹏, 郑时有
(上海理工大学 材料科学与工程学院,上海 200093)
随着能源问题的不断升级和石油资源的不断减少,同时人类的发展需要的是对环境没有影响或者影响比较小的能源,各国专家都在迫切的寻找新能源以解决当前危机,因此新型储能技术的发展就显得尤为重要[1]。氢能因温室气体和污染物零排放被认为是最有潜力的能源。而氢的有效储存是氢能应用的关键,氢能的存储也是目前氢能应用的主要瓶颈[2-4]。对于高压气态储氢存在泄露、爆炸等隐患和液化储氢中低温液化过程中的大量损耗,氢与材料间的相互作用形成固溶体、配位氢化物和材料物理吸附的固态储氢技术因储氢容量高且安全性好,被认为是最有发展前景的储存方式。碱金属硼氢化物具有高的质量和体积氢密度而被得到广泛的关注[5]。其中Mg(BH4)2的质量储氢密度为14.8%(wt),体积储氢密度为112 g/L,热解温度低于LiBH4的热解温度而被大量的研究。尽管如此,由于Mg(BH4)2在热分解过程中产生稳定的MgB12H12,使得Mg(BH4)2有高的热力学稳定性和动力学势垒,同时,Mg(BH4)2的可逆性只能在非常苛刻的条件下才能实现(95 MPa,400℃)才能实现,无法满足美国能源部为车载汽车应用设定的目标[6-7]。为了实现储氢性能匹配燃料电池的使用条件,研究改善Mg(BH4)2储氢性能的方法成为了研究的重点。
目前陈等[8]对Mg(BH4)2单体合成、晶体结构的解析进行了重点综述,为合成方法存在的诸多问题提出了指导意见。Zavorotynska等[9]重点介绍了Mg(BH4)2单体的晶型结构与分解途径,Mg(BH4)2单体具有较多的晶体结构和复杂繁多的分解途径,通过对分解途径的综述可以为后续Mg(BH4)2的性能改进提供基础理论支撑。近十年,已有大量的Mg(BH4)2的储氢性能改性的研究,本文着重对这些改性研究的成果、主要方法和机理进行综述,并为Mg(BH4)2实现商用化进行合理的展望。
1 添加过渡金属及其化合物添加剂
过渡金属及其化合物添加剂在储氢材料改性中有着重要的作用,这类添加剂可以显著改善MgH2的放氢和再吸氢动力学[10-11]。同时这类添加剂也是各种铝氢化物改性的重要方法[12-13]。而添加过渡金属化合物同样是改善金属硼氢化物的储氢性能的有效手段之一[14-15]。过渡金属化合物可以通过形成异相成核位点来促进硼氢化物的可逆再生,例如在Ca(BH4)2热分解过程中形成的CaB6在Ca(BH4)2再吸氢过程中起到重要的作用[16]。多项研究发现,Mg(BH4)2和过渡金属化合物形成的复合材料的初始放氢温度均有一定的下降。
Ti基化合物是最常用的添加剂之一。Bardaji等[17]研究加入TiCl3的复合材料起始温度降低100℃以上,而同时掺杂NbCl5和TiCl3的复合材料放氢温度降低125℃以上且300℃以下就可以放出5%(wt),对分解产物在氢压下尝试氢化,并没有观察到可逆性。Li H-W等[18]研究TiCl3与Mg(BH4)2反分解产物发现生成了MgTix(BH4)(2+nx)或者TiB2。D. Matsumura等[19]同样认为TiCl3与Mg(BH4)2在球磨后就生成TixMg1-3x/2(BH4)2,且能在较低放氢的原因是该物质首先分解生成TiB2。部分Nb基、Ti基添加剂可以改变分解过程中间体的成分从而有效提升动力学。例如向Mg(BH4)2中加入5 mol% TiF3后[20],在300℃时更早的产生了不同于MgB12H12的非晶Mg(BxHy)n中间体,该中间体热力学相对不稳定使系统动力学显著提高,氢气解吸率达到95%,分解速率是未掺杂的5倍。同时发现TiF3参与了反应生成MgF2。I. Saldan等[21]发现MoO3和TiO2掺杂γ-Mg(BH4)2后的复合材料二次吸氢过程具有一定可逆容量,这也是与形成Mg(B3H8)2中间体有关。因此Ti化合物参与Mg(BH4)2分解反应,已生成对分解和二次吸氢都有利的不稳定中间体。
I. Saldan等[22]研究镍基添加剂对Mg(BH4)2可逆加氢时的结构变化,通过研究发现添加NiCl2、NiF2后的Mg(BH4)2在220~264℃下的分解产物中出现非晶态Ni3B,并且在再吸氢过程Ni3B没有发生反应。同时添加Ni3B也可以有效提高Mg(BH4)2的放氢动力学。这些原位形成的化合物被认为是改善氢动力学的主要原因。NbF5是改善Mg(BH4)2储氢性能的一种优异的添加剂,添加15%(wt)NbF5的复合材料可以在<300℃就可以放出10.0%(wt)的氢气[23]。向采用球磨LiBH4和MgCl2原位合成无溶剂非晶Mg(BH4)2复合材料中加入NbF5[24]。复合材料在接近120℃时开始释放氢,总容量为10.04%(wt),反应产物中存在Ni3B,复合材料的可逆性也得到了改善。该复合材料在第二圈的容量为5.5%(wt)。在第三个和第四个圈中,仍具有4%(wt)H2的容量。而中间产物MgB12H12的产生是导致循环容量下降的主要原因[24]。Ni基与Nb基添加剂在改变Mg(BH4)2反应途径的同时易反应生成金属硼化物,为循环吸氢提供成核位点,改善循环稳定性。
Zhang等[25]在添加ZnF2的Mg(BH4)2复合材料中发现有原位生成的Zn,因此ZnF2通过与Mg(BH4)2反应从而降低初始放氢温度。MoCl2掺杂后的复合材料放氢产物中出现金属Mo单质,这些物质为分解和再吸氢过程提供成核位点,有效改善动力学[17]。为了更加直观的对比过渡金属化合物对Mg(BH4)2性能的影响,过渡金属化合物与Mg(BH4)2复合体系储氢性能对比表如表1所示。

表1 过渡金属化合物与Mg(BH4)2复合体系储氢性能对比
理论计算在Mg(BH4)2储氢性能研究中有着重要的作用。通过计算可以有效预测添加剂的催化效果,为实验方案和参数的选择提供理论支撑。Paduani C等[26]通过密度泛函模型进行计算Ti、TiCl3和TiF3对Mg(BH4)2放氢反应的作用,Ti元素为最佳催化剂金属易与Mg(BH4)2的B和Mg部分结合,减少了Mg原子上的正电荷,从而使得B-H趋向不稳定。同时预计TiF3和TiCl3中的F和Cl可能在催化过程中起间接作用,在球磨过程中生成MgF2和MgCl2,[BH4]2-中部分B-H键会被破坏,从而更容易放氢。这与以上的实验结果是相符合的。而在第一性原理计算Ti、Al掺杂对Mg(BH4)2电子结构机制的影响[27],Ti倾向于占据Mg的位置,Ti-B化学键的强度弱于Mg-B化学键,但此时该位置的Ti对氢气放出影响较小;当Ti替代了B的位置,易形成TiH2,另外两个H原子由弱键连接更加容易断裂放氢。Al原子代替B原子形成AlH4,其中一个Al-H化学键弱易断裂;经计算Al在间隙位置时,材料解离能最低。
以上研究发现,添加过渡金属及其化合物在硼氢化镁中的作用:1)通过两者之间发生化学反应,使得B-H键变弱,改善了硼氢化镁热力学性质。2)机械球磨工艺使得硼氢化镁尺寸明显减小和缺陷更多。3)原位生成的活性材料作为异相成核位点促进Mg(BH4)2放氢和吸氢,有效改善动力学性质,但热力学性质的改善并不明显。这是过渡金属添加剂对提高硼氢化镁放氢性能的普遍机理。虽然过渡金属添加剂的使用对Mg(BH4)2的储氢性能有着积极的作用,但离商业还有很大的距离,通过结合理论计算合理选择添加剂并研究添加剂在Mg(BH4)2循环过程中的作用是未来添加剂的研究重点。
2 纳米工程制备Mg(BH4)2纳米颗粒
一般来说,储氢纳米材料由于大的表面积、扩散距离缩短、晶界原子数增加等众多因素的影响。使得其性能与大的块状材料相比有显著优势,因此设计纳米结构是改善性能的有效方法,但寻找合适的设计方案仍然是一个巨大的挑战[28-30]。高能球磨法可有效减小粒径,但在材料吸放氢循环中颗粒容易发生团聚,性能急剧下降,而通过纳米限域的方法可以阻碍颗粒团聚实现各物质之间相分离。多孔材料、石墨烯等因具有的高的比表面积或较大的孔径比,目前已被尝试用来负载纳米氢硼化镁,通过这些材料面效应使得氢硼化镁在热力学和动力学上有极大改善,同时使得分解产物仍然均匀分散在基底材料中,为一般实验条件实现可逆循环提供可行的方案。因此着重关注通过纳米限域实现硼氢化镁纳米化的方法。
2.1 石墨烯为载体的Mg(BH4)2纳米颗粒
Zhang等[30]设计加氢自组装合成以石墨烯为载体的MgH2纳米颗粒与原位形成的B2H6发生固气反应合成以石墨烯为载体的Mg(BH4)2纳米颗粒,合成方法如图1所示。

图1 Mg(BH4)2-Gr (石墨烯)的合成方法[30]
该方法可以合成大量10 nm的Mg(BH4)2均匀负载在石墨烯表明,石墨烯的存在可以削弱MgH2的Mg-H键和B2H6的B-B键,从而在热力学和动力学上促进化学合成高纯度的Mg(BH4)2。纳米效应和石墨烯的催化效果使复合材料在154℃开始放氢,在225℃可以实现完全的放氢。更值得关注的是,纳米限域作用缓解了Mg(BH4)2纳米颗粒的团聚,第2、6个吸放循环中,该复合材料可以分别达到4.13%(wt)和3.24%(wt)的可逆氢容量。这中特殊的合成方案调整材料的热力学和动力学,为固态储氢纳米复合材料的合成方法提供了一个新的方法。
2.2 Mg(BH4)2-CNTs(碳纳米管)复合材料
通过简单的一步乙醚溶剂浸润法制备了Mg(BH4)2-CNTs(碳纳米管)复合材料(图2),获得了较好的脱氢/吸氢性能[31]。50%(wt)Mg(BH4)2-CNTs在CNTs表面形成厚度为2-6 nm的Mg(BH4)2纳米涂层,复合材料在76℃即可放氢。此外,在10 MPa H2、350℃条件下,Mg(BH4)2-CNTs也可以实现部分可逆。纳米Mg(BH4)2的高化学活性和CNTs的催化作用协同促进了可逆储氢。Yan等[32]通过熔融浸渍法合成以碳气凝胶为载体的MgH2复合材料,在B2H6/H2气氛下长时间球磨复合材料得到Mg(BH4)2/碳纳米复合材料,同样具有良好的放氢性能,160℃即可放氢,同时较温和的条件下(200℃和80~150 bar H2)可以重新合成出Mg(BH4)2,但性能发生恶化,这可能是由于纳米颗粒发生团聚所致。Jiang等[33]认为Mg(BH4)2与碳纳米管球磨后性能提升的原因是非晶纳米Mg(BH4)2氢扩散距离缩短,碳纳米管也改变了放氢途径。将Mg(BH4)2纳米限域在Cu2S空心球中,通过纳米限域和改变反应途径同样导致热力学失稳,实现部分可逆吸氢[34]。

图2 Mg(BH4)2-CNTs合成方法[31]
2.3 MC-Niinsut Mg(BH4)2
为了进一步提高硼氢化镁性能,在纳米限域方法的基础上,寻求一定催化作用的方法被大量研究。作为高效活性添加剂的Ni基在储氢材料中有大量的应用[35-37],Ni同样在Mg(BH4)2储氢性能优化中也起到重要作用。在介孔碳上原位合成Ni纳米颗粒,再用浸渍法将Mg(BH4)2加载到MC-Niinsut复合材料中,合成方法如图3所示[38]。

图3 MC-Niinsut Mg(BH4)2合成方法[38]
介孔碳的表面效应与原位合成出的高分散性Ni的催化作用且MC中的Ni和Mg(BH4)2均呈现非晶态。这使得复合材料的初始放氢低至44℃。同样Clémençon等[39]通过浸渍法将30%(wt)Mg(BH4)2加载到含有5%的纳米级Ni-Pt核壳纳米颗粒的孔隙大小为8 nm的介孔碳中,从通过质谱分析放氢过程只要一个放氢峰,在350℃下2小时内将所有的氢气完全释放出,同时产生具有催化作用的Ni-B化合物和Pt。
Wahab等[40]将硼氢化镁渗透到含有分散镍纳米粒子(Ni NPs)的高有序介孔碳(CMK3)中,研究Ni NPs对纳米约束和催化的协同效应。在只有75℃的温度下氢开始释放,在155℃,比纯Mg(BH4)2放氢动力学快10倍以上。此外,在10 MPa H2、350℃条件下可实现部分可逆性。这是Mg(BH4)2第一次在低于100℃的温度下分解,这对于质子交换膜燃料电池实际储氢具有重要意义。
2.4 Mg(BH4)2-Ti3C2复合物
MXene材料是一类具有二维层状结构的金属碳化物和金属氮化物材料,基于MXene的显著纳米限域作用和催化作用,可以作为Mg(BH4)2储氢材料的优良催化剂。Zheng等[41]采用球磨法向2D MXene Ti3C2引入Mg(BH4)2,结构示意图如图4a所示。Mg(BH4)2纳米颗粒可均匀分散在Ti3C2层状结构上Mg(BH4)2,复合材料初始脱氢温度下降到124.6℃,此外,可以在330℃下15分钟内从Mg(BH4)2-40Ti3C2复合物中释放超过10.8%(wt)H2。此外,在随后的第二和第三个循环中,仍然具有较好的放氢反应动力学。Ti3C2阻止了Mg(BH4)2粒子的聚集,同时提供了活跃的金属Ti位点催化Mg(BH4)2的分解。而在最新的研究将该复合材料的初始脱氢温度降低到82℃,如图4b所示[42]。对分解产物研究发现Ti3C2表面的氟参与脱氢反应,生成MgF2,有利于氢气的生成。特殊的结构同时可以提供更多的氢扩散通道,球磨处理也降低硼氢化镁的晶粒尺寸,产生更多的缺陷,从而提高放氢动力学。各性能对比如表2所示。

表2 纳米工程后的Mg(BH4)2复合体系储氢性能对比

图4 (a) Mg(BH4)2-2D MXene Ti3C2结构示意图[41]
2.5 纳米工程后的Mg(BH4)2复合体系储氢性能对比
通过设计纳米结构对于Mg(BH4)2在较温和条件下吸放氢具有重要意义。主要有以下优点:1)通过多孔材料和大比表面积材料实现纳米限域,有效缓解纳米Mg(BH4)2在循环过程中的团聚。2)纳米结构使得氢的扩散距离缩短,热力学稳定性降低,实现较好储氢性能。3)大比表面积材料中原位生成的纳米催化剂作为活性位点,在Mg(BH4)2循环中参与成核和生长,提高循环容量。多孔MOFs材料被认为是提高金属纳米颗粒催化性能的有效载体,同时它的空间结构可以控制颗粒成核和生长,有效防止颗粒聚集。关于硼氢化镁与MOFs材料进行复合的研究较少,但已有研究将储氢材料限制在MOFs内,用于可逆储氢,实现了很好的储氢性能。因此将MOFs材料与Mg(BH4)2相结合具有很好的前景,后续可以对此进行更加深入的研究,由于目前纳米材料合成方法复杂,不利于大规模合成,因此要注重开发新的材料纳米化方法,为大规模生成而准备。
3 制备氢化反应复合材料及其改性
在硼氢化镁改性方法中有一类是通过加入金属氢化物形成反应氢化物复合材料,这种方法会改变硼氢化镁热分解途径,从而改善吸放氢热力学和动力学。同时根据金属的电负性不同,将不同阳离子Mn+和Mm+适当地结合,这是改善金属硼化物热力学性质的有效方法。目前,在金属氢化物、含氮氢化物、金属硼氢化物等含氢金属化合物与硼氢化镁复合的基础上,又通过不同方法引入催化剂、多孔材料等进一步提升复合系统储氢性能。
3.1 Mg(BH4)2-MBH4系统
Bardají等[43]将1∶1 LiBH4/Mg(BH4)2混合物通过机械研磨和后续加热,原位形成了双阳离子(Li, Mg)硼氢化物。与组成相相比,双阳离子硼氢化物的脱氢起始温度更低。通过调整LiBH4和Mg(BH4)2的摩尔比发现少量LiBH4的存在影响了Mg(BH4)2的多晶转变动力学,可以使有少量的Mg(BH4)2从低温相α向高温相β不可逆的转变,高温相β的存在降低了热力学势垒。且在0.50<x<0.60时球磨后的复合材料中出现共晶成分,且在180℃时发生共晶熔化。通过研究得到的数据建立了相图(图5)。

图5 xLiBH4-(1-x)Mg(BH4)2的相图[43]
此外,材料在融化后立即开始分解;因此,复合材料的分解温度远低于纯硼氢化物的分解温度。270℃时,x=0.50复合材料释放出约7.0%(wt)的氢。x=0.6的二元系统[44],系统放氢过程发生明显变化,分为四个步骤如表2所示,总放氢量可达12 %(wt),但仍然需要高的温度(>350℃)。
采用熔融法将双阳离子共晶材料Li/Mg(BH4)3浸渍的有序多孔炭[45]。共晶材料以非晶态形式存在有序多孔炭中,复合材料的二次吸氢过程可以在较低温度下吸氢,吸放氢动力学得到了明显改善。用11B-NMR[46]研究表明,碳孔隙内的硼氢化物不形成[B12H12]2-等中间体的,直接转化为硼单质。多孔碳表面仅少量转化为[B12H12]2-,但也受到碳材料的影响而不稳定,在380℃就发生分解。稳定中间产物的减少是放氢热力学改善的原因。
Javadian等[47]将高表面积二氧化碳活化的气凝胶与0.55 LiBH4-0.45 Mg(BH4)2进行复合,初次放氢样品释放13.3%(wt)H2(93%),更重要的是,在四次吸放氢循环后,相比未与气凝胶复合的[3.1%(wt)H2],该复合材料依然可以释放8.3%(wt)H2(58%),具有优异的储氢性能。氟化石墨(FGi)可以提供大量纳米活性位点且两种硼氢化物与FGi相互作用形成稳定的氟化物(MgF2和LiF)[48]。3Mg(BH4)2-3LiBH4-4FGi复合材料的可以在170℃以下在几秒钟内完成氢的释放。且几乎没有B2H6和HF气体杂质产生。
与Mg(BH4)2-LiBH4体系相比,0.4 NaBH4-0.6Mg(BH4)2复合体系在205℃下共晶熔化[50],与原始的Mg(BH4)2相比,0.4NaBH4-0.6Mg(BH4)2混合物不稳定,低至180℃下放氢。Zheng等[49]通过将该体系与具有更大的表面积和单层碳氟层的氟化石墨烯复合,球磨后的石墨烯的边缘起皱(图6)。同时,Mg(BH4)2和NaBH4颗粒在FG内外两面紧密粘附,形成中空结构,实现更加密集Mg(BH4)2和NaBH4颗粒的负载。在分解过程中形成NaMgF3导致反应焓的降低。该系统在125.7℃开始放氢,且在150℃几秒钟就可放出6%(wt)H2。

图6 三维碗状Mg(BH4)2-NaBH4-FG复合材料的形成机理图[49]
3.2 Mg(BH4)2-MHx系统
金属氢化物与Mg(BH4)2复合是一种改善性能的很好选择。Grube发现[51]γ-Mg(BH4)2-MHx,(M = Li, Na,Mg, Ca)复合材料在加热过程中发生置换反应形成其他金属硼氢化物M(BH4)x。而在另一项研究中[52],该体系实现更好的储氢性能,Mg(BH4)2-0.5LiH复合材料在150℃开始放氢,250℃可释放10%(wt)H2以上,即使经过20个循环,仍可保留约3.5%(wt)的可逆氢容量。Li+的添加导致Mg2+的热力学失稳和提高B-H键的再生,使得复合材料循环吸放氢能力极大增强。而高能球磨使得复合材料尺寸的降低导致复合材料的放氢性能优于Grube[51]的研究。
对于Mg(BH4)2-AlH3体系[53]。Mg(BH4)2-AlH3复合材料的脱氢起始温度降至130.8℃,总脱氢能力为11.9%(wt)。可以在一定条件下实现部分可逆吸氢,但循环容量较低[2.0%(wt)],有待提高。氢硼化镁脱氢放氢性能优于Mg(BH4)2-LiH是由于AlH3先放氢,同时分解生成Al与Mg(BH4)2发生了化学反应。该体系不同温度下的反应产物不同,350℃下产生的Mg2Al4比400~500℃下产生的MgAlB4有更好的可逆性。而AlH3、LiH2协同与Mg(BH4)2形成复合材料可以保持3个循环无明显衰退,具有比单独添加AlH3或LiH2更好的循环稳定性[54]。该复合材料初始温度的降低是因为Mg(BH4)2和LiH的存在影响了AlH3的放氢,以AlH3为Al源与Mg(BH4)2的反应生成MgAlB4,对循环各阶段的微观结构分析,确定了Mg(BH4)2-AlH3-0.5LiH复合材料中[BH4]-的再生,揭示了MgAlB4与LiH之间再加氢形成的LiBH4和MgH2有利于可逆储氢性能的稳定。
3.3 Mg(BH4)2-MAlH4系统
由于具有较低分解温度的金属氢化物对Mg(BH4)2的放氢过程都有积极的影响,因此在160℃下即可放氢的LiAlH4被引入到Mg(BH4)2复合体系。通过研究LiAlH4-Mg(BH4)2复合体系放氢过程会形成Mg-Al合金和Al等产物[55]。Jiang等[56]研究以Al、LiAlH4作为Al源来研究Al源对Mg(BH4)2的储氢性能的影响,由LiAlH4分解原位生成的Al具有更高的活性和分散性,有效降低Mg(BH4)2活化能,且原位生产的Al加速产物的可逆吸氢过程生成LiBH4和MgH2。这与AlH3的对Mg(BH4)2的作用机理相类似。
同样采用纳米限域的方法将Mg(BH4)2和LiAlH4颗粒均匀分散在氟化石墨FGi表面会有更优异的放氢表现[57],大比表面积的FGi阻碍了Mg(BH4)2和LiAlH4两者之间的置换反应。在Mg(BH4)2-LiAlH4-30FGi复合材料在68.2℃在几秒钟内完全放出7.12%(wt)的H2,具有超快的氢解吸动力学行为。进一步研究发现,LiAlH4脱氢在低温下首先放氢,该过程可以在很短的时间内提供大量的热量,这导致局部温度迅速的上升,从而导致Mg(BH4)2脱氢,整个脱氢过程可以很快完成。因此LiAlH4可以作为一个“微型打火机”,在低温下触发Mg(BH4)2脱氢。
Liu等[58]将Mg(BH4)2与NaAlH4混合同样发生置换反应,形成Mg(AlH4)2和NaBH4。初始放氢温度为101℃,Mg(AlH4)2首先分解生成MgH2和Al,原位Al的形成改善了MgH2的动力学,这与LiAlH4作为Al源来研究Al对Mg(BH4)2的反应类似。在Mg(BH4)2-NaAlH4基础上掺杂TiF3的复合材料可在75℃开始放氢,TiF3组分通过形成含钛和含氟的相关化合物起到了催化作用,进一步改善的吸放氢性能[59]。以上部分氢化反应复合材料具体分解过程如表3所示。

表3 氢化反应复合材料具体分解过程表
目前,在Mg(BH4)2与其他含氢金属化合物复合体系中有两大理论,1)其他含氢金属化合物首先分解,原位生成具有高活性的物质再与Mg(BH4)2反应来破坏Mg(BH4)2中B-H键的稳定。2)其他含氢金属化合物与Mg(BH4)2在加热过程发生置换反应来改变化学反应途径。反应过程形成金属硼化物而不是硼,降低了金属硼氢化物体系脱氢的总焓变,从而提高了放氢性能循环过程中原位生成的金属硼氢化物或金属硼化物,这些物质是复合体系二次吸氢容量提高的主要原因,同时其他金属离子的存在更加有利于[BH4]-的再生。
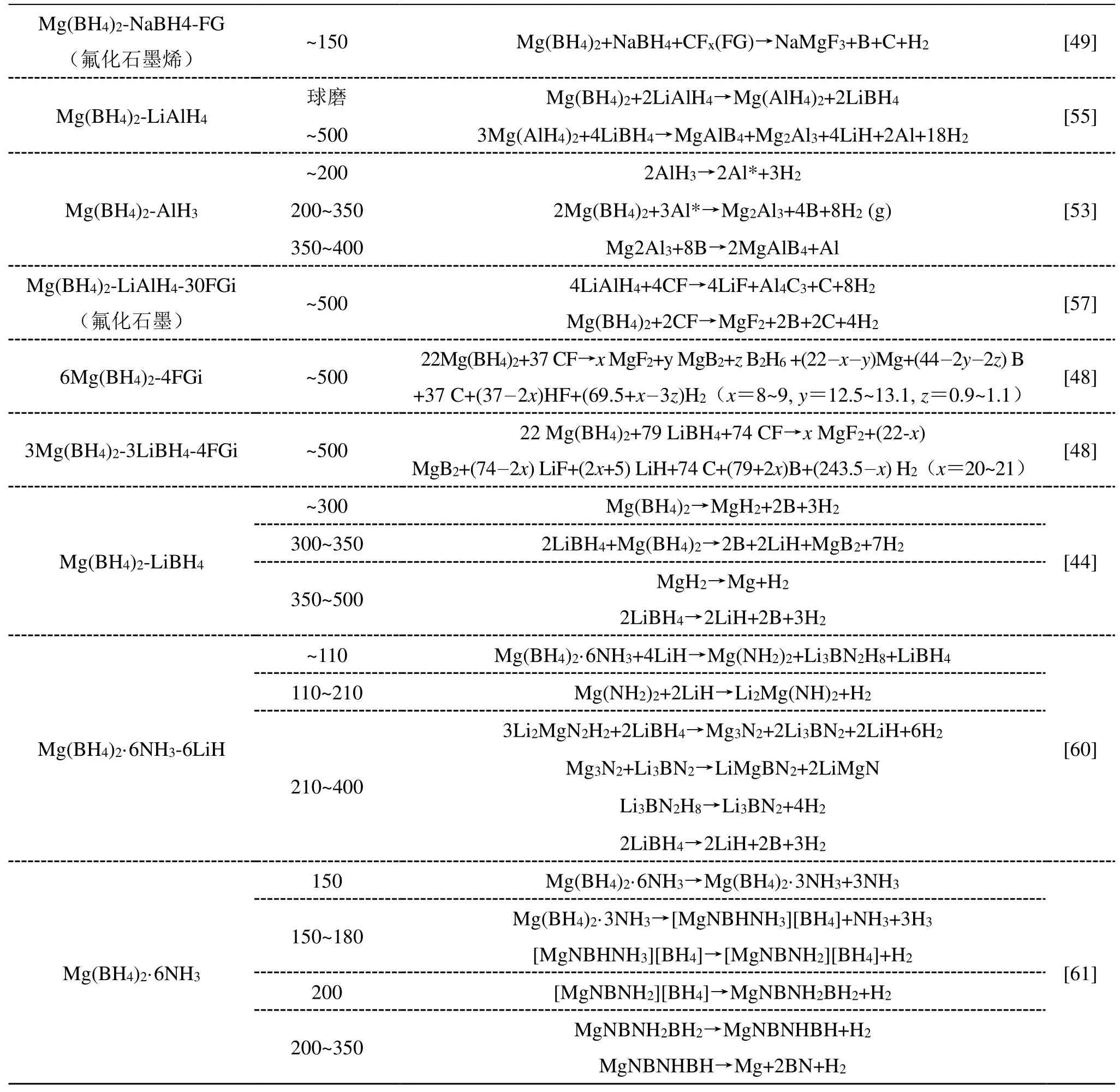
(续表3)
4 Mg(BH4)2衍生物
近年来,人们提出了一种降低金属硼氢化物脱氢反应温度的新策略,即配合NH3形成氨化物,金属硼氢化物在加热氨化时实现了N-Hδ+···Hδ--B局部结合形成化学键,从而改变金属硼氢化物的热力学稳定性和提高氢质量密度[61-63]。Mg(BH4)2可以与NH3反应形成络合物Mg(BH4)2·6NH3,Mg(BH4)2·6NH3在118℃动态真空中加热Mg(BH4)2·6NH34 h释放出氨气后生成Mg(BH4)2·2NH3。进一步加热后氢为主要气态产物,生成硼氮化镁、氮化硼和无定形硼[61]。

图8 Mg(BH4)2·6NH3加热分解过程[61]
通过形成Mg(BH4)2衍生物初始放氢温度上明显低于硼氢化镁的初始放氢温度,但氨气的释放对于所需要高纯氢气的燃料电池是无法满足的,而通过硼氢化镁氨合物与氨硼烷或其他金属氢化物的结合可以有效的提高纯氢的释放[60,64],这些方法都是通过促进NHδ+与其他H-离子有效重组形成氢气来抑制氨气的释放。这与Mg(BH4)2-LiNH2与Mg(BH4)2-NaNH2的[BH4]-中的H-和[NH2]中的H+结合的机理类似。这为后续通过合成新型硼氢化镁衍生物来提高氢释放纯度探索出可行的道路。
5 总结
Mg(BH4)2因具有高储氢容量和具有相对较低的放氢温度在固态储氢材料中具有重要的地位,但储氢性能仍然无法满足质子交换膜燃料电池的实际应用。因此当前通过添加过渡金属及其化合物添加剂、纳米化及催化、制备氢化反应复合材料来改善Mg(BH4)2的储氢性能。其中在纳米化的基础上添加催化剂或与制备氢化反应纳米复合材料是最有效的方法,未来研究的重点是开发具有更加稳定、不易团聚的纳米Mg(BH4)2与活性更高的Mg(BH4)2基新型氢化反应体系复合材料,这在未来将具有更高的应用价值。
