1株羊源产气荚膜梭菌的分离鉴定及毒素分型检测
2021-11-11张疏桐胡天豪孙筱峰陈思怀宋振辉郭建华
张疏桐,胡天豪,孙筱峰,陈思怀,张 耕,宋振辉,郭建华
(西南大学动物医学院,重庆 荣昌 402460)
产气荚膜梭菌(Clostridiumperfringens)旧称魏氏梭菌,可引起人和动物急性腹泻、坏死性肠炎、肠道出血、气性坏疽等疾病,是许多国家人和动物食源性感染的重要病原[1-4]。该菌是一种革兰阳性厌氧菌,菌体直杆状,边缘整齐,两端钝圆,大小为(0.6~2.4)μm×(1.3~19.0)μm,单在或成双,短链,无鞭毛,不能运动,能产生荚膜并释放毒素。在一般条件下罕见形成芽孢,在适宜的pH、温度、合适比例的碳源等条件下才可形成芽孢。根据产生4种致死性毒素(α、β、ε、ι)的能力可将产气荚膜梭菌分为A、B、C、D和E五个毒素型,每个毒素型均能引起人或畜禽特定的疾病[5-6]。
据相关文献报道,产气荚膜梭菌可引起羊只腹胀、腹泻、食欲废绝甚至突然死亡,感染病例剖检可见心、肺、肾、胃肠道等多器官坏死、水肿或充血、出血等病变[7]。更为严重的是,该菌感染可引起膘情较好的羊急性死亡,且病死率超过40%[8]。因而,选择合适的疫苗对防治羊产气荚膜梭菌病显得至关重要。
本试验通过对某黑山羊养殖场猝死羊进行剖检观察,从1只小肠严重出血坏死的羊的回肠内容物中分离得到1株溶血性厌氧致病菌,对该菌进行培养特性观察、生化试验、药敏试验、小鼠致病性试验,16S rDNA PCR扩增及测序、产气荚膜梭菌毒力基因PCR试验,旨在鉴定该病原菌药物敏感性、致病性和毒素分型,为该病防制及疫苗研究提供理论指导。
1 材料与方法
1.1 病料 某黑山羊养殖场急性死亡羊只,腹部膨大,剖检后发现回肠浆膜面严重出血,呈黑色,心包积液。无菌采集病死羊只出血肠段内容物作为病原分离材料[9]。
1.2 菌种的分离培养及形态观察 将病料划线接种于鲜血琼脂培养基,置于2.5 L厌氧培养袋中,37 ℃ 培养24 h[10],挑取单菌落,于脑心浸出液肉汤(Brain heart infusion,BHI)厌氧培养基(5 mL BHI培养基+1 mL 液体石蜡)中37 ℃培养24 h,分别于6、12、18 h和24 h观察培养基状态并记录,取37 ℃培养24 h的菌液25 μL进行涂片,分别进行革兰染色、荚膜染色、芽孢染色和镜检。取BHI厌氧培养基中菌种,稀释至约109CFU/mL(OD600=0.600),吸取菌液500 μL,加入500 μL 60%无菌甘油,置于-40 ℃保存。
1.3 培养特性观察 将1.2中厌氧培养基中的菌液稀释至108CFU/mL,吸取200 μL,分别均匀涂布于20 mL LB琼脂培养基、麦康凯琼脂培养基、胰蛋白胨大豆琼脂(Tryptic soy agar,TSA)培养基、巧克力琼脂培养基、BHI琼脂培养基上,分别置于2.5 L厌氧培养袋和有氧环境37 ℃培养24 h,观察生长情况。
1.4 生化特性鉴定 分离菌分别接种于葡萄糖、山梨醇、乳糖、棉子糖、明胶、侧金盏花醇、卫矛醇、枸橼酸盐等生化反应管,37 ℃厌氧培养24 h,进行生化鉴定;牛乳发酵试验,观察是否出现牛乳汹涌发酵现象[11]。
1.5 药敏试验 吸取0.5麦氏浓度菌液200 μL,均匀涂布于TSA平板,待菌液吸收后,35 ℃厌氧培养24 h后测量各药物抑菌圈的大小(mm),根据药敏纸片说明书及抑菌圈直径大小判断分离菌株对各种药物的敏感程度[12]。
1.6 16S rDNA的PCR扩增 根据文献报道的16S rDNA 通用引物进行菌液PCR,反应体系为50 μL:TaqPCR Master Mix(2×,Blue dye)25 μL,27F引物和1492R引物(10 μmol/mL,由重庆擎科兴业生物技术有限公司合成)各1 μL,菌液(108CFU/mL)3 μL,ddH2O补至50 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃ 10 min,4 ℃ 保温[13]。
1.7 毒力基因检测 根据文献[14-15]合成plc、cpb、cpe、iap、etx、netB基因的引物(表2),分别检测产气荚膜梭菌α、β、ε、ι毒素、肠毒素和坏死性肠炎毒素B[14-15]。反应体系为25 μL:TaqPCR Master Mix(2×,Blue dye)12.5 μL,上下游引物(10 μmol/mL,由重庆擎科兴业生物技术有限公司合成)各2 μL,菌悬液2 μL,ddH2O补至25 μL。反应条件:95 ℃预变性5 min;95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃ 10 min,4 ℃保温[15]。

表1 产气荚膜梭菌毒素基因及其引物
1.8 致病性试验 将20日龄清洁级昆明小鼠分为试验组和对照组,其中试验组分为两组,每组5只小鼠,试验组的小鼠分别腹腔注射106、108CFU/mL 的分离菌,0.5 mL/只(即5×105CFU组和5×107CFU 组);对照组的小鼠分别腹腔注射0.5 mL无菌BHI液体培养基。注射后每1 h观察并记录1次结果,观察小鼠死亡时间;若24 h后,小鼠仍未死亡,则将5×105CFU 组菌液浓度提高至109CFU/mL,继续腹腔注射0.5 mL/只(即5×108CFU 组),试验结束将各组小鼠进行剖检,无菌分离腹水划线接种TSA培养基进行病原鉴定[13]。
2 结果
2.1 细菌生长状况及形态
2.1.1 细菌生长状况 细菌在鲜血琼脂平板上生长良好,呈光滑、灰白色、半透明、微凸起菌落,直径约5 mm,有明显的β溶血现象;液体培养基生长6 h时,培养液未浑浊;12 h时培养液开始出现浑浊,但无明显产气;18 h时培养液浑浊,有小气泡产生;24 h 时培养液浑浊,产生大量气体。
2.1.2 镜检形态 革兰染色可见革兰阳性、短棒状、两极着染杆菌;孔雀石绿-番红染色未见明显芽孢结构,荚膜染色可见清晰荚膜。
2.1.3 培养特性 有氧条件下,该菌在5种培养基上均不生长;厌氧培养袋中,该菌在BHI琼脂、TSA和鲜血琼脂3种培养基上均生长良好,在LB琼脂上生长较差,在麦康凯琼脂上不生长。
2.2 16S rDNA的PCR与序列分析 将16S rDNA扩增产物送至重庆擎科兴业生物技术有限公司进行测序,测序结果在GenBank上进行BLAST比对,与云南昆明分离得到的编号为MK156683.1(KM-1株)的A型产气荚膜梭菌同源性达到99%。
2.3 生化试验 发酵葡萄糖、乳糖产酸产气,不发酵卫矛醇、山梨醇、侧金盏花醇和棉子糖,明胶试验、MR试验阳性,V-P、靛基质、枸橼酸盐利用、H2S试验均为阴性,脲酶试验可疑,石蕊牛乳培养基出现该菌特有的“爆裂发酵”现象(表2)。
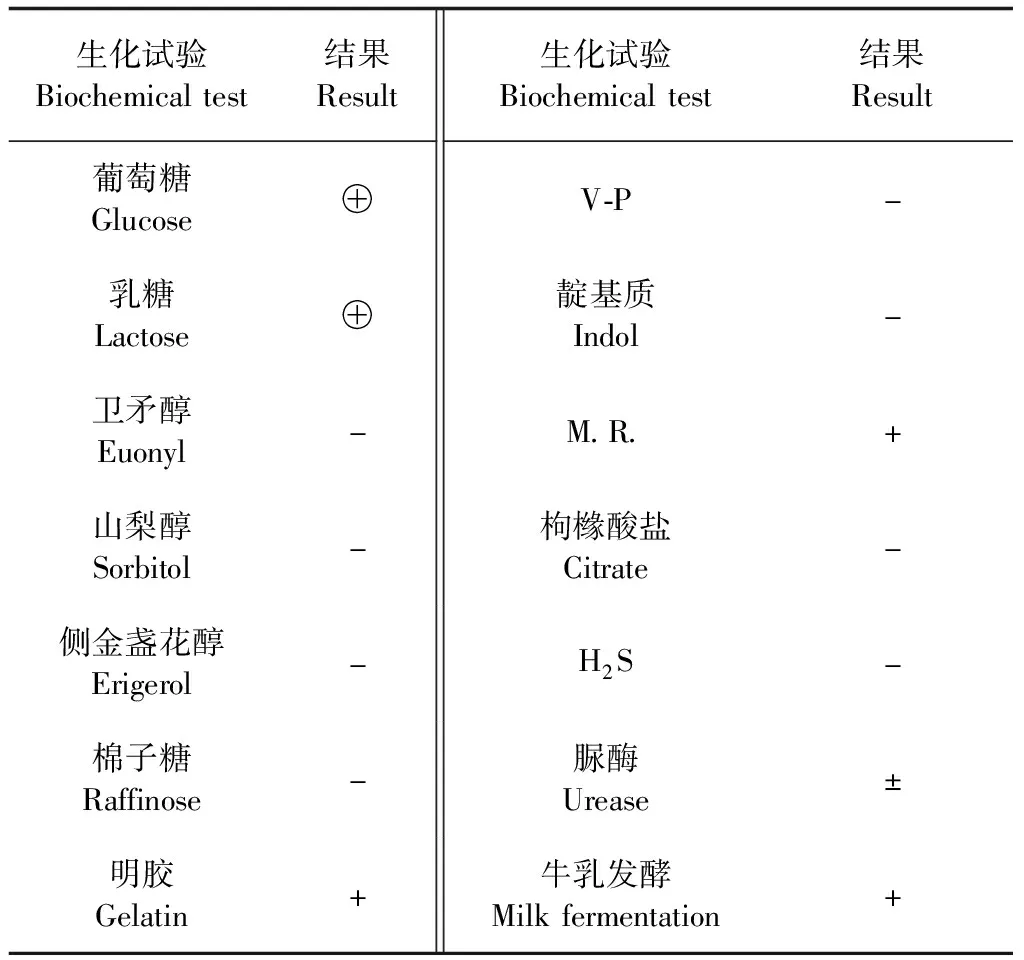
表2 分离株生化试验结果
2.4 药敏试验 经药敏试验证实,该分离菌株对阿米卡星、卡那霉素、庆大霉素等氨基糖苷类抗生素及多黏菌素B、复方新诺明耐药,对红霉素中度敏感,对其他抗生素高度敏感(表3)。

表3 分离株药敏试验结果
2.5 毒素基因的扩增 如图1所示,仅扩增得到α毒素基因plc。

图1 毒素基因的PCR扩增结果
2.6 致病性试验 24 h时,对照组、5×105CFU组和5×107CFU组小鼠均不死亡,但5×107CFU组小鼠精神沉郁、食欲减退,将菌液量浓度提高至5×108CFU时,小鼠6 h全部死亡。剖检发现5×107CFU 组和5×108CFU组小鼠空肠、回肠均有出血现象,5×108CFU组鼠肠道严重出血,且两组小鼠腹水中均分离得到该菌。
3 讨论
根据文献[17]可知,自1892年首先从人腐败尸体膨胀产气的血管中第1次分离得到产气荚膜梭菌起,产气荚膜梭菌的研究就从未停止过。研究表明,产气荚膜梭菌可引起人和动物气性坏疽、坏死性肠炎、食物中毒、肠毒血症等严重的传染性疾病,是一类非常重要的人兽共患病病原,关系着生物安全和食品安全。近年来,随着分子生物学技术的发展,对于产气荚膜梭菌分子病原学方面的研究也日趋成熟,不仅有多重PCR对产气荚膜梭菌进行毒素分型的研究[18],也有对产气荚膜梭菌基因工程疫苗的研究[19]。再加之产气荚膜梭菌病具有病死率高、病程极短、感染动物种类多等特点,因此,对其防制方面的研究显得尤为重要。
本试验从生产实际出发,对某黑山羊场坏死性肠炎死亡羊只进行肠内容物细菌分离培养,经形态学鉴定、16S rDNA测序、生化试验、毒力基因PCR检测证实该分离菌株为A型产气荚膜梭菌。致病性试验证实小鼠致死量5×107~5×108CFU。经药敏试验显示,该菌株对氨基糖苷类抗生素有较强的耐药性,但对其他抗生素较敏感。后续的研究中,将对该分离菌株进行plc基因全序列扩增及测序,并对其进行核苷酸序列比对分析,观察其是否存在碱基位点突变及突变对其毒力的影响。
结合本试验结果,建议该黑山羊养殖场对环境进行全面消毒,对已发病羊只可注射氨苄西林、青霉素钾等药物进行治疗,并适当补液;对未发病羊只,可紧急接种A型产气荚膜梭菌灭活疫苗进行预防,以免此病的流行。
