2株J亚群禽白血病病毒毒株的分离鉴定及全基因组序列分析
2021-11-11郭雨欣游广炬李晓齐郑世军王永强
郭雨欣,游广炬,李晓齐,高 丽,郑世军,王永强
(中国农业大学动物医学院 农业部动物流行病学重点实验室,北京 海淀 100193)
禽白血病是由反转录病毒科反转录病毒属的禽白血病病毒(Avian leukosis virus,ALV)引起的一种肿瘤性疾病,可以造成鸡的免疫抑制及生长迟缓,给养鸡业带来了巨大的经济损失[1-3]。根据ALV囊膜糖蛋白抗原性可将其分为7个亚群,分别为A、B、C、D、J、K亚群及E亚群,其中E亚群为内源性病毒,一般没有致病性或致病性很弱[2]。J亚群ALV是我国目前流行范围最广,带来经济损失最大的禽白血病病毒[4]。自1999年我国首次从鸡场病鸡中分离出ALV-J以来,ALV-J迅速在全国各地流行[5-7]。近年发现流行的ALV-J的囊膜基因发生了多处碱基突变,并出现J亚群与其他亚群病毒产生重组毒株的现象,给ALV防控带来了新的挑战[8-10]。
2019年12月和2020年7月,河北某鸡场的地方品系鸡群中先后发生2起疑似禽白血病的疫情,本试验采集病鸡的血浆和组织病料,通过接种DF-1细胞,分离出2株禽白血病病毒,经鉴定这2株病毒均为J亚群毒株,分别命名为CAU2019和CAU2020。通过克隆获得这2个毒株的全基因组序列,并对其核苷酸序列进行同源性分析及构建长末端重复序列(LTR)、gp85基因的遗传进化树,为更好的了解我国目前ALV流行毒株的进化趋势,以及ALV的防控和净化提供参考。
1 材料与方法
1.1 试验材料 血浆和病料组织样本分别于2019年12月和2020年7月采集自河北某鸡场地方品种鸡。禽白血病病毒ELISA抗原检测试剂盒,购自动物用生物制品国家工程研究中心(NECVB);DF-1细胞、禽白血病病毒P27单克隆抗体,由本实验室保存;DMEM、PBS和胰酶,均购自中科迈晨(北京)科技有限公司;大肠杆菌DH5α感受态细胞、pEASY-Blunt Zero Cloning Kit,均购自北京全式金生物技术有限公司;Q5高保真酶,购自NEB(北京)有限公司;组织细胞基因组DNA快速提取试剂盒,购自北京艾德莱生物科技有限公司。
1.2 病鸡剖检及病毒分离鉴定 剖检病死鸡,将病料研磨过滤所得的病毒液和血浆样品接种于DF-1细胞,并设立空白对照,盲传2代后,在第7天提取细胞上清用禽白血病病毒P27抗原ELISA检测试剂盒检测P27抗原。
1.3 ALV全病毒DNA的制备 取P27检测阳性的细胞培养上清接种DF-1细胞,3 d后用组织细胞基因组DNA快速提取试剂盒提取接种后的DF-1细胞DNA,获取ALV全病毒DNA。
1.4 全病毒基因组 PCR扩增以ALV-J经典毒株HPRS103(GenBank:Z46390.1)的序列为参考设计3对 引物,引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。以1.3中得到的ALV全病毒DNA为模板,用NEB Q5高保真酶进行PCR扩增。

表1 ALV-J全基因组扩增所用引物序列
1.5 克隆测序 PCR扩增所得产物回收纯化后,按说明书将目的片段连接到pEASY-Blunt Zero载体上,转化DH5α大肠杆菌后,接种LBA平板并过夜培养,挑取单菌落进行PCR鉴定,阳性菌液送往北京诺赛基因组研究有限公司测序。
1.6 全基因组序列拼接及分析 使用DNASTAR的SeqMan软件对2个毒株的各3段测序结果进行拼接,获得全基因组序列。然后用DNASTAR的MegAlign软件将获得的CAU2019和CAU2020全基因组序列与国内外公布的其他ALV毒株进行同源性比对。采用MEGA-X软件用最大似然法对分离的ALV全病毒序列和其他ALV亚群毒株进行遗传进化分析,Bootstrap值为1 000。本试验所用参考毒株见表2。

表2 ALV参考毒株信息
2 结果
2.1 病鸡剖检 剖检病死鸡,可见病死鸡肝脏肿大,表面有灰白色小点状肿瘤灶;脾脏肿大且呈灰棕色;心脏表面可见灰白色肿瘤结节(图1)。

图1 病鸡的病理剖检
2.2 病毒的分离及鉴定 取病死鸡的肝脾组织研磨液及血浆样品接种DF-1细胞,盲传2代后收集细胞上清,用ALV P27抗原ELISA试剂盒检测,结果有2个 样品为阳性,对照组检测结果为阴性。分离得到2株ALV毒株,分别命名为CAU2019和CAU2020。
2.3 全病毒基因组序列PCR扩增 使用1.4中的引物扩增2株病毒全病毒基因组,分别扩增出3段大小约为3 000 bp的特异性条带,与预期的目的基因片段大小相符(图2)。
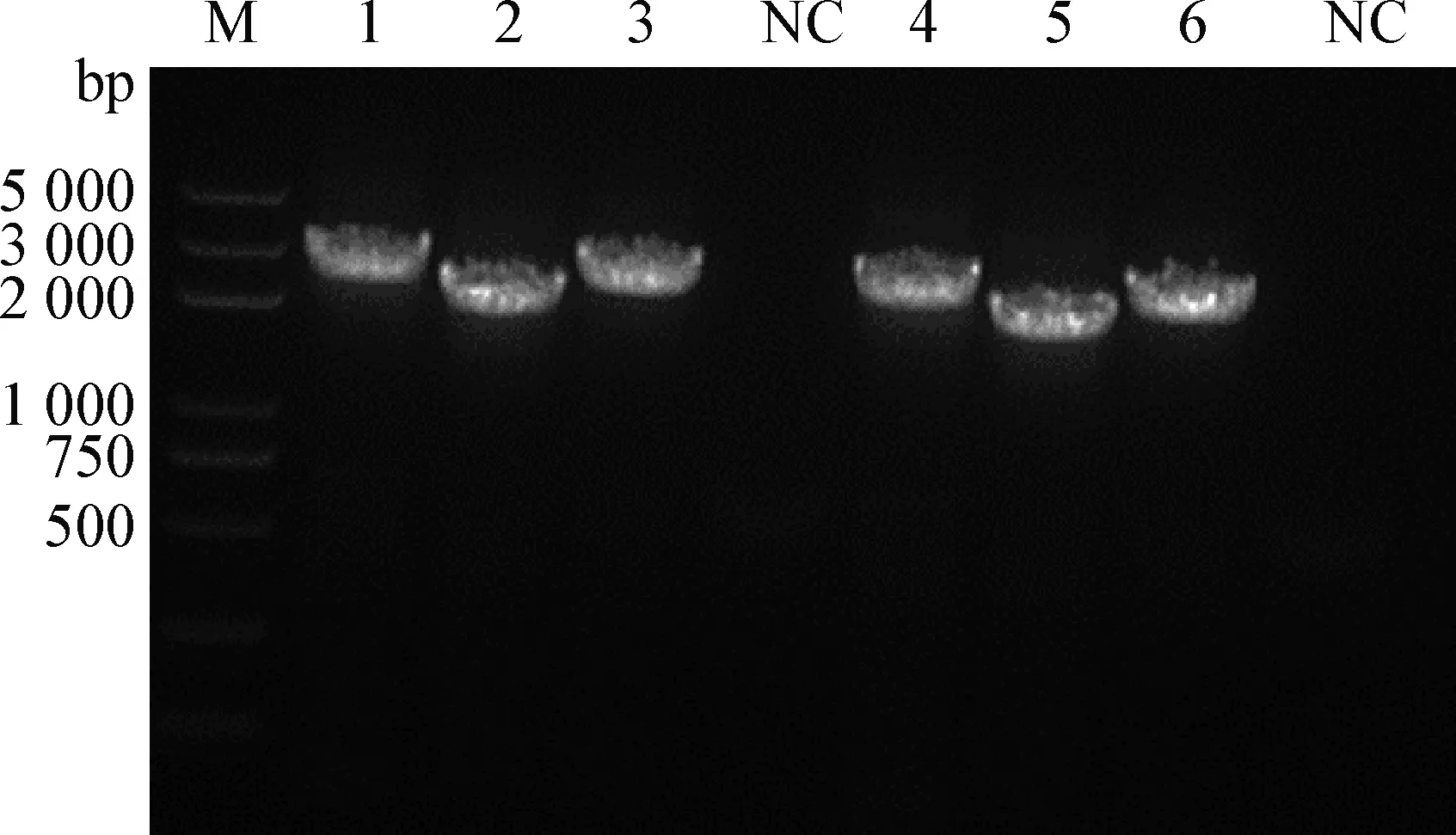
图2 病毒全基因组DNA的PCR扩增
2.4 分离毒株基因组序列测定 通过DNASTAR的Seqmen软件对2个毒株的测序序列进行拼接,得到CAU2019与CAU2020的全病毒基因组序列,将序列上传至GenBank,登录号分别为MW891539和MW891540。其中,CAU2019全长7 610 bp,CAU2020全长7 594 bp。2株病毒间的基因组序列同源性为95.27%。2个毒株结构均符合典型反转录病毒基因组的结构特点,即LTR-gag-pol-env-LTR。其中,CAU2019的LTR段长度为325 bp,gag长度为2 106 bp,pol长度为2 622 bp,env长度为1 686 bp;CAU2020的LTR段长度为325 bp,gag长度为2 094 bp,pol长度为2 622 bp,env长度为1 692 bp。
2.5 分离株与现有毒株序列同源性分析 利用DNASTAR软件对2个分离株全基因组与GenBank 中收录的国内外ALV参考毒株进行同源性分析。结果显示,CAU2019与2011年山东分离的SD110503(GenBank登录号:KF562374.1)同源性最高,为95.7%;CAU2020与2009年江苏分离的JS09GY3(GenBank登录号:GU982308.1)同源性最高,为97.0%。2个分离株与J亚群参考株同源性均在94.1%~97.0%(表3)。
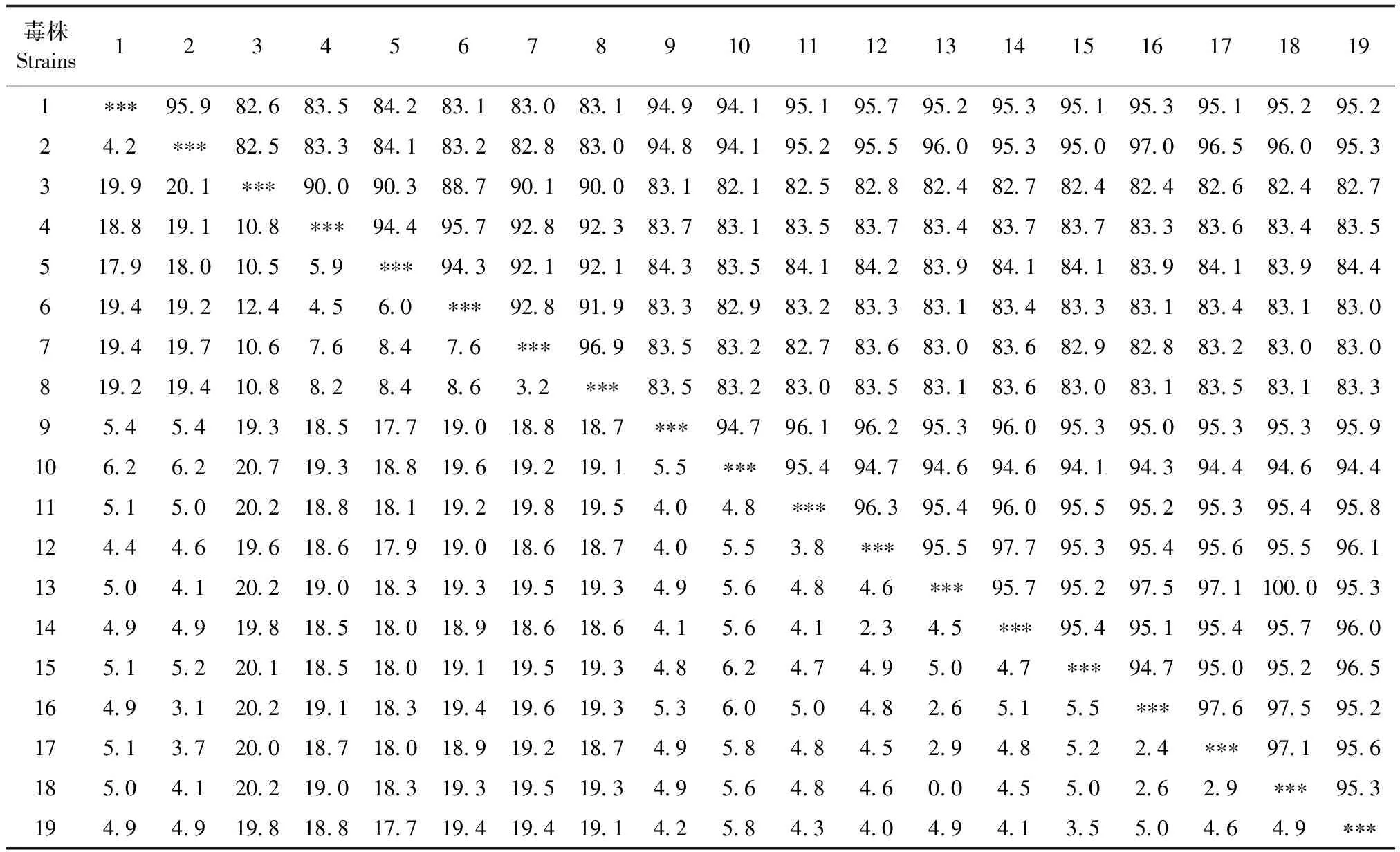
表3 ALV分离毒株全基因组核苷酸序列的同源性分析
利用DNAMAN软件,将2个分离株与表中提到的与它们同源性最高的ALV-J毒株进行全基因组序列比对。比对发现,CAU2019在3′UTR有30 bp和11 bp的2段不连续碱基缺失;CAU2020在3′UTR 有29 bp的1段碱基缺失。
利用DNASTAR软件对2个分离株的各基因片段与ALV各亚群参考毒株进行同源性分析。结果显示,2个分离株的gag和pol基因相对保守。CAU2019的gag与各参考株同源性在94.5%~96.3%,CAU2019的pol与各参考株同源性在97.0%~98.4%;CAU2020的gag与各参考株同源性在94.5%~96.2%,CAU2020的pol与各参考株同源性在96.5%~97.8%。2个分离株LTR基因序列都与J亚群参考株同源性最高,CAU2019的LTR与J亚群HPRS103和ADOL-7501同源性最高,达93.2%,与K亚群SD0501同源性最低,仅64.4%;CAU2020的LTR与J亚群HPRS103同源性最高,达92.3%,与K亚群JS13LY19同源性最低,仅64.4%。CAU2019和CAU2020的gp85、gp37基因片段与J亚群各参考株同源性最高,为93.8%(HPRS103)和94.2%(SD07LK1),与其余亚群参考株同源性较低,最高仅有51.5%和60.1%,表明该毒株属于J亚群(表4)。
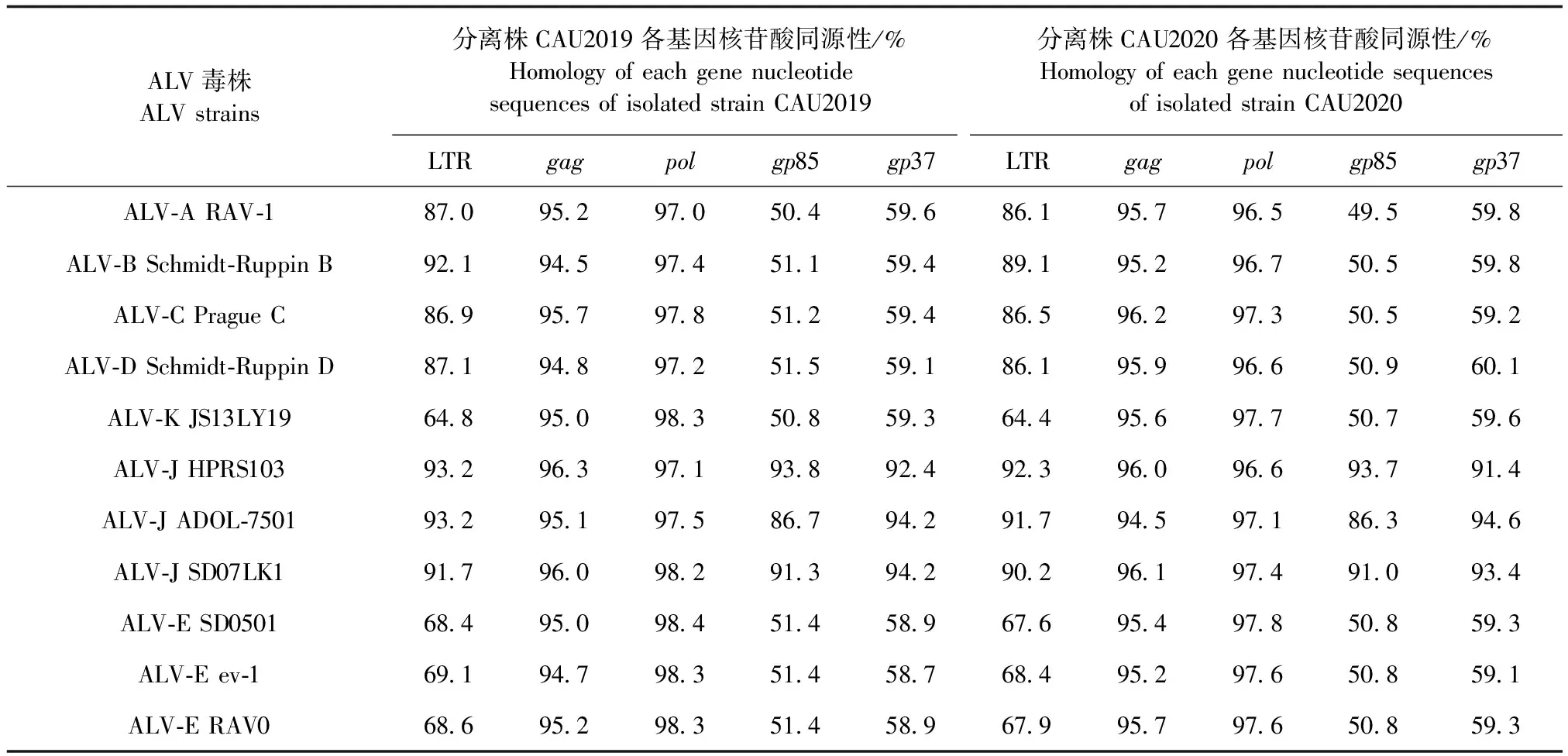
表4 CAU2019株、CAU2020株各基因片段与不同亚群毒株核苷酸序列的同源性分析
利用MEGA-X软件分别对CAU2019和CAU2020株的gp85和LTR基因进行遗传进化分析。gp85是鉴定ALV亚群的主要依据,结果如图4所示,2个分离株gp85基因片段与J亚群中国分离株JS16JH9的亲缘关系最近,与J亚群各毒株在同一进化支上,进一步表明2个分离株是J亚群ALV。2个分离株LTR基因片段与J亚群JS09GY3、SDAU1102、SD1005、Fu-J4亲缘关系最近,同属一个大的进化支。
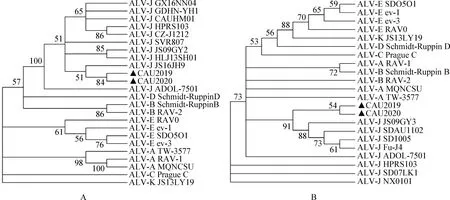
图4 2个ALV分离株gp85基因(A)、LTR基因(B)系统进化树
3 讨论
自20世纪90年代首次从肉鸡群中分离出ALV-J以来,其便在世界各地流行,致病作用和宿主范围不断扩大[2,11]。作为一种免疫抑制病,在实际生产中禽白血病常与其他疾病混合感染,给养禽业带来了重大经济损失[12-14]。此外,由于ALV是单链RNA病毒,病毒基因组结构不稳定,非常容易发生突变和重组,给疫苗的研发和疾病的预防也带来了困难[6,15-16]。
本试验从河北某鸡场地方品种鸡中分离出2株禽白血病病毒,经PCR鉴定后,又对2个毒株进行了序列同源性分析与遗传进化分析。序列分析显示,分离株CAU2019与2011年山东分离的SD110503(GenBank登录号:KF562374.1)同源性最高,为95.7%;CAU2020与2009年江苏分离的JS09GY3(GenBank登录号:GU982308.1)同源性最高,为97.0%。2个毒株的pol和gag基因序列比较保守,而gp85与gp37基因序列突变较多。此外,通过将分离株病毒的全基因组序列与表3中J亚群参考毒株进行比较,发现CAU2019在 3′UTR的7 030 bp与7 399 bp处有30 bp和11 bp的2段不连续碱基缺失,其30 bp碱基缺失的位置和长度与ALV-J广东分离毒株(GD13HY和GD1411-4)、广西分离株(GX14FF03)和英国分离株(MQNCSU)的基因序列相似,11 bp碱基缺失的位置和长度与ALV-J广东分离毒株(GD1408-2)和广西分离株(GX14ZS14)相似。CAU2020在3′UTR的7 005 bp处有29 bp的1段 碱基缺失,该缺失的位置和长度与ALV-J广东分离毒株SCAU1903基因序列相似。
根据gp85和LTR的序列同源性分析及遗传进化分析结果,推测CAU2019和CAU2020均为J亚群禽白血病病毒。CAU2019可能来源于山东的肉鸡分离株SD110503,CAU2020可能来源于江苏的肉鸡分离株JS09GY3。CAU2019与CAU2020在3′UTR段的缺失突变与广东和广西的少数几株ALV-J和英国的1株ALV-J十分相似。由此猜想,本试验中2株 河北ALV分离株的亲代或祖代可能与广东和广西的ALV-J发生过基因重组,亦或者3′UTR段的碱基缺失是自然进化中的一种演变趋势[7]。有研究显示,禽白血病病毒3′UTR对病毒的转录有调控作用,3′UTR区域的碱基缺失能够增强ALV-J的体内复制能力,从而增强ALV-J的致病力,本分离株3′UTR的变异与近年来ALV-J致病性的增强是否有关有待进一步研究[12-14]。近年来ALV毒株突变的可能性有加大趋势,加之我国地方品系鸡群中ALV遗传背景十分复杂,防控和净化的难度也日益增加[6,17-19]。本试验丰富了ALV基因组库资源的同时,还为ALV的进化趋势提供了一定参考,有助于制定更好的防控措施,减少我国养禽业经济损失。但是,这些毒株的变异究竟是个例还是具有一定规律性,发生变异后毒株的致病力是否受到影响等问题还有待进一步研究。
