核转录因子HMBOX1在结直肠癌中的表达及其与预后的关系
2021-11-09何承志戚文静王辉杜天明王智辉王向阳
何承志,戚文静,王辉,杜天明,王智辉,王向阳
(华中科技大学同济医学院附属武汉中心医院胃肠外科,湖北武汉430000)
结直肠癌是常见的恶性肿瘤,发病率在所有肿瘤中排第3 位,也是全球癌症相关死亡的第二大原因,2020年新诊断病例190 万例,死亡93.5 万例[1]。由于生活和饮食习惯的改变,过去10年中我国结直肠癌发病率迅速上升[2-3]。转移仍是结直肠癌患者死亡的主要原因,约60%的结直肠癌患者发展成转移性结直肠癌[4],转移性结直肠癌5年生存率仅13.9%[5-6]。 核 转 录 因 子 HMBOX1 (homeoboxcontaining 1,HMBOX1)是2006年分离并鉴定的转录因子,基因包含21 个外显子,长度在160 kb,定位于染色体8p21.2,属于同源框基因成员,其特征在于含有同源框结构域[7],HMBOX1 在多种正常组织中表达,包括胰腺、大脑、胎盘、前列腺、胸腺、睾丸等[8]。研究报道同源框基因在多种肿瘤中表达异常,调控细胞增殖、凋亡、转移及细胞自我更新[9-10]。在胶质瘤[11]和卵巢癌[12]中HMBOX1异常低表达,且低表达与上述肿瘤预后差相关。然而,HMBOX1 在结直肠癌中的表达及与预后的关系尚未见报道。本研究探讨HMBOX1 在人结直肠癌组织中的表达及预后特征。
1 材料与方法
1.1 组织标本纳入和排除标准
纳入2012年1月—2014年1月在我院胃肠外科结直肠癌切除术后癌组织标本90 例,其中男59 例,女31 例,I~II 期26 例,III~IV 期64 例,其中15 例为结肠癌肝转移。纳入标准:⑴术后经病理确诊为结直肠癌;⑵按NCCN 指南原则治疗;⑶患者病历资料完整且具有完整随访资料。排除标准:患者随访或临床资料缺失者。本研究标本采集自病理组织样本库并经医院批准。
1.2 临床资料收集和随访
收集患者性别、肿瘤部位、年龄、转移等一般临床资料,采用TNM 分期(第8 版)[13]对病理组织切片再评估以准确确定TNM 分期。随访方案:术后采用门诊或电话方式随访,随访频次为3 个月或半年/次。截止日期为2020年1月,术后至肿瘤首次复发或随访截止时间定义为无瘤生存时间。术后至患者死亡或随访截止时间定义为总生存时间。共4 例失访,在生存曲线上表示为截断值。
1.3 免疫组化
对4 μm 厚的石蜡包埋的结直肠癌组织切片行免疫组织化学染色。将切片在二甲苯中脱石蜡并在梯度乙醇中再水合。用3%过氧化氢溶液阻断内源性过氧化物酶活性,并用3%山羊血清阻断非特异性结合。随后,将HMBOX1 一抗(1∶200,英国Abcam 公司) 于组织切片上孵育,4 ℃下孵育过夜。将磷酸盐缓冲盐水孵育的切片设定为阴性对照。将切片与过氧化物酶缀合的二抗一起温育。二氨基联苯胺用作色原体,苏木素复染后,在200 倍显微镜下观察计数,在镜下10 个视野下取平均值。
1.4 免疫组化评分
评估HMBOX1 染色,选择每个载玻片中的至少10 个随机视野并由两位病理大夫独立评估。阳性细胞的百分比评分如下:0% 细胞染色=0 分;1%~10%细胞染色=1 分;11%~50%细胞染色=2 分;51%~100%细胞染色=3 分。染色强度评分如下:阴性染色=0 分;弱染色=1 分;中度染色=2 分;重度染色=3 分。最终免疫评分=染色百分比评分×染色强度评分。根据免疫染色评分结果将患者分为两组:染色总评分0~4 分定义为HMBOX1 低表达组;染色总评分6~9 分定义为HMBOX1 高表达组。
1.5 统计学处理
所有分析均使用SPSS 17.0 软件进行。两组间的比较使用t检验,χ2检验评估临床病理特征与HMBOX1 表达间的关系。Cox 比例风险回归分析模型分析影响结直肠癌患者预后的危险因素,Kaplan-Meier 生存曲线和对数秩检验分析结直肠癌患者预后差异,P<0.05 为差异有统计学意义。
2 结 果
2.1 HMBOX1在结肠癌组织中的表达
免疫组化示HMBOX1 主要定位于结直肠癌细胞核及胞浆中,组化染色阳性。90 例患者中,HMBOX1 高表达组有54(60.0%)例,HMBOX1 低表达组有36(40.0%)例,HMBOX1 在结直肠癌癌组织中典型组化染色结果见图1。
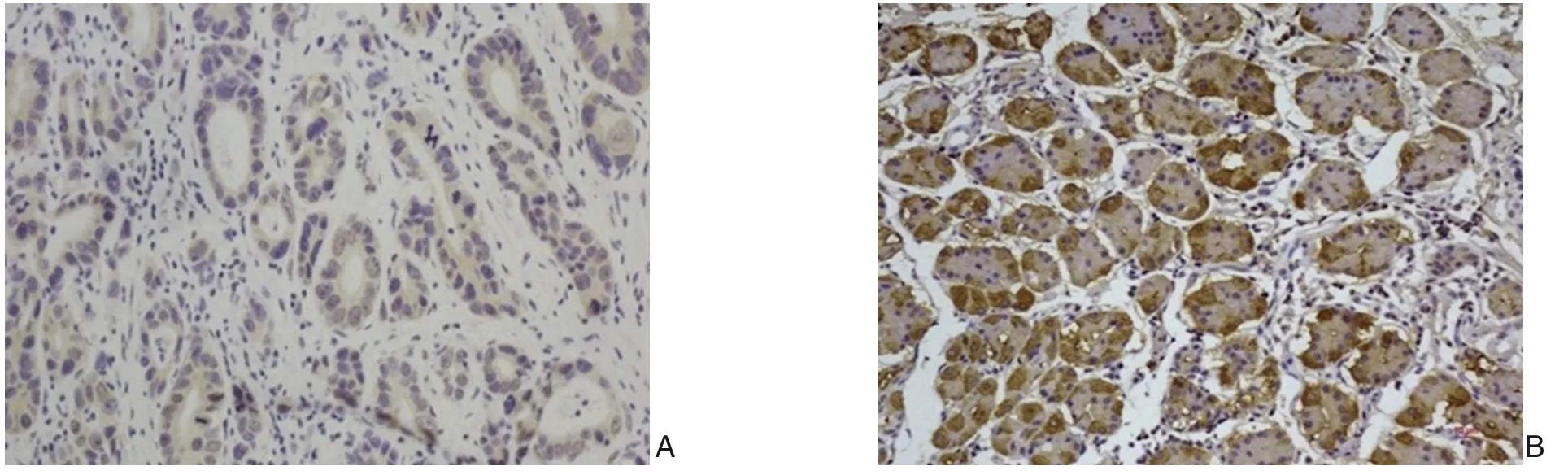
图1 结直肠癌组织中HMBOX1免疫组织化学染色(×200)Figure 1 Immunohistochemical staining of HMBOX1 in colorectal cancer tissues (×200)
2.2 结直肠癌组织中HMBOX1 表达与临床病理参数的关系
分析结果显示,HMBOX1 高表达与TNM 分期、N 分类、M 分类及分化程度明显有关(均P<0.05),而与患者年龄、性别和T 分类无明显关系(均P>0.05)(表1)。
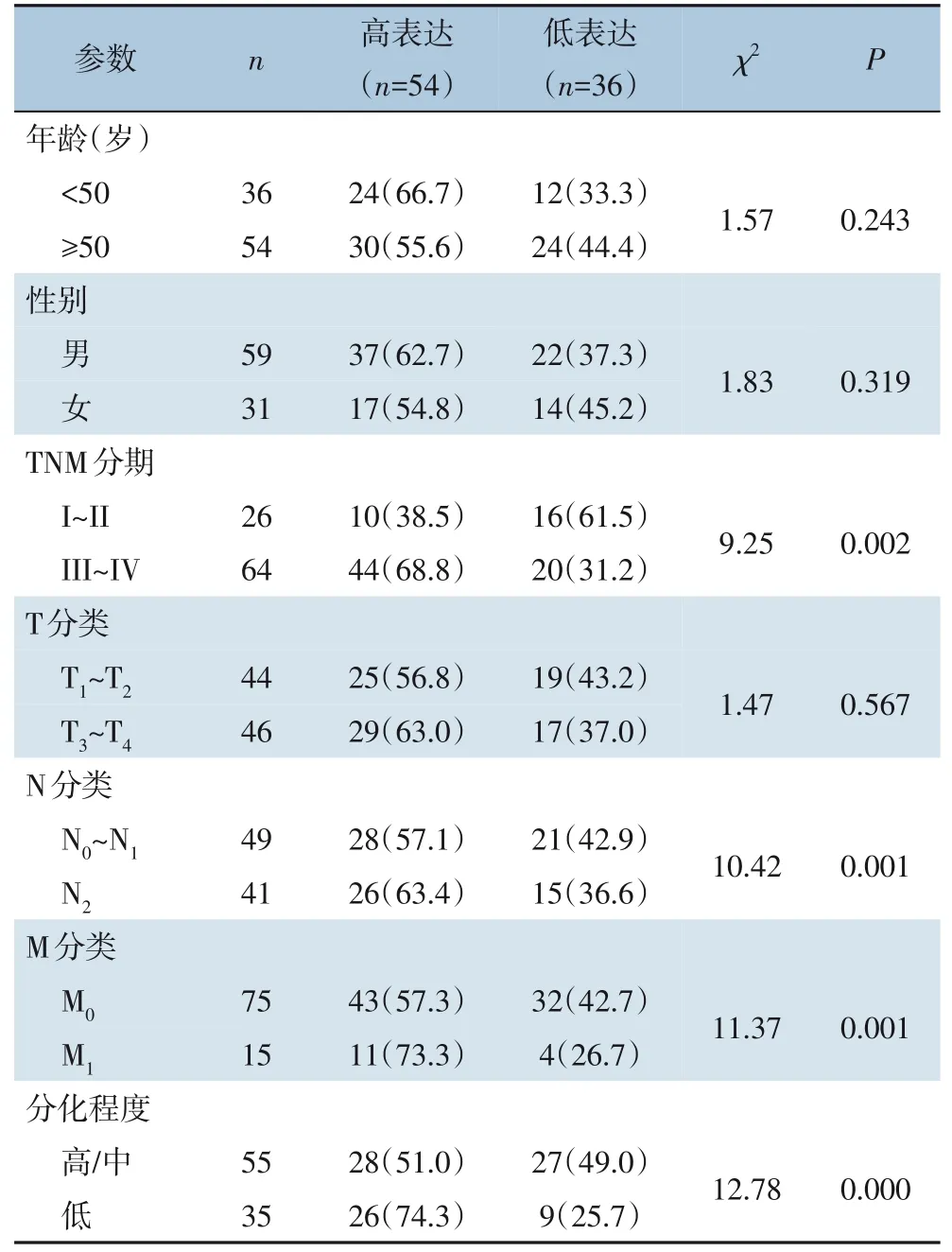
表1 HMBOX1表达与临床病理特征的关系[n(%)]Table 1 Associations between clinicopathologic characteris‐tics and HMBOX1 expression[n(%)]
2.3 HMBOX1的表达与患者预后间的关系
HMBOX1 高表达组1、3、5年无瘤生存率分别为90.0%、50.5%、18.3%,HMBOX1 低表达组1、3、5年无瘤生存率分别为93.6%、67.4%及34.2%,HMBOX1 高表达组无瘤生存率低于HMBOX1 低表达组(均P<0.01)(图2A)。HMBOX1 高表达组1、3、5年总生存率分别为92.0%、 63.4%、 22.6%,HMBOX1 低表达组1、3、5年总生存率分别为95.3%、75.1%及36.1%,HMBOX1 高表达组总生存率低于HMBOX1 低表达组(均P<0.01)(图2B)。
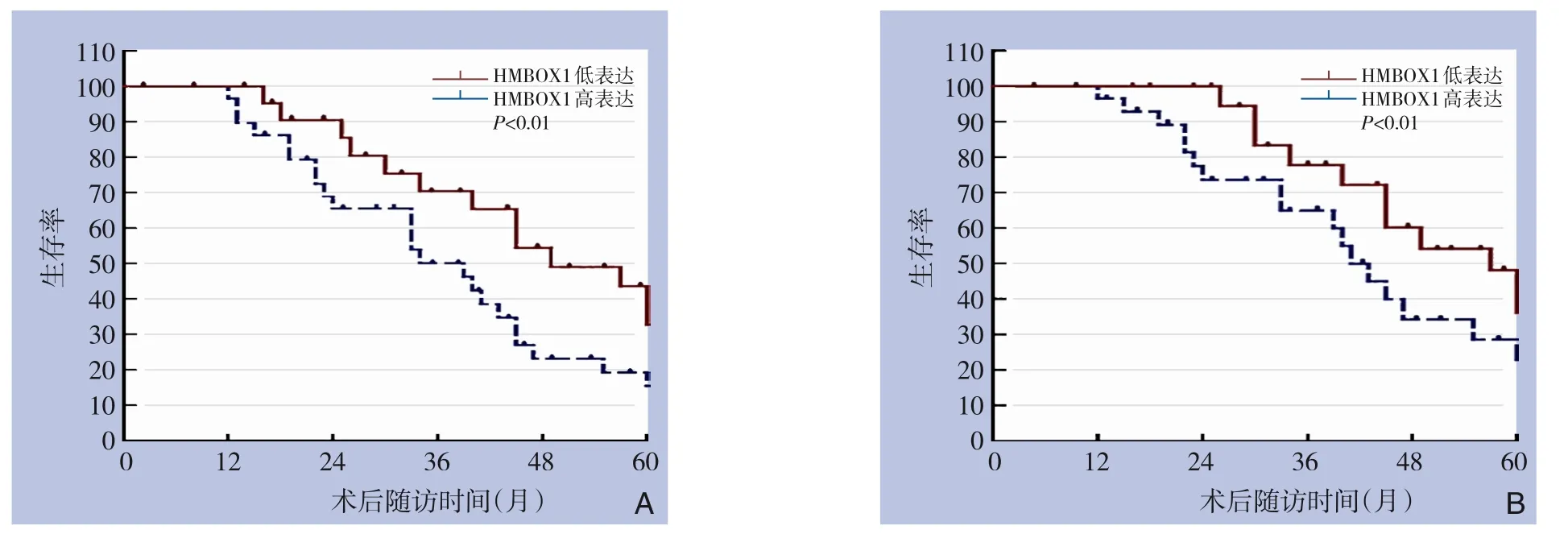
图2 不同HMBOX1表达状态结直肠癌患者的生存分析Figure 2 Survival analysis of colorectal cancer patients with different HMBOX1 expressions
2.4 影响无瘤生存率的危险因素分析
单因素分析表明, III~IV 期、 N2、 M1及HMBOX1 高表达为影响无瘤生存率的危险因素(均P<0.05), 多因素分析表明, III~IV 期、 M1及HMBOX1 高表达是影响无瘤生存率的独立危险因素(均P<0.05)(表2)。
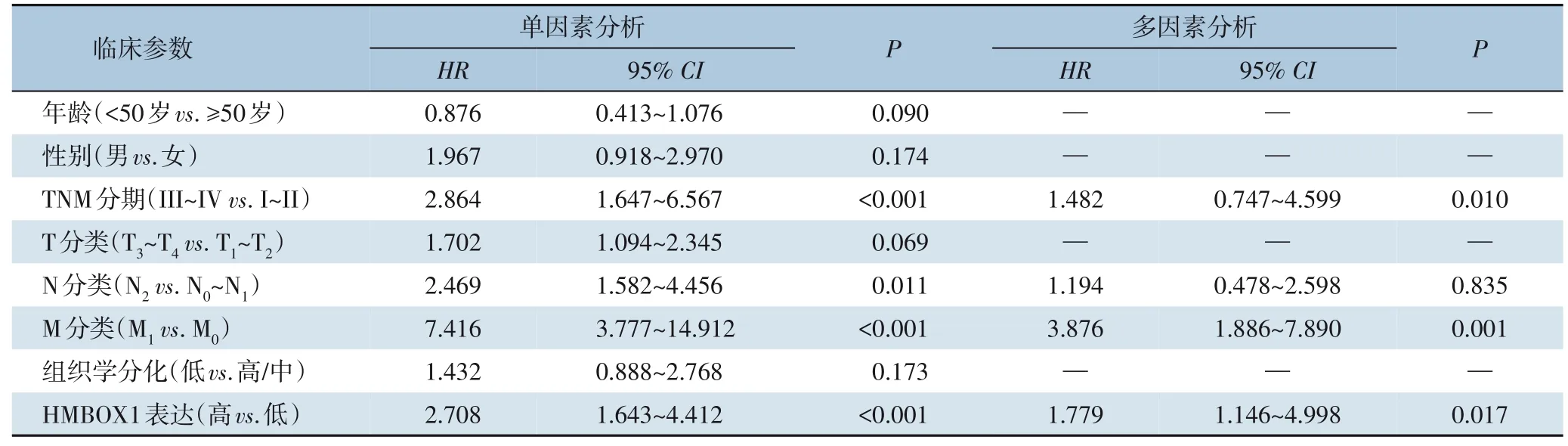
表2 影响无瘤生存率的危险因素分析Table 2 Analysis of risk factors for tumor-free survival
2.5 影响总生存率的危险因素分析
单变量分析显示,III~IV 期、M1、低分化及HMBOX1 高表达为影响总生存率的危险因素(均P<0.05),而多因素分析显示,III~IV 期、低分化及HMBOX1 高表达是影响总生存率的独立危险因素(均P<0.05)(表3)。
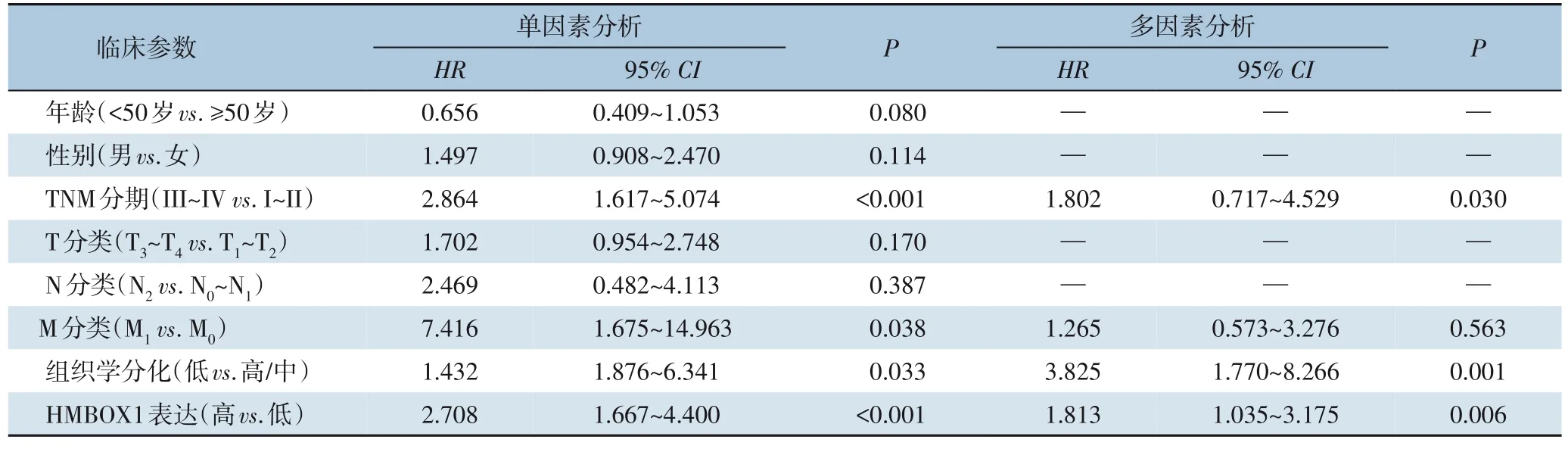
表3 影响总生存率的危险因素分析Table 3 Analysis of risk factors for overall survival
3 讨 论
现代肿瘤学认为,结直肠癌的发生是一系列环境因素、不良生活方式及遗传因素相互作用的结果。诸如,吸烟、缺乏运动、喝酒、肥胖、高脂低纤维素饮食等[14-15]。慢性炎症-发育不良-腺瘤-腺癌是结直肠癌发生的一般病理过程,包括原癌基因的激活、抑癌基因的抑制、甲基化及DNA损伤修复错配[16-17]。结直肠癌癌变过程涉及众多关键分子的突变或表达异常,包括Ras[18]、P21[19]、P53[20]、HMBOX1[21]等。
HMBOX1 是与DNA 损伤修复过程中的关键转录抑制因子,发挥转录抑制作用,属于同源框基因成员之一,最初发现其参与调节免疫功能和干细胞分化[22-23],后来发现其与维持端粒长度有关[21]。HMBOX1 主要在肾小管中表达,在正常胃组织中,HMBOX1 主要位于壁细胞中,提示HMBOX1可能与机体的正常功能有关。HMBOX1 是一种转录因子,只有从胞浆转运入胞核才能发挥调节基因转录的功能,在不同类型的组织或肿瘤中可能有不同的表达模式,即存在异质性[8]。在肾透明细胞癌[8]、胰腺癌[8]组织中呈高表达。在胃癌组织中,HMBOX1 呈高表达且主要定位于癌细胞核内,HMBOX1 阳性表达与淋巴结转移与TNM 分期呈负相关,且与胃癌术后患者总生存时间呈负相关。值得注意的是,HMBOX1 蛋白在胃癌组织中主要定位于细胞核,而在正常胃黏膜主要定位于胞浆[24]。与之不同,在肝癌组织中HMBOX1 呈低表达,且miR-548a-5p 通过靶向HMBOX1 的mRNA 的3 端非编码区抑制HMBOX1 的翻译,从而抑制肝癌细胞HepG2 的凋亡[8]。在胶质瘤中HMBOX1 也呈低表达,且与WHO 分级、Karnofsky 评分及微血管密度相关[11]。在高级别浆液性卵巢癌及细胞系中,HMBOX1 呈低表达,HMBOX1 可抑制卵巢癌细胞增殖,并通过下调抗凋亡蛋白Bcl-2、Bcl-xL,促进凋亡蛋白Bad、Bax、caspase-3及P53表达诱导细胞凋亡[12,21]。
本研究经免疫组化发现结直肠癌组织中HMBOX1 在细胞核及胞浆中表达阳性,HMBOX1 已被证实是一种抑制性转录因子,在细胞核中发挥转录调节作用,HMBOX1 在结直肠癌细胞核中的特定位置可能与HMBOX1 在结直肠癌发展中的作用有关。本研究发现HMBOX1 高表达者比例为60%,HMBOX1 低表达者比例为40%。研究[24]报道在胃癌中,HMBOX1 较邻近癌旁组织上调表达[9,24]。本研究发现HMBOX1 高表达与结直肠癌患者低分化、晚期TNM 分期、N 分类和M 分类显著相关,提示HMBOX1 高表达组患者肿瘤分化程度低且处于TNM晚期。HMBOX1 高表达与结直肠癌患者年龄、性别和T 分类间无统计学相关性,提示其表达不受上述因素影响。文献[8]报道肝癌中HMBOX1 低表达与肝癌患者晚期临床分期相关,结果与本研究相反,其可能原因为HMBOX1 在不同肿瘤中表达具有异质性。
HMBOX1 高表达组预后均显著差于HMBOX1 低表达组,提示高低表达组患者无瘤生存率和总生存率存在差异。这与胃癌[24]中的结果一致。然而,文献报道结果不尽一致,卵巢癌[12]中HMBOX1 低表达与卵巢癌预后不良显著相关,这与本研究结果相反。HMBOX1 异常表达与胶质瘤预后无明显相关性[11],其可能原因为HMBOX1 在癌症中的临床预后意义依据肿瘤类型而异。本研究Cox 比例风险回归分析中单因素和多因素分析均显示HMBOX1 高表达是影响结直肠癌术后患者无瘤生存率和总生存率的独立危险因素。 这与文献报道结果一致,在胃癌中,HMBOX1 高表达是胃癌独立危险因素[24]。
在结直肠癌中HMBOX1 表达影响预后的机制尚不清楚,可能原因如下:文献报道同源框基因的表达改变在肿瘤进展的不同阶段可发挥促进或抑制肿瘤发生和进展的双重作用[25],HMBOX1 作为同源框基因之一,细胞增殖的影响可能基于肿瘤类型不同而异。HMBOX1 高表达与TNM 分期相关,且显著降低结直肠癌患者的生存时间。在胃癌细胞系中,上调HMBOX1 表达可通过促进细胞周期,促进胃癌细胞增殖和迁移[24]。另一个机制可能是HMBOX1 参与癌症干细胞自我更新的维持和调节,并参与血管生成[26]。HMBOX1 高表达与血管内皮生长因子受体、转化生长因子β 及CD133 表达相关,而血管内皮生长因子受体、转化生长因子β 及CD133 均与肿瘤新生血管生长的促进因子,而高密度肿瘤血管生成则是结直肠癌癌细胞生长的重要条件之一[27-29]。
本研究存在如下局限性:本研究为单中心回顾性研究,研究病例数目较少,尚需要结合TCGA或GEO 预后数据库或多中心大样本研究进一步验证;本研究并未探讨HMBOX1 影响结直肠癌患者预后的分子机制,也是进一步的研究方向。
总之,结直肠癌中HMBOX1 表达与结直肠癌患者较差组织学分化、TNM 分期密切相关,HMBOX1 高表达组患者预后差于HMBOX1 低表达组患者,HMBOX1 表达是影响结直肠癌术后患者预后的独立危险因素。
