加速康复外科对腹腔镜胃癌根治术患者肿瘤细胞免疫、炎症因子及应激激素的影响
2021-11-09戴春谭明丁永斌华召来莫广沛史君成侯飞城
戴春,谭明,丁永斌,华召来,莫广沛,史君成,侯飞城
(1.江苏省扬中市人民医院普通外科,江苏扬中212200;2.江苏省人民医院普通外科,江苏南京210029;3.江苏省扬中市肿瘤防治研究所,江苏扬中212200)
胃癌是常见的消化道肿瘤,也是癌症相关死亡的主要原因。胃癌发病有很强的地域性特点,好发于东亚地区且病死率较高,其中男性每10 万中24 例死亡,女性每10 万中9.8 例死亡[1-2]。随着胃镜、手术、分子靶向及免疫治疗的进步,早期胃癌生存率大幅改善,但晚期胃癌病死率仍在25%~30%之间[3]。由于胃癌患者常伴有营养不良及其他慢性病,传统的围手术期处理常导致较高的术后并发症发生率,12.5%~39%[4]。加速康复外科(enhanced recovery after surgery,ERAS)是基于循证医学证据的一系列围手术期多学科技术的综合运用,包括快速通道麻醉、微创技术、最佳镇痛技术及强有力的术后护理(如术后早期进食、运动)等,以达到减轻围手术期患者心理和生理上的应激和炎症反应,改善患者营养和机体免疫状态,达到快速康复的目的[5-6]。ERAS 在肝胆外科、胃肠外科、减重外科、妇产科及甲乳外科均有应用[7-8]。较多研究[9]报道ERAS 可缩短住院时间、减少住院费用、改善营养状态、加快术后康复、提高生活质量、减少疼痛及改善心理状态。即便如此,加速康复外科对胃癌根治术患者细胞免疫功能及应激反应在分子水平上的影响仍鲜见研究和报道。本文旨在分子水平上研究接受ERAS 的胃癌切除术患者肿瘤正向及负向免疫调控细胞及调节性B 细胞(regulatory B cell,Breg) 数量变化、对应激反应激素促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质醇(cortisol,COR)和肾上腺素(epinephrine,EPI)及对炎症因子C 反应蛋白(c-reactive protein, CRP)和白细胞介素 6(interleukin 6,IL-6)的影响,以在分子水平上阐述ERAS 对胃癌细胞免疫功能、炎性因子及应激反应的影响。
1 资料与方法
1.1 纳入及排除标准
本研究纳入2018年1月—2020年12月间扬中市人民医院普外科收治的胃癌患者90 例,分为ERAS 组和对照组。其中ERAS 组43 例患者在ERAS理念指导下行围手术期管理,对照组47 例患者接受常规围术期处理。入组标准:⑴所有研究对象均经病理确诊为胃癌;⑵术前未行放疗和(或)化疗;⑶患者术前未发现明显远处转移,肿瘤分期在T3 及以下,可手术切除;⑷患者存在完整的术前检查和术后随访资料;⑸既往无胃镜下胃黏膜剥离手术史或上腹部手术史。剔除标准:⑴患者存在其他部位的恶性肿瘤;⑵接受姑息性手术切除患者;⑶经评估患者无法耐受手术治疗者;⑷中途不能完成研究者;⑸有炎症性或自身免疫性疾病者,如:IBD 肠病等。医院同一外科医疗组医师完成两组患者腹腔镜胃癌根治术。本研究方案经医院伦理委员会审查批准。
1.2 干预方法
1.2.1 对照组对照组按常规围手术期方案给予术前、麻醉及术后指导。术后2~3 d 待首次肛门排气后给予拔除胃管,术后5 d 内给予进流食,术后6 d过渡至正常饮食。
1.2.2 观察组ERAS 理念用于指导观察组患者围手术期处理,其干预措施参考2016 版专家共识[10]。术前:⑴患者被告知ERAS 实施内容,并对患者进行全面心理辅导,降低患者焦虑和紧张情绪,并宣教负面情绪管理,提高医护配合度;⑵术前6 h内禁食,术前2 h 饮用≤400 mL 碳水化合物,对糖尿病患者口服500 mL 果糖溶液;⑶术前无常规胃肠道准备;⑷麻醉后放置胃管,防止术中胃胀气。术中:⑴麻醉成功后导尿;⑵手术操作轻柔仔细,按照ERAS 原则轻柔精细操作和麻醉,尽量减少组织损伤,缩短操作时间,减轻创伤应激反应;⑶保温,维持手术室温度(25±2)℃,患者体温保持≥36 ℃;⑷液体治疗,按目标导向控制术中和术后液体管理;⑸引流管放置,放置1 根腹腔引流管至吻合口;⑹镇痛,采用自控式静脉止痛泵(PCA)+口服非甾体抗炎药,减少阿片类止痛药使用。术后:⑴拔除导尿管时间在术后1 d,对前列腺增生患者可依情况口服盐酸坦索罗辛胶囊,0.2 mg,1 次/d,或延后至术后2~3 d 拔除导尿管。拔除腹腔引流管时间在术后第2 d;⑵术后清醒活动,术后1 d 沿床边站立慢走,活动时间在1~2 h;术后2 d 活动时间增加至2~4 h,以后维持每日活动时间4~6 h;⑶手术后当天咀嚼口香糖,饮水量200~300 mL,进流食时间在术后1 d,术后2 d 流食量维持在1 000~1 500 mL,术后3 d增至2 000~2 200 mL,半流质饮食开始时间为肛门首次排气后;⑷每日补液量随着流质饮食量递减,2 000~2 500 mL 为每日总入量,口服入量≥2000 mL 时,静脉输液即停止。抗生素使用:术前30 min和术后当天各使用1次。
1.3 观察指标
1.3.1 手术相关指标记录并比较两组患者一般资料,包括:性别、年龄、体质量指数(body mass index,BMI)、美国麻醉医师协会(American society of Anesthesiologists, ASA) 体格情况评估分级、TNM 分期、肿瘤大小;手术相关指标,包括:手术方式、吻合方式、手术时间、术中出血量、淋巴结清扫数;术后指标,包括:术后下床活动时间、术后肛门首次排气时间、住院时间及术后并发症。
1.3.2 循环中T、B 细胞免疫相关指标术后1 d 和7 d 清晨抽取患者外周静脉血10 mL,取3 mL 加入CD3、CD4、CD8、CD11b、CD14、CD15、CD16、CD25、CD33、CD56、CD127(美国Invitrogen 公司)荧光抗体及破膜剂后,离心,上流式细胞仪检测正向免疫调节细胞(CD3+CD4+T 细胞、CD3+CD8+T细胞、CD16+CD56+NK 细胞);负向型免疫调节细胞[ 中性粒细胞型骨髓源性抑制细胞G-MDSC,CD11b+CD15+CD33+CD14-G-MDSC)、单核细胞型骨髓源性抑制细胞(M-MDSC,CD11b+CD15-CD33+CD14+、T-调节细胞(Treg,CD4+CD25+CD127low)]及Breg 细胞的百分比。
1.3.3 炎症及应激指标采集ERAS 组及对照组患者于术前及术后24 h 清晨静脉血20 mL,离心后取上清,采用化学发光法测定COR、ACTH、EPI 浓度,采用ELISA 试剂盒(美国Invitrogen 公司)测定CRP 及IL-6 的浓度。
1.4 统计学处理
数据分析采用SPSS 20.0 软件处理,均数±标准差(±s)表示正态分布的计量资料,t检验用于组间比较。例数(百分比)[n(%)]用于表示计数资料,组间比较采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组研究对象临床资料比较
ERAS 组与对照组在性别、年龄、BMI、ASA分级、TNM 分期、肿瘤大小、手术方式、吻合方式、手术时间、术中出血量及淋巴结清扫数方面差异均无统计学意义(均P>0.05),具有可比性(表1)。
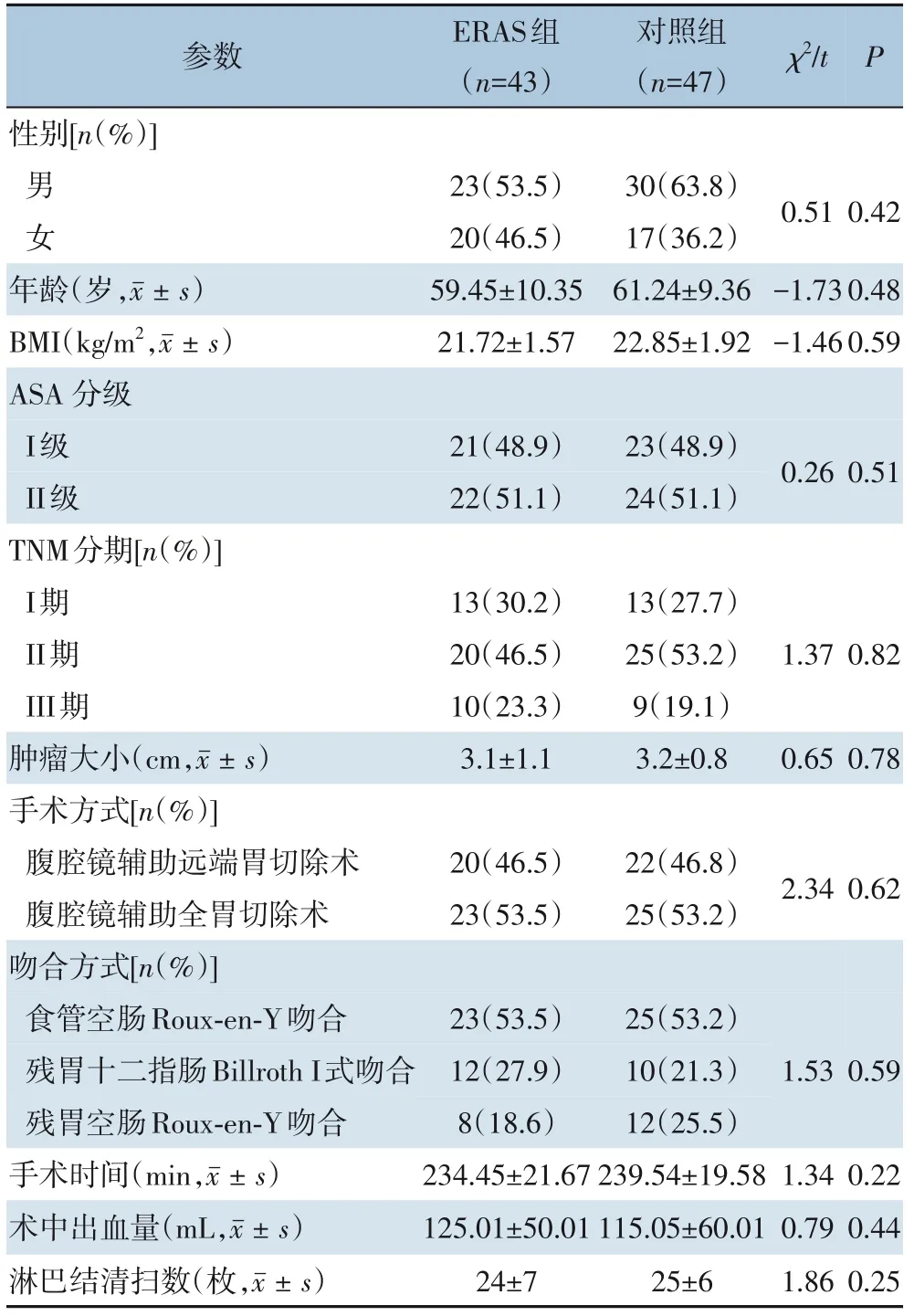
表1 ERAS组与对照组临床资料比较[n(%)]Table 1 Comparison of the general clinical data between ERAS group and control group[n(%)]
2.2 两组患者术后临床参数比较
ERAS 组术后下床活动时间和术后肛门首次排气时间均早于对照组[(25.01±3.20)hvs.(37.01±5.81) h,t=11.38,P=0.000;(74.51±10.81) hvs.(135.31±15.11) h,t=12.63,P=0.000],ERAS 组住院时间短于对照组[(7.01±0.72) dvs.(9.81±0.31)d,t=16.40,P=0.000](表2)。
表2 ERAS组与对照组患者术后临床参数比较(± s)Table 2 Comparison of the postoperative clinical parame‐ters between ERAS group and control group(± s)
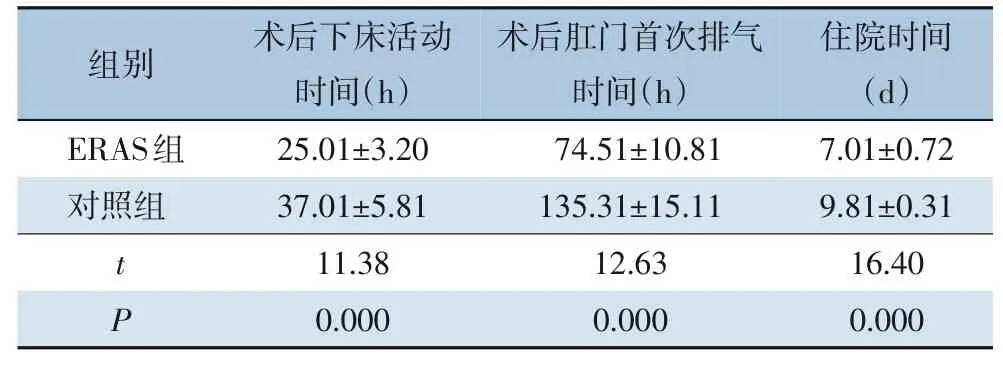
表2 ERAS组与对照组患者术后临床参数比较(± s)Table 2 Comparison of the postoperative clinical parame‐ters between ERAS group and control group(± s)
组别术后下床活动时间(h)术后肛门首次排气时间(h)住院时间(d)ERAS组对照组t P 25.01±3.20 37.01±5.81 11.38 0.000 74.51±10.81 135.31±15.11 12.63 0.000 7.01±0.72 9.81±0.31 16.40 0.000
2.3 两组患者术后并发症比较
ERAS组伤口感染1例,肺部感染1例,胃瘫1例,吻合口漏1 例,对照组伤口感染3 例,肺部感染3 例,胃瘫1 例,吻合口漏1 例,腹腔脓肿1 例,ERAS 组总术后并发症率小于对照组(9.3%vs.19.1%,P=0.027)(表3)。
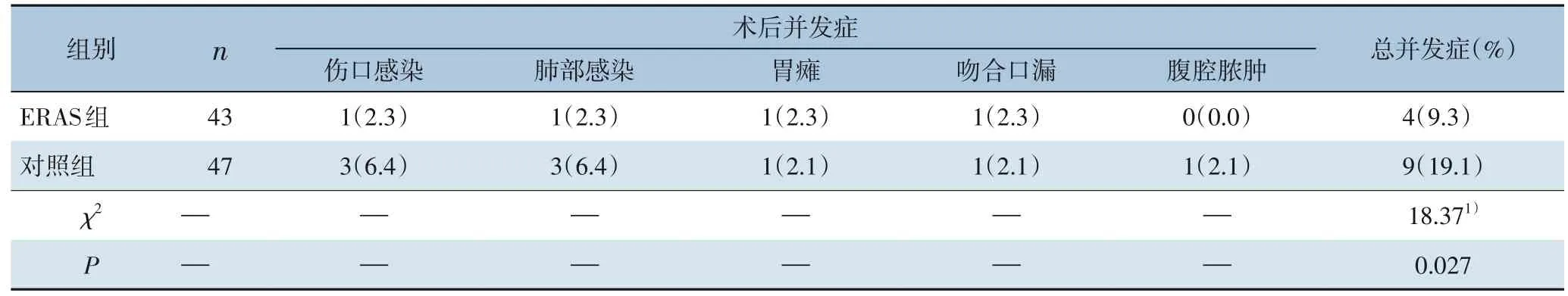
表3 ERAS组与对照组患者术后并发症对比[n(%)]Table 3 Comparison of postoperative complications between ERAS group and control group[n(%)]
2.4 两组患者细胞相关免疫指标比较
在术后1 d 及7 d,ERAS 组肿瘤正向免疫调控细胞 (CD3+CD4+T 细胞、 CD3+CD8+T 细胞、CD16+CD56+NK 细胞)所占百分比高于对照组(均P<0.05)(表4)。ERAS 组肿瘤负向免疫调控细胞(G-MDSC、M-MDSC 和Treg)所占百分比以及抑制肿瘤免疫相关的Breg 细胞所占百分比低于对照组(均P<0.05)(表5)。
表4 ERAS组与对照组患者术后1 d和7 d肿瘤正向免疫调控细胞百分比比较(%,± s)Table 4 Comparison of the percentages of positive immunoregulatory cells between ERAS group and control group at 1 and 7 d after operation(%,± s)

表4 ERAS组与对照组患者术后1 d和7 d肿瘤正向免疫调控细胞百分比比较(%,± s)Table 4 Comparison of the percentages of positive immunoregulatory cells between ERAS group and control group at 1 and 7 d after operation(%,± s)
组别n 术后7 d CD3+CD4+T细胞术后1 d CD3+CD8+T细胞术后1 d 术后7 d CD16+CD56+NK细胞术后1 d 术后7 d ERAS组对照组48.83±5.44 34.12±5.95 4.587 0.013 43 47 t P 41.83±5.34 33.84±5.12 4.071 0.011 27.81±3.12 21.84±4.44 3.187 0.010 31.81±4.91 24.82±5.95 4.843 0.021 11.12±2.93 7.83±2.44 4.431 0.011 14.63±2.23 10.73±4.13 4.921 0.007
表5 ERAS组与对照组患者术后1 d和7 d肿瘤负向免疫调控细胞百分比比较(%,± s)Table 5 Comparison of the percentage of negative immunoregulatory cells between ERAS group and control group at 1 and 7 d after operation(%,± s)
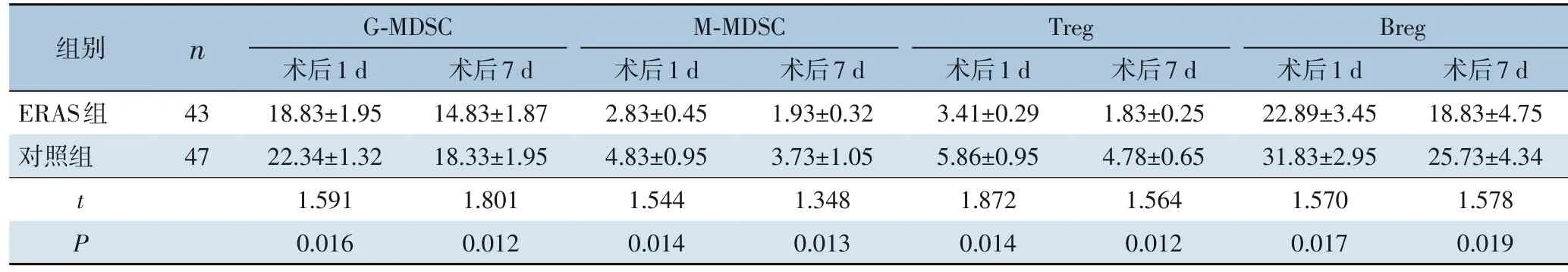
表5 ERAS组与对照组患者术后1 d和7 d肿瘤负向免疫调控细胞百分比比较(%,± s)Table 5 Comparison of the percentage of negative immunoregulatory cells between ERAS group and control group at 1 and 7 d after operation(%,± s)
组别n G-MDSC术后1 d 术后7 d M-MDSC术后1 d 术后7 d Treg术后1 d 术后7 d Breg术后1 d 术后7 d ERAS组对照组43 47 t P 18.83±1.95 22.34±1.32 1.591 0.016 14.83±1.87 18.33±1.95 1.801 0.012 2.83±0.45 4.83±0.95 1.544 0.014 1.93±0.32 3.73±1.05 1.348 0.013 3.41±0.29 5.86±0.95 1.872 0.014 1.83±0.25 4.78±0.65 1.564 0.012 22.89±3.45 31.83±2.95 1.570 0.017 18.83±4.75 25.73±4.34 1.578 0.019
2.5 两组患者炎症及应激指标的比较
术前,ERAS 组COR、ACTH、EPI 浓度与对照组差异无统计学意义(均P>0.05);术后24 h,ERAS 组COR、ACTH、EPI 浓度均明显低于对照组(均P<0.05);术前,ERAS 组CRP、IL-6 浓度与对照组差异均无统计学意义(均P>0.05),术后24 h,ERAS 组CRP、IL-6 浓度均明显低于对照组(均P<0.05)(表6)。
表6 ERAS组与对照组手术前后应激及炎症指标比较(± s)Table 6 Comparison of stress and inflammatory indexes between ERAS group and control group before and after operation(± s)
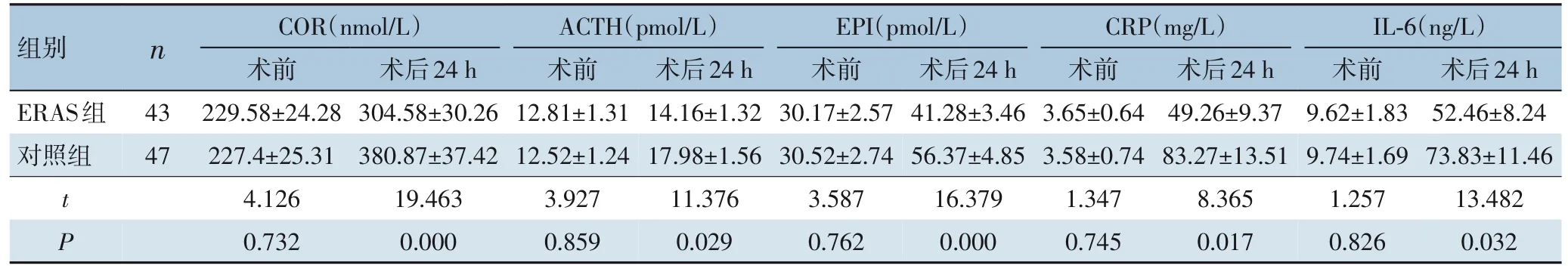
表6 ERAS组与对照组手术前后应激及炎症指标比较(± s)Table 6 Comparison of stress and inflammatory indexes between ERAS group and control group before and after operation(± s)
组别n 术后24 h CRP(mg/L)术前术后24 h COR(nmol/L)术前术后24 h ACTH(pmol/L)术前术后24 h EPI(pmol/L)术前IL-6(ng/L)术前术后24 h ERAS组对照组41.28±3.46 56.37±4.85 16.379 0.000 t P 3.65±0.64 3.58±0.74 1.347 0.745 49.26±9.37 83.27±13.51 8.365 0.017 229.58±24.28 227.4±25.31 4.126 0.732 43 47 304.58±30.26 380.87±37.42 19.463 0.000 12.81±1.31 12.52±1.24 3.927 0.859 14.16±1.32 17.98±1.56 11.376 0.029 30.17±2.57 30.52±2.74 3.587 0.762 9.62±1.83 9.74±1.69 1.257 0.826 52.46±8.24 73.83±11.46 13.482 0.032
3 讨 论
ERAS 理念和微创外科技术的有机融合促进外科向更小创伤发展的同时,也降低了手术风险,使得更多患者受益[11]。大量证据显示,采用ERAS理念对患者行围手术期管理可减轻手术创伤对患者心理、生理功能及应激反应的影响,保护机体器官功能,减少术后并发症的发生并加速患者康复[12-14]。顾亚奇等[15]报道对因胰头癌接受胰十二指肠切除术的患者行ERAS 管理,ERAS 组患者术后并发症低于对照组,术后营养指标转铁蛋白、前清蛋白和白蛋白均优于对照组。程康文等[16]报道对接受腹腔镜辅助胃癌根治术患者围手术期管理采用ERAS,ERAS 组补液量、肛门首次排气时间、排便时间、输液时间、住院时间及总费用均优于常规组,术后血清白蛋白、CRP、IL-6 及降钙素原均优于常规组。腹腔镜微创外科和ERAS 理念综合运用,可显著降低机体创伤和应激对患者免疫功能的影响[17]。
本研究发现ERAS 组术后下床活动及肛门排气时间缩短,住院时间缩短,显示ERAS 可加速患者康复过程,本研究结果与前人文献报道结果一致[16,18]。关于ERAS 方案的Meta 分析显示对胃癌患者围手术期采用ERAS 管理,可缩短患者住院时间,降低住院费用[19]。尽管如此,此前的研究仅限于探讨机体循环中CD4+和CD8+细胞数目或百分比变化,尚未对循环中T 和B 细胞免疫功能进行全面研究。
激活肿瘤免疫、杀死肿瘤细胞是机体清除肿瘤细胞的主要途径,而肿瘤细胞可通过多种机制逃避机体免疫系统的捕杀[20]。同时手术操作所带来的机体急性应激和炎症反应可影响免疫应答功能和免疫细胞的分化和成熟[21]。T 淋巴细胞是机体参与肿瘤免疫反应的重要细胞亚群,CD3+是T 细胞的共同分子标志物, 在成熟过程中可分为CD3+CD4+和CD3+CD8+亚群,而CD3+CD8+亚群作为重要的抗肿瘤细胞系,可分泌包括IL-2 和IFN-γ 在内的细胞因子,再经MHC-I 类分子信号刺激激活成熟为细胞毒性T 细胞,对肿瘤产生杀伤作用和并捕杀循环中的肿瘤细胞[22]。本研究发现患者在接受胃癌切除术后第1 天和7 天,与对照组相比,ERAS组患者循环中具有促进肿瘤免疫、消除肿瘤细胞功能的正向免疫调控T 细胞数量增多,体现在CD3+CD4+、CD3+CD8+和CD16+CD56+细胞百分比均显著升高,提示ERAS 对T 细胞免疫干扰影响较小。T 细胞中其他亚群,如G-MDSC、M-MDSC 和Treg 细胞在肿瘤免疫中也发挥重要作用,其可抑制肿瘤免疫,促进肿瘤细胞免疫逃逸,进而导致肿瘤细胞在循环中存活,促进肿瘤远处转移。T 细胞免疫受到G-MDSC、M-MDSC 和Treg 三种细胞的负性调控[23-24]。本研究发现在术后第1 和7 天,与对照组相比,ERAS 组患者G-MDSC、M-MDSC 和Treg 细胞百分比显著降低。提示ERAS 对T 细胞负向免疫干扰程度低,有利于肿瘤免疫应答。
最近研究认为Breg 细胞可在肿瘤免疫中发挥负调控作用,即抑制免疫应答[25-26]。本研究发现在术后第1 和7 天,与对照组相比,ERAS 组患者Breg细胞百分比显著降低,结果提示ERAS 对Breg 细胞功能的影响有利于肿瘤免疫应答并杀伤肿瘤细胞。
麻醉及手术创伤是种应激源,创伤应激反应大小与机体所受的损伤密切相关,麻醉及手术创伤可引起机体代谢、炎症因子释放及激素分泌等发生变化,进而影响患者术后康复。CRP 是机体经创伤和炎症反应后释放的非特异性急性时相蛋白,CRP 浓度与创伤及应激反应密切相关,术后CRP 浓度可用于反映围手术期创伤程度大小[27]。IL-6 由单核细胞、巨噬细胞和内皮细胞分泌并激活,在手术创伤和应激刺激下,IL-6 浓度与创伤严重程度正相关[28]。本研究结果发现CRP 及IL-6 浓度在术前差异无统计学意义,而在术后24 h,ERAS 组CRP 及IL-6 浓度低于对照组,提示ERAS 可减少围手术期患者创伤,这与程康文[16]等人研究结果类似。
手术应激及炎症因子能抑制机体的免疫功能,同时手术应激可激活交感神经系统和下丘脑-垂体-肾上腺轴并诱导神经内分泌反应,促进应激激素,如儿茶酚胺、促肾上腺皮质激素的释放[29],同时严重的手术创伤及应激反应易导致切口感染、肺部感染、尿潴留和尿失禁等并发症的发生[30]。COR、ACTH 及EPI 是常见的应激反应标志物,ERAS 组COR、ACTH 及EPI 与对照组在术前差异无统计学意义,而在术后24 h,ERAS 组COR、ACTH及EPI 浓度低于对照组,这在分子水平上表明ERAS 可显著减少患者术后应激反应,使患者处于较温和的生理环境中,便于术后胃肠功能快速恢复。从两组术后并发症率比较来看,ERAS 组总术后并发症率也低于对照组,提示ERAS 可显著减轻患者术后应激程度,这也解释了ERAS 组患者术后下床时间、术后首次肛门排气时间、住院时间短于对照组,ERAS 组术后并发症率低于对照组的原因。
诚然,本研究在实施过程中积累了一定的经验,也存在一定的不足:首先,ERAS 强调术后早期拔除导尿管及腹腔引流管,对于术后恢复情况良好,无腹腔内出血、脓肿及尿储留等并发症的患者给予术后早起拔除导尿管及腹腔引流管。其次,但对于有排尿困难、前列腺增生的患者适当的给予延迟留置导尿管,并口服盐酸坦索罗辛胶囊治疗。对于伴吻合口漏、腹腔脓肿等并发症的患者,在经过对引流物及腹部CT 复查后,综合评估无异常后方给予拔除。最后,由于本研究是单中心研究,不可避免的存在一定的选择偏倚,值得更大规模的多中心研究。
综上所述,围手术期采用ERAS 理念行腹腔镜下胃癌根治术可降低手术创伤对机体细胞免疫的干扰,促进肿瘤正向免疫调控,抑制肿瘤负向免疫调控,减少术后并发症,减少机体应激反应及炎症因子释放,有助于患者快速康复。
