腹壁化疗港在胃癌腹膜转移NIPS化疗应用中的安全性分析
2021-11-09丁平安杨沛刚郭洪海田园郑涛刘洋张志栋王冬李勇赵群
丁平安,杨沛刚,郭洪海,田园,郑涛,刘洋,张志栋,王冬,李勇,赵群
(河北医科大学第四医院外三科,河北石家庄050011)
目前,胃癌是全球发病率排名第三、病死率排名第二的消化道恶性肿瘤之一[1-2]。我国大部分患者就诊时就已经处于中晚期,失去了最佳的手术机会[3-4]。而其中腹膜转移是进展期胃癌最常见的转移形式,一旦出现腹膜转移,难以通过手术切除,预后极差,中位生存时间仅为6~9 个月[5-6]。近年来,关于胃癌腹膜转移转化治疗方法一直处于不断探索中,传统的全身性化疗由于腹膜-血浆屏障的存在,药物无法充分作用于腹膜转移病灶,因而疗效甚微[7-8]。而腹腔化疗作为一种新型治疗方法,能够可以将化疗药物直接作用于腹腔,相关研究证实已取得较好的临床疗效[9-12]。由于腹壁化疗港具有可以重复多次给药进行腹腔化疗的优点,现广泛应用于临床中。然而,腹壁化疗港价格昂贵,同时置入操作需在全麻无菌条件下进行,一旦出现相关并发症,将会导致治疗的延误或终止,而引起疾病进展。为此,本研究通过回顾性分析我科收治的置入腹壁化疗港的病例,分析在进行腹腔化疗过程中存在的并发症及相应的防治措施,为并发症的预防与处理提供建议。
1 资料与方法
1.1 一般材料
收集河北医科大学第四医院外三科自2018年1月—2020年6月在全麻下进行腹腔化疗港留置术行辅助腹腔内联合全身性化疗(neoadjuvant intraperitoneal and systemic chemotherapy, NIPS) 患者的临床资料,病例纳入标准:⑴术前经胃镜咬检病理确诊为腺癌;⑵能够耐受腹腔镜探查术;⑶可获得完整的临床病理资料;⑷腹腔镜探查及腹腔脱落细胞学检测证实存在腹腔转移(P0CY1/P1CY1)。所有患者均签署知情同意书,本研究的设计与开展经过医院伦理委员会审批通过(审批号:2018086)。
1.2 方法
1.2.1 腹腔镜探查术探查在全麻下采用腹腔镜方式进行,患者体位为平卧位,以开放法在脐下建立观察孔,并另建立2 个操作孔。腹腔探查顺序[13-14]:左右膈下→肝脏、脾脏→腹腔壁层腹膜→盆腔→大网膜、小肠及系膜→横结肠系膜→胃。探查内容:有无腹水,腹盆腔腹膜、肠系膜、大网膜和Douglas 腔有无转移灶,肝表面有无转移,胃周淋巴结是否肿大,胃浆膜面有无浸润,胃壁是否僵硬。腹腔冲洗脱落细胞学检查:以500 mL灭菌生理盐水分别冲洗左右膈下、腹盆腔腹膜及肠系膜。取头高较低位于Douglas 腔、肝下及脾窝收集腹腔冲洗液,离心沉渣,细胞学检查有无脱落的肿瘤细胞。对于胃体后壁肿瘤,需要切开胃结肠韧带,探查小网膜囊,包括横结肠系膜和胰腺被膜,必要时以抓钳钳取可疑组织进行病理学检查。
1.2.2 腹壁化疗港留置术化疗港选取口径较大的腹腔专用港,包含1 枚基座、连接套环、穿刺装置及化疗管(15 F-420 mm)。港座放置区通常选取髂前上棘与脐连线中外1/3 位置,保证底座下方能够起到支撑作用。手术切口(长度通常取3~4 cm)选取在港座放置区的外侧行斜行切口,切开皮肤及皮下脂肪,分离脂肪层至筋膜层,充分止血,使化疗港距离表皮1.0~1.5 cm,另在切口内侧充分游离周围组织形成港腔,至能够完整放置腹壁化疗港。然后将穿刺杆沿盆腔方向穿刺形成隧道,沿隧道置入腹壁化疗管(一般取12~15 cm),后将港座与化疗管通过连接套环相连,在腹腔镜辅助下钳住化疗管的管头置入盆腔,同时在保证导管无折曲的前提下,使用不可吸收丝线将港座四周固定与筋膜层,依次关闭皮下脂肪、皮肤,最后试验港座及导管通畅性[15]。
1.2.3 化疗方案所有患者在置入腹壁化疗港后首选方案为NIPS 方案:每1 个化疗周期为21 d,在化疗第1 天和第8 天经腹壁化疗泵输注紫杉醇(腹腔注射20 mg/m2),同时静脉输注紫杉醇(静脉注射50 mg/m2);连续14 d 在早、晚餐30 min 后口服S-1 80 mg/(m2·d),停药7 d,每3 周为1 个周期,直到患者出现严重的化疗不良反应或疾病进展。S-1剂量根据体表面积(body surface area,BSA)而定:BSA<1.25 m2,80 mg/(m2·d);BSA 1.25~1.50 m2,100 mg/(m2·d);BSA>1.50 m2,120 mg/(m2·d)。
1.2.4 腹壁化疗港的使用⑴置入蝶翼针以建立输液通路,由1 名医护人员佩戴好帽子、口罩,同时穿戴无菌手套;⑵以港座为中心,由内向外10 cm处进行皮肤消毒后,以左手拇指、食指分别向下用力按压,至按及港座轮廓不移动,同时使港座有足够稳定的支撑,从而保证进针方向精准;⑶将蝶翼液针于化疗港区域中心垂直进针,直至进针困难,针尖遇到坚硬屏障(港座的底盘),使用无菌透明敷贴固定蝶翼针;⑷然后给予生理盐水100 mL 滴注,确认滴注无阻力及管道通畅性,同时观察针尖部有无液体外溢;⑸待确认液体顺利进入腹腔后再输注紫杉醇注射液,全部治疗结束后,最后给予生理盐水100 mL 滴入,垂直拔除针头,消毒并贴敷料。
1.2.5 临床资料收集收集患者的性别、年龄、术前NRS2002 评分、PG-SGA 评分、ECOG 评分、术前伴发病情况、BMI、PCI 评分、肿瘤分化程度、肿瘤位置以及Borrmann 分型等情况。所有患者治疗后均给予随访,随访时间截至2020年7月1日。随访工作主要通过电话、门诊复查、住院检查等方式进行。
1.3 统计学处理
数据利用SPSS 21.0 统计软件进行分析,计数资料采用例(%)[n(%)]表示,并发症相关因素分析采用χ2检验、Fisher 精确概率检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 临床病理特征
1 634 例患者进行了腹腔镜探查联合腹腔脱落细胞学检测,探查发现存在腹膜转移者(P1CY1)137 例(8.38%),腹腔脱落细胞学阳性者(P0CY1)189 例(11.57%),所有腹腔转移患者术中均置入腹壁化疗港。326 例患者中男性与女性患者分别为177 例(54.29%)及149 例(45.71%);中位年龄59 岁,其中年龄≤50 岁185 例(56.75%),>50 岁141 例(43.25%);286 例(87.73%) 的ECOG 评分为0 或1 分,余40 例(12.27%) 评分为2 分;28 例(8.59%) BMI<18.5 kg/m2,276 例(84.66%)BMI为18.5~23.9kg/m2,余22例(6.75%)BMI>23.9kg/m2;病灶部位位于贲门89 例(27.30%),胃体78 例(23.93%), 胃窦112 例(34.36%), 全胃47 例(14.42%);病灶≥5 cm 者231 例(70.86%),<5 cm者95 例(29.14%);Borrmann 分型为I~II 型133 例(40.80%),III~IV 型193 例(59.20%);PCI 评分中,0~10、 11~20、 21~30、 31~39 分分别为256 例(78.53%)、28 例(8.59%)、29 例(8.90%)及13 例(3.99%)。在留置方式上,所有患者均在在腹腔镜下完成的置管,化疗管管端均放在盆腔(表1)。
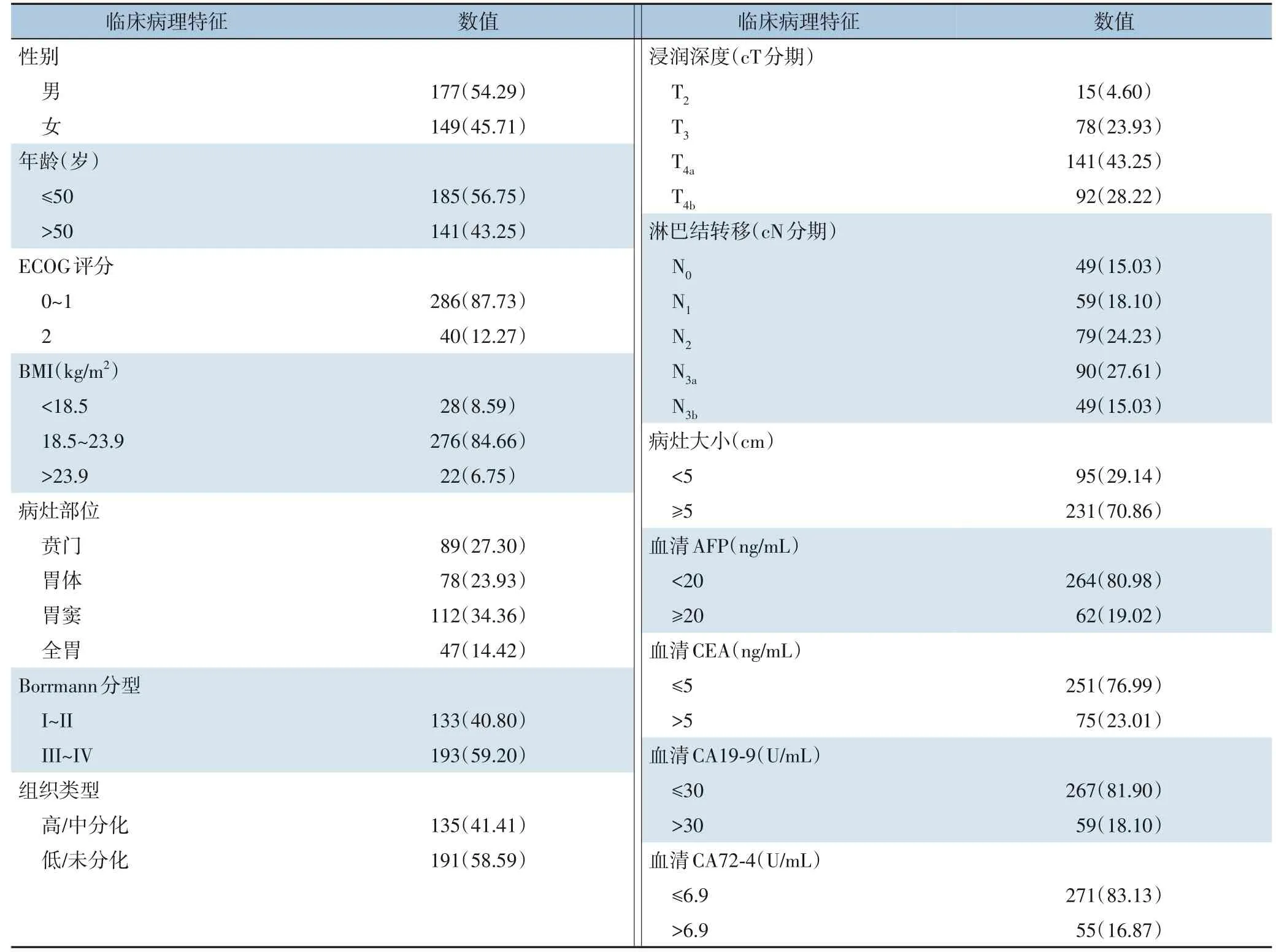
表1 326例置入腹腔化疗港患者的临床病理特征[n(%)]Table 1 Clinicopathologic features of 326 patients undergoing intraperitoneal chemotherapy port placement[n(%)]
2.2 并发症情况
326 例患者中腹壁化疗港的平均使用时间为11.6(0.9~26.3)个月。使用期间共出现57 个化疗港相关并发症,并发症总发生率为17.48%(表2)。其中以感染(5.21%)和导管折曲(2.15%)最为常见,其次是导管移位(1.84%)、港腔血肿(1.84%)、切口裂开(1.53%)、皮下硬结(1.23%)、导管阻塞(1.23%)、导管断裂(0.61%)、液体外渗(0.61%)、港座翻转(0.61%)、港腔种植转移(0.61%)(图1)。腹壁化疗港植入时间和出现并发症之间的中位间隔为4.4 个月(范围:0.3~13.4 个月),全组患者因化疗港相关并发症拔除港座7 例(2.15%),此7 例患者均终止腹腔化疗仅进行全身性静脉化疗,其中因囊腔内感染3 例,港座翻转1 例,导管断裂及折曲各1 例,液体外渗导致皮肤坏死1 例。其余患者发生并发症后均给予对症处理后,腹壁化疗港可继续使用,均未影响腹腔化疗的进行。
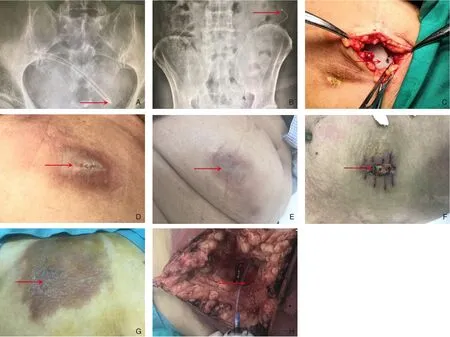
图1 腹壁化疗港术后及化疗期间相关并发症Figure 1 Related complications after intraperitoneal chemotherapy port operation and during chemotherapy
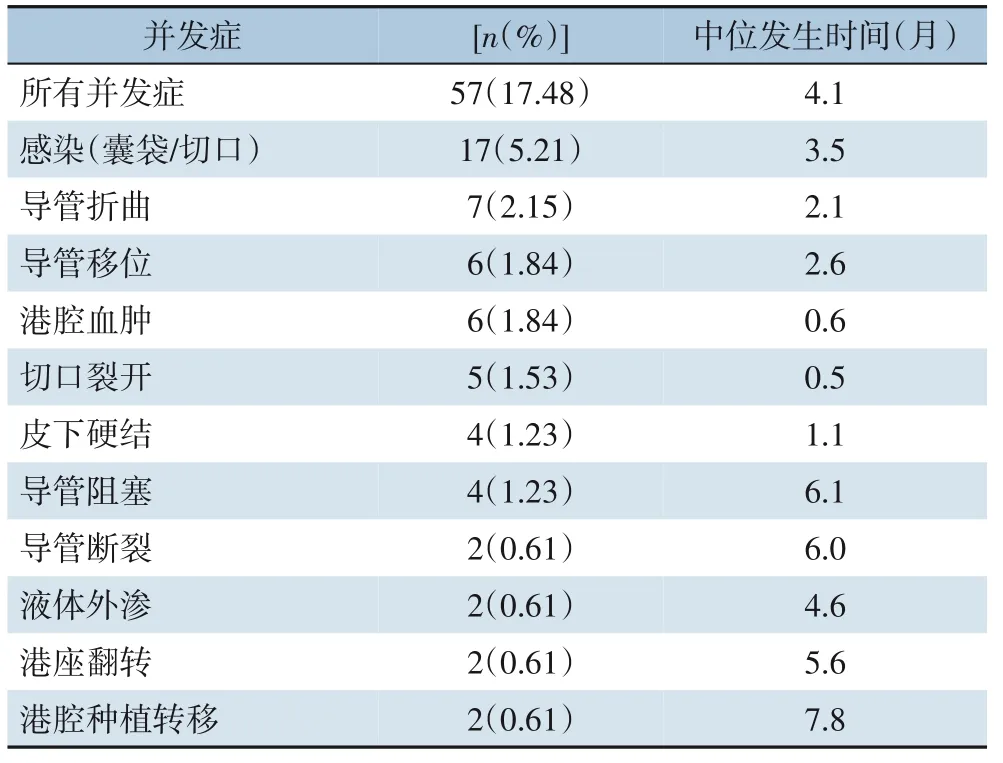
表2 腹壁化疗港相关并发症发生情况Table 2 Incidence of intraperitoneal chemotherapy port-re‐lated complications
2.3 危险因素分析
单因素分析发现,患者年龄、是否合并糖尿病、术者经验(是否完成30 例以上腹壁化疗港置入手术)、术前是否贫血及低蛋白血症均是影响近期并发症发生的相关因素(均P<0.05)(表3)。多因素分析显示,经验≤30 例的术者(OR=8.317,95%CI=2.023~11.883,P=0.008)是影响腹壁化疗港置入患者术后出现相关并发症的独立危险因素(表4)。
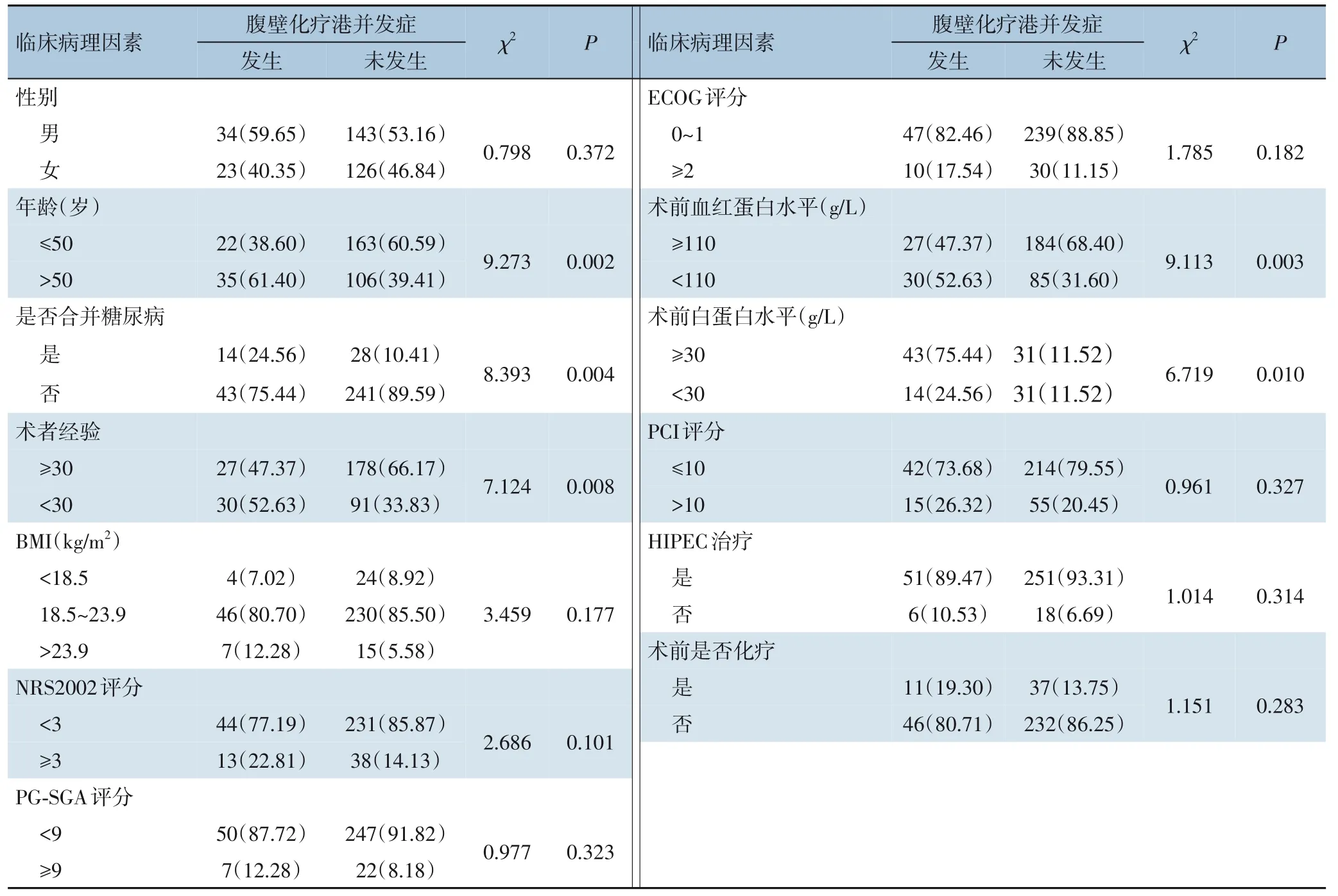
表3 影响腹壁化疗港相关并发症发生的单因素分析[n(%)]Table 3 Univariate analysis of complications related to intraperitoneal chemotherapy port[n(%)]
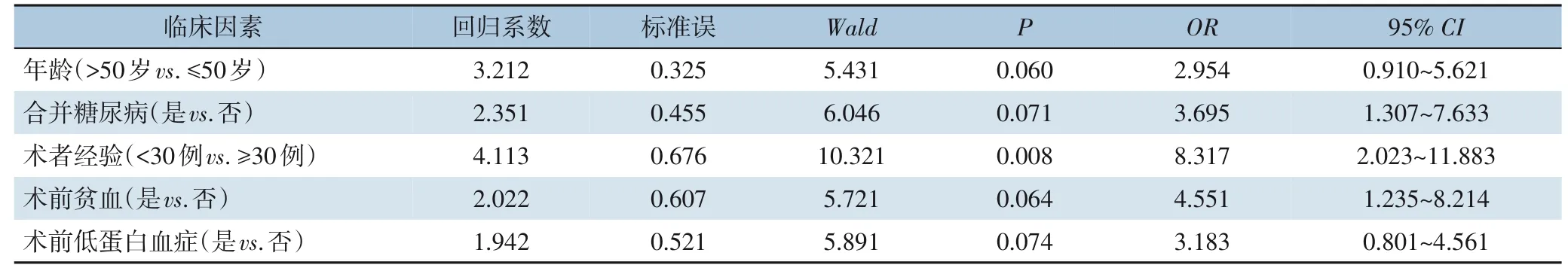
表4 影响腹壁化疗港相关并发症发生的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of complications related to intraperitoneal chemotherapy port
3 讨 论
近年来对胃癌腹膜转移的转化性治疗受到了高度关注,目前关于腹膜转移的治疗手段十分有限,系统的全身性化疗是目前主要的治疗选择,但疗效欠佳,主要是由于腹膜-血液屏障的存在,导致化疗药物无法对腹膜转移病灶产生持续有效的作用[16-18]。大量临床研究[19-23]表明,腹腔热灌注化 疗 (hyperthermic intraperitoneal chemotherapy,HIPEC)及NIPS 的效果较之传统单纯全身性化疗明显为优。但由于HIPEC 具有作用时间短、不易多次反复使用的缺点,导致临床实践中无法持续腹腔给药,然而皮下置入腹壁化疗港可以避免这一缺点,达到多次重复腹腔给药目的,从而为长时间腹腔化疗给药提供了便利性。NIPS 转化性治疗的不良反应除I、II 度血液学与消化系等全身性影响多见外,其特殊情况是腹壁化疗泵埋置所引起的并发症。国外学者Emoto 等[24]研究发现,131 例行腹壁化疗港的胃癌患者中,出现腹壁化疗港相关并发症的发生率为20.6%,主要包括导管阻塞(7.6%)与感染(6.9%),同时还有液体反流(3.1%)、切口或港腔周围出现皮下硬结(1.5%)等。本研究纳入了326 例行腹壁化疗港置入胃癌患者,主要的并发症感染(5.21%) 和导管折曲(2.15%)、导管移位(1.84%)、港腔血肿(1.84%)、切口裂开(1.53%)、皮下硬结(1.23%)、导管阻塞(1.23%)、导管断裂(0.61%)、液体外渗(0.61%)、港座翻转(0.61%)、港腔种植转移(0.61%)。
本研究中出现腹壁化疗港周围组织感染的发生率最高,主要包括切口感染及囊袋感染,主要原因可能在于:⑴患者自身免疫力低下或来自患者其他部位的感染;⑵穿刺部位皮肤菌群随蝶翼针穿刺浸入导管装置;⑶术中或术后切口换药过程中未严格执行无菌原则。Emoto 等[24]研究中将港座周围感染组织进行培养后发现,感染菌落主要来源于消化道及呼吸道,这提示在整个腹壁化疗港置入的围手术期间要充分做好无菌防护,可以预防性使用抗生素。化疗期间导致腹腔化疗终止的最主要原因是导管阻塞,我国学者李子禹团队[25]分析发现导管周围纤维鞘形成包裹导管将导致导管阻塞。本研究中共出现4 例导管阻塞,该组患者均给予溶栓处理后效果不佳,仅2 例患者导管再通继续使用,其余患者均拔除,最后证实为导管全周形成纤维蛋白鞘,导致导管侧孔完全阻塞,但管腔内没有发生阻塞,目前国内及国外相关研究尝试多种方法进行干预,但均效果不佳[26-27]。另外腹壁化疗港出现反流是一个严重的并发症,反流的化疗药物将会导致周围软组织,尤其是皮下组织坏死,同时反流的肿瘤细胞渗入到囊腔或导管周围形成种植转移。本研究出现严重的化疗药物反流外溢1 例,导致皮下脂肪大面积坏死,及时清创引流,摘除腹壁化疗港;另外出现囊腔内肿瘤种植转移1 例,也及时拔除港座,囊腔扩大切除。鉴于此问题,应常规对穿刺口进行加固缝扎,充分预防反流;同时操作过程还需注意无瘤操作,固定港座前应对囊腔反复冲洗,以减少肿瘤细胞种植。
由于我国部分患者的腹壁脂肪厚度较厚,尤其对于BMI>23.9 kg/m2、中老年女性,针对此类患者我们中心在最开始放置过程中,为了固定牢固,将港座固定于筋膜层。但由于腹壁脂肪厚度较厚,固定位置较深,置入蝶翼针时出现无法明确港座位置,进针无法探及港座底部,最后更换较长的蝶翼针才可探及。针对于此,本研究认为对于BMI>23.9 kg/m2、腹壁脂肪较厚的患者,术中可以适当去除囊腔内脂肪组织,保持将港座置入距离表皮1.0 cm 的位置,同时还得固定牢固;对于BMI<18 kg/m2、腹壁脂肪厚度较薄的患者,置入过程中则应保持港座距离表皮不能<0.5 cm。胃癌作为消化道恶性肿瘤,是一种长期慢性消耗性疾病,皮下脂肪呈现逐渐减少趋势,若距离<0.5 cm,则后续治疗期间可能出现港座摩擦表皮,最终表皮破损导致港座裸露外界继而出现囊腔内感染。既往国内相关学者[25]对相关并发症的危险因素进行分析,并未发现引起其发生的高危因素。同时国外研究[28-29]报道显示,在妇科肿瘤手术中腹壁化疗港相关并发症的出现仅与术中同时进行肠道手术相关,在其他相关临床特征方面也并未找到能够引起并发症的高危因素。而本研究中按照是否具备独立完成30 例以上腹壁化疗港置入手术经验,将所有术者分为两组,发现术者经验与术后并发症发生相关。进一步多因素分析显示,经验<30 例的术者是促进腹壁化疗港置入患者术后出现并发症的独立危险因素,这与杨中印等[30]研究一致。因此,但在减少相关并发症方面,医生自身的经验及熟练程度可能起着重要作用,由经验丰富的专科医师诊治,避免术中过度操作、减少手术时间及出血量是降低患者术后并发症的关键一步。另外术中的无菌及无瘤操作、术后的医护团队之间的配合、腹壁化疗港的术后维护也将会较少并发症的发生。
综上所述,腹腔化疗港在胃癌腹膜转移NIPS转化治疗中的应用是安全可行的,另外在降低相关并发症方面,医护团队之间的团结协作、术中的无菌及无瘤操作、术后规范细致的操作以及不断的经验总结将起到重要作用,从而可以保证腹腔化疗的顺利进行。
