系统免疫炎症指数与胃癌患者预后关系的Meta分析
2021-11-09周发权陈师孙红玉汤礼军
周发权,陈师,孙红玉,汤礼军
(1.川北医学院,四川南充637000;2.中国人民解放军西部战区总医院全军普通外科中心,四川成都610083;3.四川大学灾后重建与管理学院,四川成都610207)
胃癌是世界上最常见的恶性肿瘤之一,全球每年有超过100 万例被诊断为胃癌[1]。而我国是胃癌高发国家,病例数占全球50%[2]。虽然胃癌在诊断和治疗上取得了明显的进步,但由于早期症状不典型,并且术后转移和复发率高,导致胃癌患者的预后仍然较差[3]。而可靠的预后指标对掌握患者的病情,制定有效的临床治疗策略非常重要。近年来已经发现了很多的预后指标,然而由于技术条件复杂、高成本等因素使得这些预后指标并不适用于临床[4-5]。
炎症和免疫系统参与了恶性肿瘤的发生和发展[6],反映人体免疫炎症状态的参数可能是癌症患者预后的指标。系统性免疫炎症指数(systemic immune-inflammation index,SII)是一种新的炎症生物标志物,可从血常规检查中获得,定义为血小板计数×中性粒细胞计数/淋巴细胞计数[7]。目前,已有大量研究报道了SII 与胃癌预后的相关性,但各研究的结论尚不一致。例如Chen 等[7-9]发现较高水平SII 与胃癌患者治疗后总体生存期(overall survival,OS) 和无病生存期(disease-free survival,DFS)缩短相关。然而,Liu 等[10-11]的研究并没有发现SII 与胃癌患者预后存在相关性。此外,虽Qiu等[12]已对治疗前SII 与胃癌患者预后关系进行了Meta 分析,但该研究存在纳入研究不全面等局限性。因此,本研究采用Meta 分析方法,客观、系统的探讨治疗前SII 水平对胃癌患者的预后意义,以及SII 与胃癌患者临床病理特征的关系。以获得循证医学证据为临床决策提供依据。
1 资料与方法
1.1 检索策略
计算机检索 PubMed、 EMBASE、 Web of Science、Cochrane Library 数据库,收集从建库到2020年7月28日公开发表的有关SII 与胃癌预后关系的队列研究。检索采用主题词与自由词相结合的方式进行。并且,追溯已纳入文献的参考文献,以获取相关文献。检索词包括:Gastric Cancer、Stomach Cancer、 Cardia Cancer、 Gastric Neoplasm、Stomach Neoplasm、Cardia Neoplasm、Gastric Tumor、Gastric Carcinoma、 Stomach Tumor、 Stomach Carcinoma、 Cardia Carcinoma、 Cardia Tumor、Systemic Immune-Inflammation Index、SII。本研究已在PROSPERO 中预先进行了注册(注册号:CRD42020197213)。
1.2 纳入与排除标准
1.2.1 纳入标准⑴研究类型:队列研究;⑵研究对象:已发表探讨SII 与胃癌患者预后关系的研究,且经病理诊断为胃癌的患者;⑶结局指标:报告治疗前SII 水平多因素生存分析的风险比(hazard ratio,HR) 和相应的95% 可信区间(confidence interval,CI),包括OS、DFS、无复发生存期(recurrence-free survival,RFS)。
1.2.2 排除标准⑴文章类型为综述、系统评价、会议论文;⑵无法获得该文献的全文;⑶数据不足;⑷重复发表文献;⑸非英文文献。
1.3 文献筛选和资料提取
由2 名研究者独立筛选文献、提取资料并交叉核对,通过双方讨论或与第三位研究者协商解决争议。文献筛选时首先阅读题目及摘要,在排除明显不相关的文献后,进一步阅读全文确定是否纳入。如有需要,通过邮件、电话联系原始研究作者获取未确定但对本研究的重要信息。资料提取内容包括:研究题目、第一作者、出版年份、研究时间、国家、样本量、性别、治疗方式、随访时间、SII 临界值、所关注的结局指标和结果测量数据。
1.4 纳入研究质量评价
由两名研究人员根据纽卡斯尔-渥太华量表(Newcastle-Ottawa quality scale,NOS)独立对纳入研究进行偏倚风险评价,得分为6 分或更高的研究被定义为高质量研究[13]。
1.5 统计学处理
采用Stata 12.0 软件进行分析数据。通过HR及其95%CI评价SII 与胃癌患者预后的关系。分别探究SII 与OS、DFS/RFS 的关系。为进一步探究SII 对胃癌患者预后的影响,对SII 临界值、国家、治疗方式、研究时间进行亚组分析。通过I2统计量和q检验判断纳入文献异质性。当P<0.1 和/或I2>50%,异质性显著,采用随机效应模型进行Meta 分析;反之,采用固定效应模型进行Meta 分析[14]。采用Begg 检验和Egger 检验对潜在发表偏倚进行检验(检验水准α=0.05)[15]。
2 结 果
2.1 文献筛选流程及结果
初检共获取相关文献252 篇,剔重后获得文献201 篇,排除不符合纳入标准的文献173 篇,初步纳入28 篇相关文献,进一步阅读全文排除文献16 篇,最终纳入12 项回顾性队列研究(图1)。
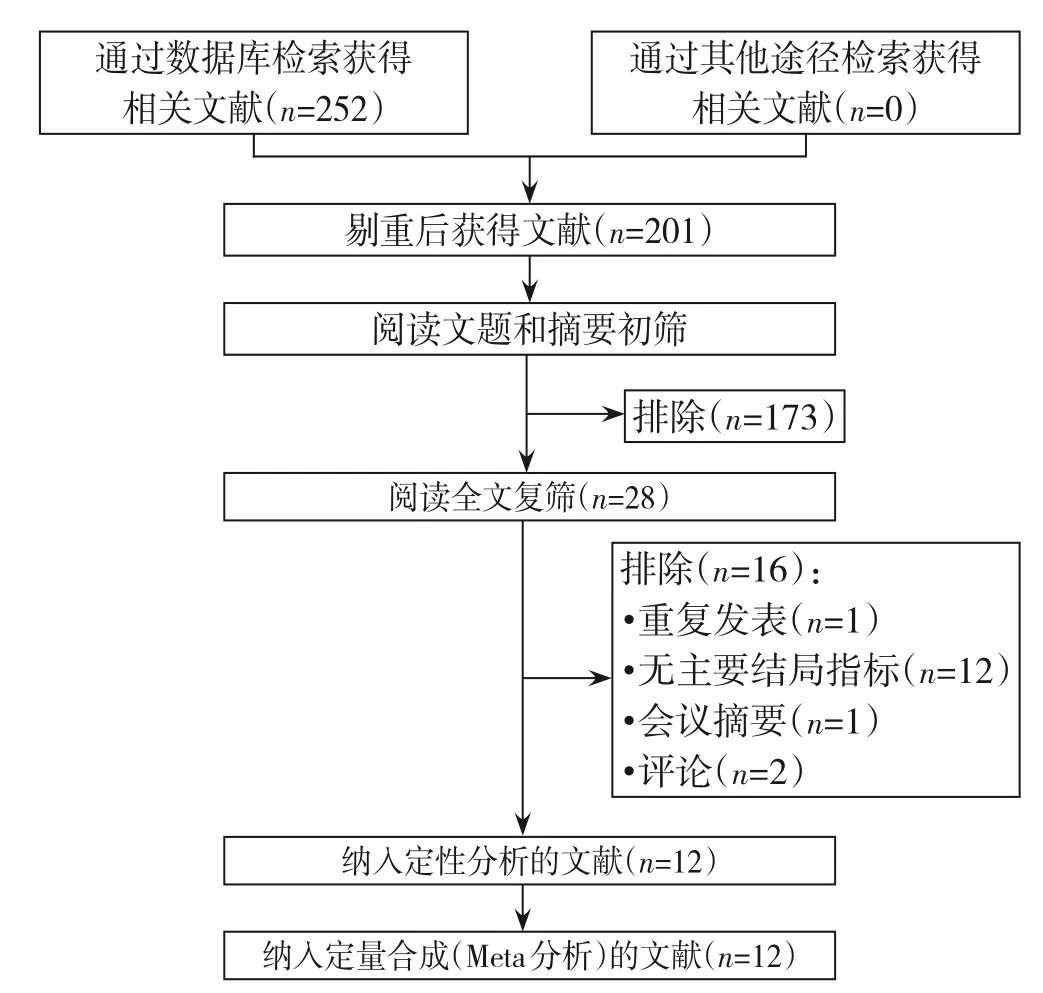
图1 文献筛选流程及结果Figure 1 Literature screening process and results
2.2 纳入研究的基本特征
共纳入12 项回顾性队列研究[7-11,16-22],包括7 244 例患者。纳入研究发表于2015—2020年,其中10 项[7-11,16-18,21-22]在中国进行,另外2 项研究[19-20]分别在日本和土耳其进行。11 项研究[7-11,16,18-22]报道了SII 与OS 之间的关系,有4 项研究[7,17-18,20]报道了SII 与DFS/RFS 的关系。SII 临界值在330~802 不等。纳入研究NOS 得分均在6 分以上,提示纳入研究质量较高(表1)。
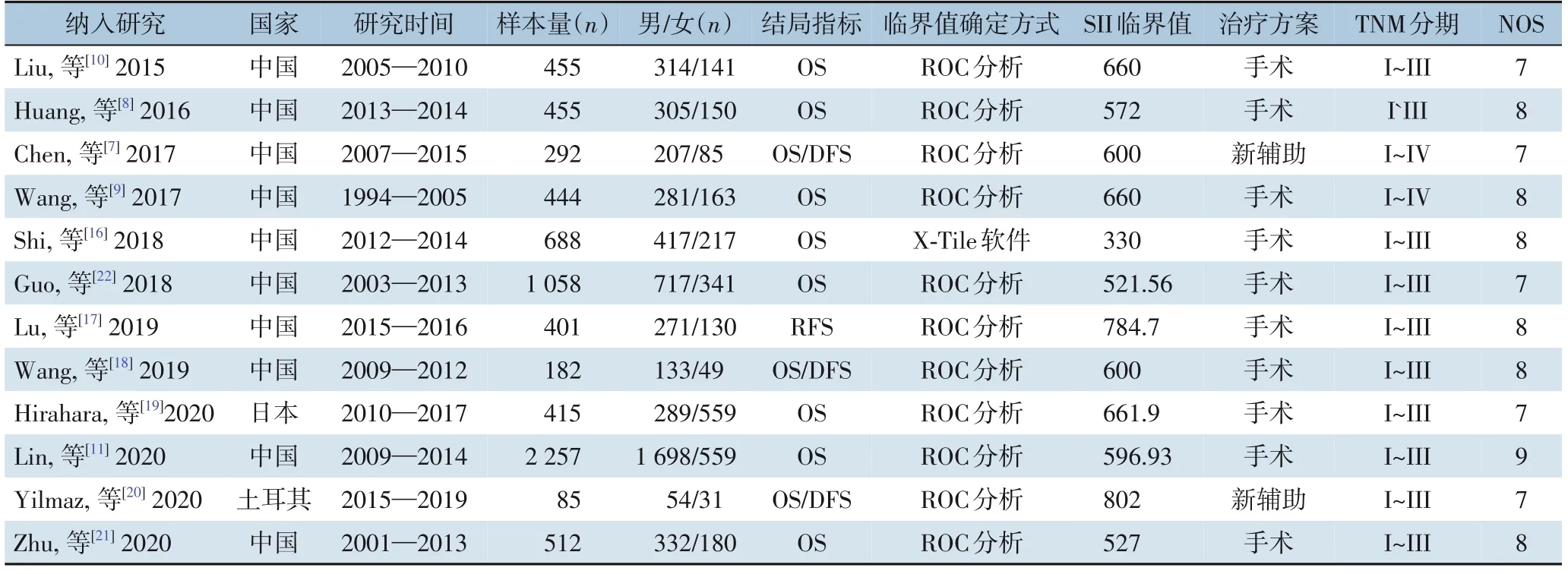
表1 纳入研究的基本特征Table 1 General characteristics of the included studies
2.3 Meta分析结果
2.3.1 SII 与OS 的关系11 项研究[7-11,16,18-22]报道了SII 与OS 之间的关系,研究间存在明显异质性(I2=78.6%,P=0.000),故采用随机效应模型。Meta分析结果表明,SII 较高的患者OS 明显缩短(HR=1.40,95%CI=1.12~1.76,P=0.003)(图2)。
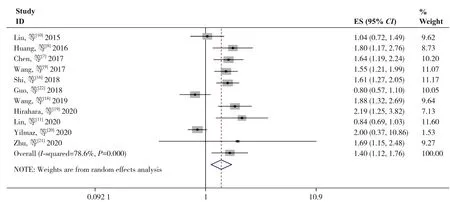
图2 SII与OS关系的Meta分析Figure 2 Meta-analysis of relationship between SII and OS
2.3.2 SII 与DFS/RFS 的关系4 项研究[7,17,18,20]报道了SII 与DFS/RFS 的关系,研究间无明显异质性(I2=0.0%,P=0.867), 故采用固定效应模型。Meta 分析结果表明,SII 较高的患者DFS/RFS 明显缩短(HR=1.52,95%CI=1.23~1.89,P<0.001)(图3)。
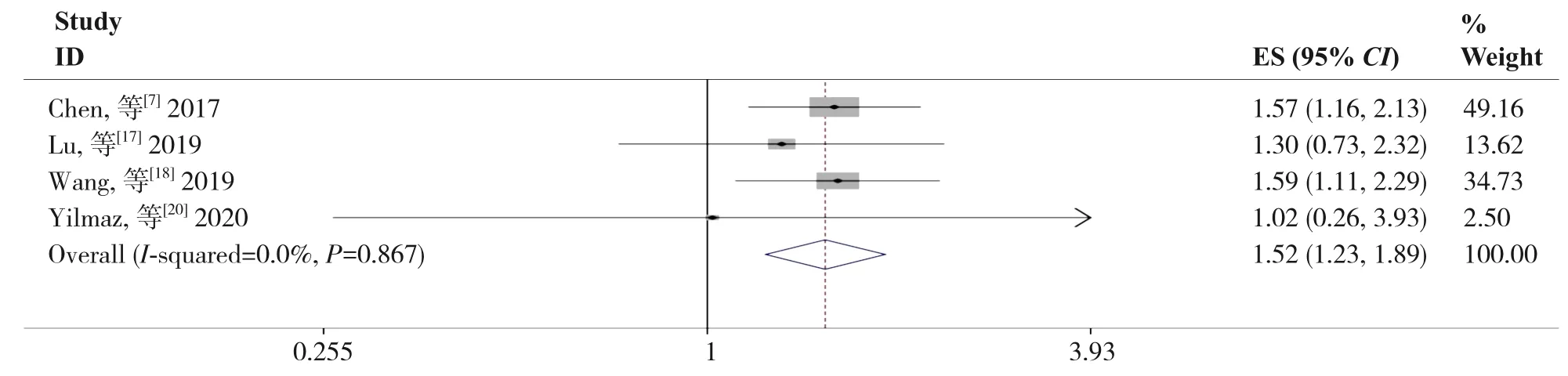
图3 SII与DFS/RFS关系的Meta分析Figure 3 Meta-analysis of relationship between SII and DFS/RFS
2.3.3 亚组分析为了进一步探讨SII 对于胃癌患者的预后价值,本研究从SII 临界值、样本量、国家、治疗方式和研究时间等方面进行亚组分析。亚组分析发现,当SII≥临界值600 时,较高水平SII与OS 缩短有关;但SII<临界值600 时,SII 与OS 无明显关系。研究时间较长时,较高水平SII 与OS 缩短有关;研究时间较短时,SII 与OS 无明显关系。根据样本量、国家、治疗方式进行亚组分析,结果显示较高水平SII 都与OS 缩短有关(均P<0.05)(表2)。
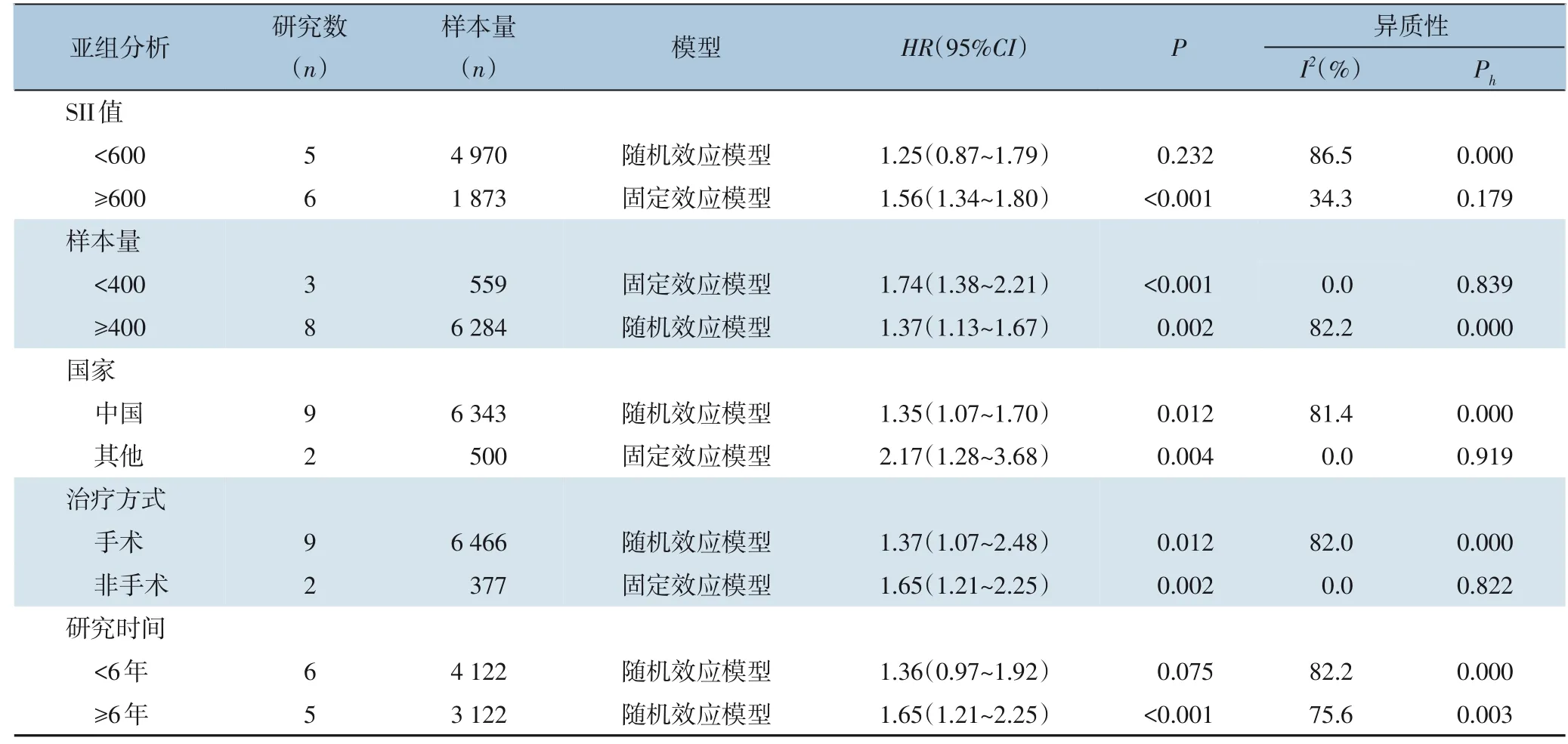
表2 胃癌患者SII与OS关系的亚组分析Table 2 Subgroup analysis of relationship between SII and OS
2.4 SII与胃癌患者临床病理特征的关系
为了探讨SII 与胃癌患者临床病理特征的关系,根据性别、年龄、TNM 分期、淋巴结转移、肿瘤大小、肿瘤分化程度等因素进行分析。如表3所示,与低SII 组相比,高SII 组TNM 分期更晚(OR=2.45,95%CI=1.75~3.44,P<0.001),有更高的淋巴结转移风险(OR=1.72,95%CI=1.27~2.32,P<0.001),肿瘤更大(OR=2.45,95%CI=1.75~3.44,P<0.001),分化程度更差(OR=2.45,95%CI=1.75~3.44,P<0.001)。而SII 升高与性别、年龄无关(均P>0.05)。
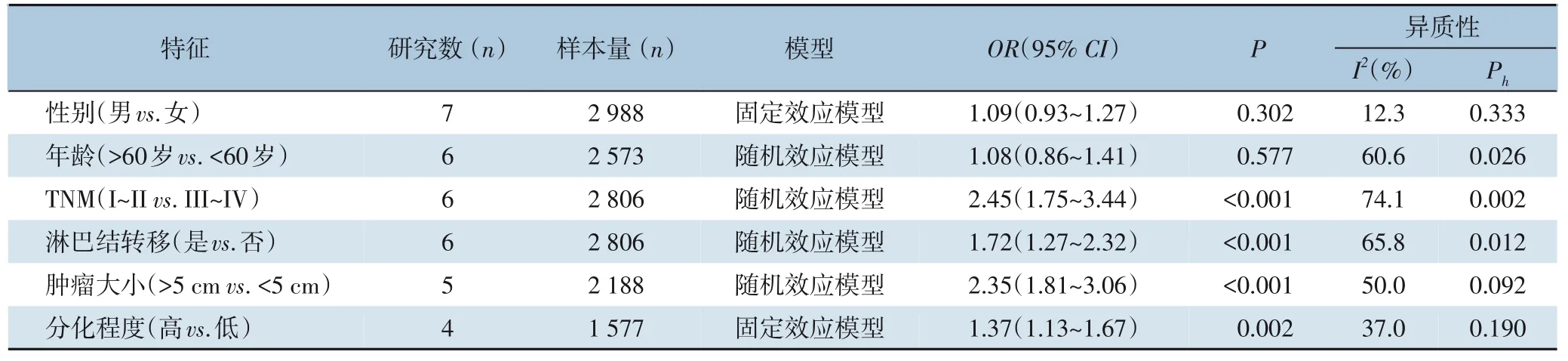
表3 SII与胃癌患者临床病理特征的关系Table 3 Rrelations of SII with clinicopathologic characteristics in patients with gastric cancer
2.5 敏感度分析
通过逐一剔除单项研究进行敏感度分析,结果显示SII 与OS 关系的Meta 分析结果稳定(HR=1.24~1.39)(图4),SII 与DFS/RFS 关系的Meta 分析结果稳定(HR=1.24~1.39)(图5)。
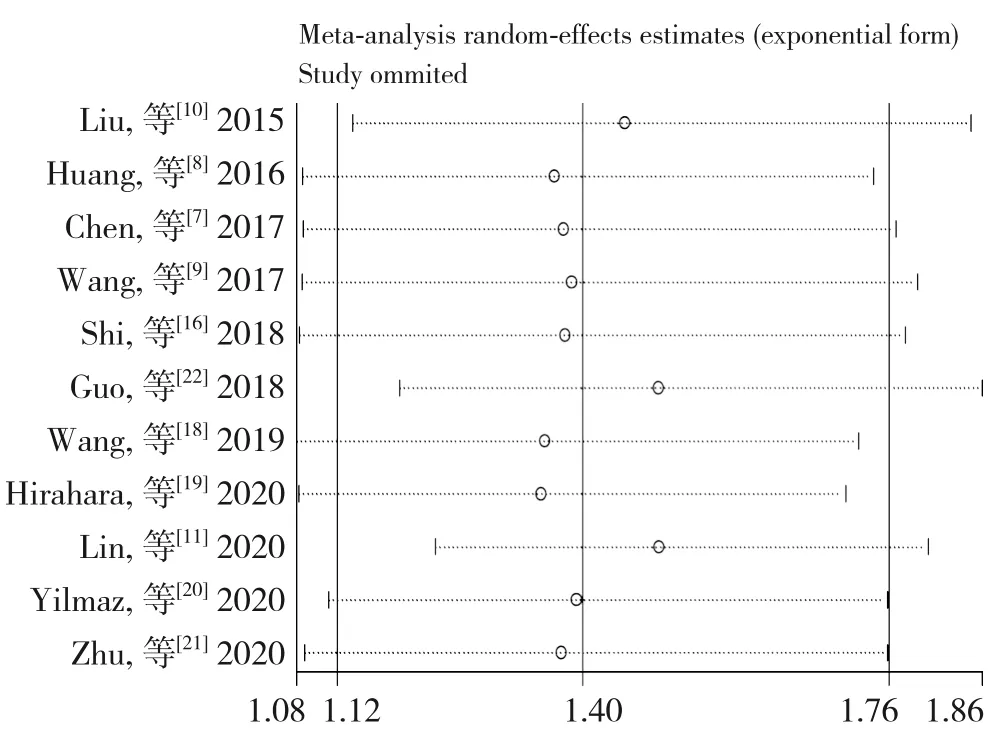
图4 SII与OS关系的敏感性分析Figure 4 Sensitivity analysis of relationship between SII and OS
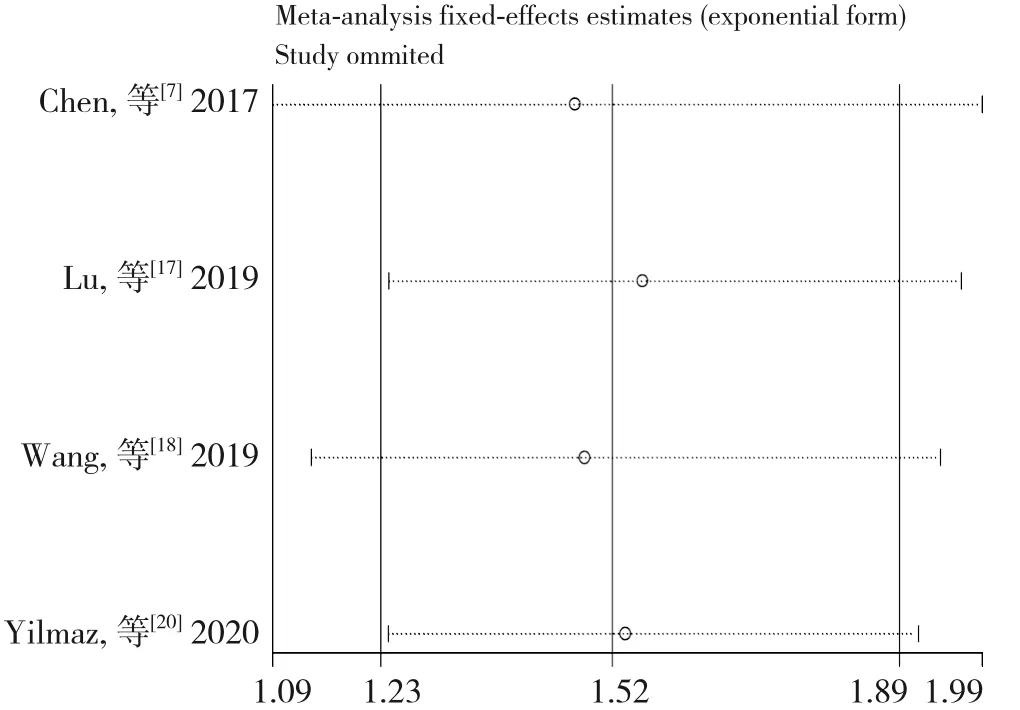
图5 SII与DFS/RFS关系的敏感性分析Figure 5 Sensitivity analysis of relationship between SII and DFS/RFS
2.6 发表偏倚
通过Begg 检验和Egger 检验评估SII 与OS 关系的发表偏倚,Begg 检验(Z=0.31,P=0.755)、Egger检验(t=1.30,P=0.227);SII 与DFS/RFS 关系的发表偏倚,Begg 检验(Z=1.70,P=0.089)、Egger 检验(t=3.82,P=0.062)结果表明,纳入文献存在发表偏倚的可能性较小(图6)。
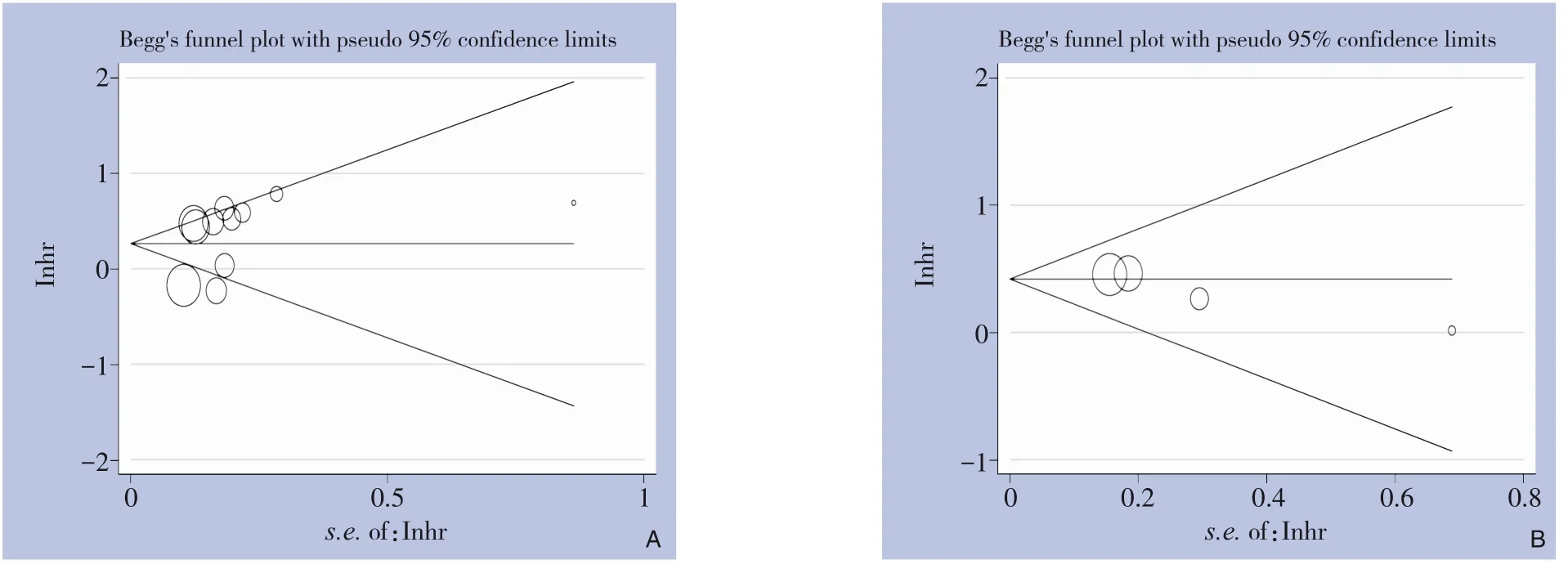
图6 Begg检验Figure 6 Begg's test
3 讨 论
SII 作为一种新的预后指标,反映癌症患者免疫系统的整体状态。由于其检测经济、快捷、有效,SII 与癌症患者预后关系成为研究热点。在对SII 与胃癌患者预后关系的研究中,已有治疗前SII与胃癌患者预后关系已有Meta 分析[12],但该研究存在一定局限性,具体表现在:首先,从纳入原始研究数量上而言,其并未纳入Liu 等[10]在2015年和Lu 等[17]在2019年发表的研究,并且检索时间只到2019年12月,关于SII 与癌症患者预后关系近几年又有了新的原始研究,如Lin 等[11]在2020年发表的研究并未发现SII 与胃癌患者预后存在相关性,可为该领域提供新的证据。此外,为了更加科学地探讨SII 水平在胃癌患者中的预后价值,本研究只纳入了报道多变量分析的原始研究。因此,本研究是对Qiu 等[12]研究的继承与发展,并对研究设计进行了改进、全面纳入相关原始研究,以期提高SII 与胃癌患者预后关系的研究结论的可靠性与科学性。
本研究共纳入12 项回顾性队列研究,包括7 244 例患者,探讨了SII 在胃癌预后中的作用。Meta 分析结果表明,较高水平SII 与胃癌患者OS、DFS/RFS 缩短存在相关性。肿瘤微环境近年来受到越来越多的关注,而炎症细胞是肿瘤微环境的重要组成部分[23-24]。许多证据表明,炎症反应是许多癌症的发生、发展和预后的重要因素,如幽门螺杆菌感染相关胃癌的特点是炎性浸润,主要是中性粒细胞和T 细胞[25-27]。此外,循环淋巴细胞可反映患者的炎症状态[28]。SII 是以外周血淋巴细胞、中性粒细胞和血小板计数为基础。中性粒细胞可以激活内皮细胞和实质细胞,从而促进循环肿瘤细胞的转移[29]。中性粒细胞也通过分泌炎症介质来介导癌细胞的增殖和转移[30]。血小板可以释放多种促进癌细胞增殖的生长因子[31]。此外,血小板还可以保护循环肿瘤细胞免受抗肿瘤免疫反应的影响,从而促进肿瘤细胞的血管生成和转移[32]。淋巴细胞在机体对恶性肿瘤的免疫应答中起着重要的作用,可抑制肿瘤细胞增殖和迁移[33]。因此,SII 升高可以反应胃癌患者的炎症免疫状态,可能是胃癌患者预后的指标。SII 可通过血常规检测且成本低,可以帮助临床医生更好地预测患者预后,更容易制定合理的系统治疗策略。
此外,亚组分析发现,当SII 的临界值>600 时,SII 较高与OS 缩短相关,而当SII 的临界值<600 时,SII 与OS 无明显关系。这与笔者之前对胰腺癌进行研究的结果类似[34]。根据研究时间分组发现,研究时间较长时,较高水平SII 与OS 缩短有关;研究时间较短时,SII 与OS 无明显关系。可能是由于研究时间较短造成随访时间较短未能揭示其真实结果,这提示,未来原始研究应注意设置更合理的研究时间以更加科学地探讨SII 与癌症患者预后关系。根据样本量、国家、治疗方式进行亚组分析,结果显示较高水平SII 都与OS 缩短相关。遗憾的是在进行亚组分析后,仍未能探究所有的异质性,在SII 临界值>600、样本量>400、在中国的研究、手术治疗及研究时间的分组中的异质性仍较高。此外,本研究还探究了SII 与胃癌的临床病理特征的关系,较高水平SII 与TNM 分期更高、淋巴结转移、肿瘤大小(>5 cm)、肿瘤程度更差有关。这些与恶性肿瘤进展相关的临床参数与SII 存在相关性,进一步表明较高水平SII 可能是胃癌进展和肿瘤复发可能性的一个潜在指标。
本研究也存在一定的局限性。首先,这些纳入的文章中存在一些异质性,本研究采用了亚组分析等方法,但仍未能探究所有的异质性;其次,本研究纳入文章均为回顾性研究,需更多前瞻性研究予以证实。第三,大多数研究来自中国,SII对其他国家患者的预后价值还有待验证。第四,目前SII 临界值尚未统一,存在偏倚。
综上所述,SII 可以作为胃癌的预后指标。但由于纳入研究的数量和质量的限制,上述结论还需要更多高质量的研究来进一步验证。
