脆弱拟杆菌Pif1解旋酶的表达纯化与晶体生长
2021-11-06曹汝菲李泽轩许欢张莎张敏敏戴枫段晓雷
曹汝菲 李泽轩 许欢 张莎 张敏敏 戴枫 段晓雷,3
(1. 遵义医科大学生物化学教研室,遵义 563000;2. 遵义医科大学检验医学院,遵义 563000;3. 西北农林科技大学生命科学学院,杨凌712100)
脆弱拟杆菌(Bacteroides fragilis)是人类和动物肠道内厌氧菌群中的优势菌,对于维护宿主正常生理机能至关重要[1]。当下消化道的某一部位受损或预先有病理改变时,脆弱拟杆菌会转变为机会致病菌[2]。脆弱拟杆菌在转化为机会致病菌时,多项解旋酶基因的表达量会发生改变,表明相关解旋酶很可能参与了机会致病过程的应激变化[3-4]。此外,不同于其他种的拟杆菌,脆弱拟杆菌机会致病菌的全基因组中G+C含量明显偏高,而且特异GC结构相对丰富而稳定[4],这一特征恰恰符合在氧化应激条件下G4 DNA结构易在调控区域形成的特点。这些DNA水平的异常变化,提示出特异调控G4 DNA异常形成的解旋酶很可能在脆弱拟杆菌转变为机会致病菌过程中扮演重要角色。最新的研究表明,脆弱拟杆菌转变成为机会致病菌的多种解旋酶(包括Pif1解旋酶)在基因组和转录组水平都发生了表达差异[5-6],这些变化表明B.f Pif1解旋酶很可能在其机会致病过程中发挥着重要的调控作用。
B.f Pif1解旋酶属于Pif1解旋酶家族成员;该蛋白家族是一类特异性解旋G4 DNA以及G-rich序列的高度保守的DNA解旋酶,其对于细胞内基因组稳定性的维持至关重要[7-8];前人的研究已明确证实脆弱拟杆菌属中存在此类解旋酶(B.f Pif1)[9]。近年来的大量研究表明,不同物种的解旋酶具有特异的生物学活性。例如,小鼠mPif1解旋酶失活可引起相关线粒体肌病[10]、酿酒酵母Sc.Pif1解旋dsDNA活性由于结合G4 DNA而显著增强[11]、白色念球菌Ca.Pif1解旋酶具有特异性3'-5'核酸外切酶活性等[12],而这些功能差异性往往是由于其结构差异性造成的。因此,科学界也开始积极关注许多物种Pif1解旋酶结构的研究:Bs.Pif1与ssDNA复合物晶体成为首个Pif1蛋白成员的蛋白结构被解析[13],研究最广泛的Sc.Pif1解旋酶的共结晶报道为其分子机制的研究开启新篇章[14],而人类hPif1解旋酶更是“十年磨一剑”终于在2019年得以发表其晶体结构信息[15]。但是,迄今为止,有关B.f Pif1解旋酶的蛋白结构与功能的研究仍处于空白阶段。
本研究通过对B.f Pif1解旋酶进行原核表达与纯化,获得高纯度、高浓度的B.f Pif1蛋白;再利用多种结晶试剂盒进行结晶筛选及晶体生长条件优化,并进行该蛋白晶体的初步X射线衍射,为下一步的晶体衍射优化、B.f Pif1蛋白结构解析及功能研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、引物与质粒 Bacteroides fragilis菌株购自于ATCC;前期同源序列比对与预试验中可溶性分析等明确B.f Pif1解旋酶的全长序列(NCBI Sequence ID:WP_005787496.1,833Aa)中 的21-402 aa为解旋酶核心结构域,可进行晶体结构研究,目的基因B.f Pif1核心结构域上游引物:5'-GGAATT CCATATGCTTTTTCTGACAGGAAAGGCC-3',下游引物:5'-CCGCTCGAGCTTACAACGACTCAGAGCGAC AT-3',由上海生工生物工程有限公司合成。大肠杆菌DH5α菌株、表达载体pET15b-SUMO,以及E.coli BL21(DE3)菌株均购自大连宝生物公司。
1.1.2 试剂 SUMO蛋白酶由遵义医科大学检验医学院段晓雷课题组自行制备。RNA提取与逆转录试剂盒均购自天根生化科技(北京)有限公司。高保 真DNA聚 合 酶PrimerSTAR、T4 DNA连 接 酶、Nde I、BamH I、Xho I等限制性内切酶均购自大连宝生工生物工程有限公司。镍-亲和层析柱(Ni-NTA)、Superdex 200(S200)凝胶过滤层析柱、DEAE阴离子交换柱、PD MiniTrap G-25预装脱盐柱以及超滤离心管均购自美国GE公司。质粒抽提试剂盒和琼脂糖凝胶DNA回收试剂盒购自康为公司。Salt RxTMI、IndexTM、Cystal screen I和Cystal screen II、PEG I和PEG II结晶筛选试剂盒购自美国Hampton Research公司。
1.2 方法
1.2.1 B.f Pif1解旋酶的原核表达载体构建 提取脆弱拟杆菌总RNA,并反转录获得cDNA,以其为模板,使用靶标基因特异性引物,参照PrimerSTAR标准体系进行PCR扩增,反应程序为98℃ 10 s,58.5℃ 15 s,72℃ 1 min 15 s(34 cycles)。PCR产物经Nde I/EcoRI双酶切,由T4酶连接后构成pET15b-SUMO-B.f Pif1重组表达载体,转入DH5α,涂布于LB/Amp(100 μg/mL)平板,筛选阳性克隆菌株,挑取阳性菌株扩大培养并提取质粒,再进行双酶切鉴定;同时将重组质粒送至生工生物工程(上海)有限公司进行测序鉴定。
1.2.2 B.f Pif1重组蛋白的诱导表达 将鉴定成功的pET15b-SUMO-B.f Pif1重组质粒转入表达菌株E.coli BL21(DE3)感受态细胞,涂布于LB/Amp(50 μg/mL)平板,挑取单克隆菌株再接种至5 mL LB/Amp(50 μg/mL)液体培养基进行活化;按1∶1 000比例转接至3 L液体LB培养基内,以37℃ 200 r/min培养至菌液OD600为0.5左右,按1∶1 000比例加入不同浓度的IPTG(0.1、0.3、0.5与0.8 mmol/L)进行诱导,并在不同诱导温度(37℃诱导表达4 h、28℃诱导表达8 h、18℃诱导表达16 h)下诱导目的蛋白(B.f Pif1)的表达。
1.2.4 SUMO酶切与第二次Ni-NTA亲和层析 将第一次Ni-NTA纯化产物进行SUMO蛋白酶酶切,按SUMO酶与待纯化蛋白1∶100的质量比加入,4℃透析过夜。次日,将酶切与透析后的蛋白溶液再次流经镍柱纯化,并用镍柱洗脱液洗脱带His-Tag的杂蛋白和SUMO酶,并收集Ni-NTA流出液及平衡液进行10% SDS-PAGE检测。
1.2.5 DEAE阴离子交换柱层析 将上一步纯化产物(蛋白溶液)快速(15 mL/min)流经脱盐预装柱,以置换buffer为离子交换柱平衡缓冲液(20 mmol/L Tris-HCl pH 7.2、100 mmol/L NaCl、2 mmol/L DTT、1 mmol/L EDTA和10%甘油)。将脱盐后蛋白溶液上样至预平衡的DEAE阴离子交换柱内,以1.5 mL/min流速、按NaCl浓度线性梯度(l00-1 000 mmol/L)进行蛋白洗脱——利用AKTA prime plus色谱系统监测离子交换层析中的蛋白吸收峰变化,分部收集洗脱峰对应的蛋白溶液,并进行SDS-PAGE检测。
1.2.6 Supdex 200凝胶过滤层析(分子筛) 预先用分子筛平衡缓冲液(20 mmol/L Tris pH 7.5、300 mmol/L NaCl、2 mmol/L DTT和1 mmol/L EDTA)平衡S200分子筛,随后依据分子量大小分离纯化蛋白:将蛋白样品浓缩到1 mL上样,用一个柱体积(约130 mL)的分子筛平衡缓冲液洗脱(流速为0.5 mL/min,压强上限0.4 MPa),并结合紫外吸收峰收集目的蛋白。最后用SDS-PAGE相关的灰度分析法检测蛋白纯度,并用Bradford法测定蛋白浓度。
1.2.7 验证纯化蛋白的活性 B.f Pif1重组蛋白的最终纯化产物需超滤浓缩后,加入20%终浓度甘油,液氮速冻后置于-80℃保存备用。利用Stopped-flow设备对纯化好的B.f Pif1蛋白进行解旋酶活性与解旋极性检测[16-17],以验证B.f Pif1解旋酶活性。
1.2.8 B.f Pif1蛋白结晶初筛与晶体生长条件优化
采用Salt RxTMI、IndexTM、Cystal screen I和Cystal screen II、PEG I和PEG II等多种结晶初筛试剂盒对低温高速离心后的B.f Pif1蛋白进行晶体初步筛选;初筛条件是:晶体生长池中含1 μL上述结晶筛选试剂盒中的成分液与1 μL B.f Pif1蛋白,平衡池则为98 μL试剂,结晶机器人反应室内温度设定为4℃和20℃。该机器人主要利用棋盘法原理进行条件优化,主要包括蛋白质浓度、pH缓冲液、沉淀剂/添加剂种类、浓度及组合等。
1.2.9 B.f Pif1蛋白晶体的初步X射线衍射 对初筛优化后状态良好若干B.f Pif1蛋白晶体进行持续培养:此时晶体生长采用座滴气相扩散法;再将逐步分散培养的晶体置于16℃晶体培养箱,每天于显微镜下观察记录晶体生长状况。待培养2周左右,挑取靶标蛋白晶体,放置于MAR 345DTB X-ray衍射仪的衍射套环上,进行X射线衍射并收集衍射数据,并将衍射后的蛋白晶体经SDS-PAGE检测再次明确其为B.f Pif1蛋白。初步X-ray衍射数据较好的蛋白晶体采用液氮保存,后续送上海光源同步辐射进一步研究。
2 结果
2.1 目的基因的扩增及原核表达载体的构建
根据表达载体pET15b-SUMO-B.f Pif1示意图(图1-A)进行载体构建,并通过菌落PCR与重组质粒EcoRⅠ/XhoⅠ双酶切进行鉴定,结果(图1-B)显示,PCR与酶切产物大小均约为1 200 bp,与靶标基因序列(1 146 bp+酶切位点与保护碱基)预期相符。此外,重组质粒测序结果与B.f Pif1解旋酶的靶标序列完全一致,表明表达载体构建成功。
“风雨说”以黄进为首提出的,他们认为广东丹霞地貌及北国山山顶的上凹坑形成主要是由风化、雨水的滴蚀、溶蚀作用下产生的,称之为“风化、雨滴溶蚀说”,简称“风雨说”。
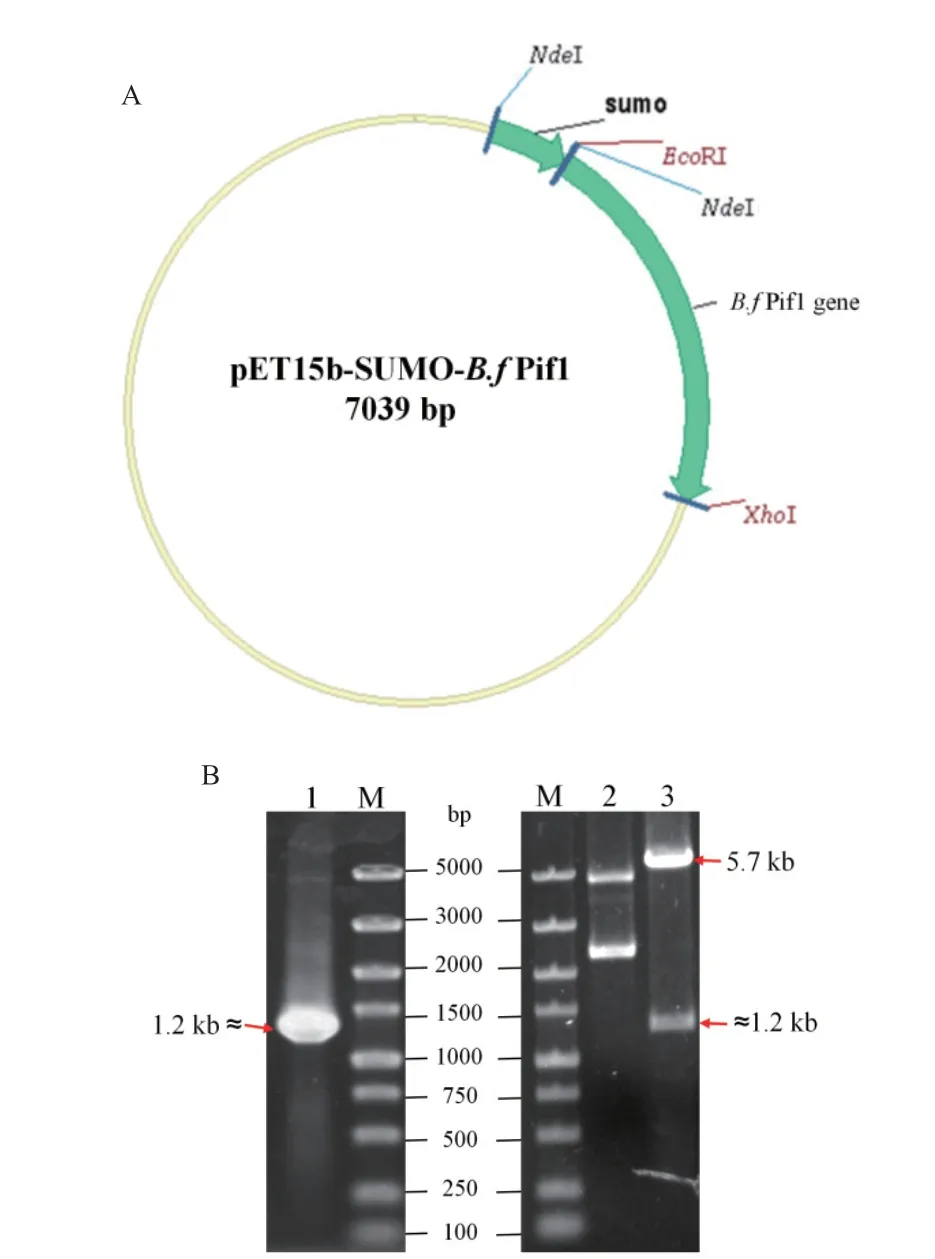
图1 表达载体pET15b-SUMO-B.f Pif1的构建Fig. 1 Construction of expression vector pET15b-SUMOB.f Pif1
2.2 B.f Pif1重组蛋白的诱导表达
经过诱导条件(主要是不同IPTG浓度与不同诱导温度)的优化(图2),该重组蛋白的最佳IPTG工作浓度为0.5 mmol/L,最适诱导温度为18℃(180 r/min)诱导16 h。超声破碎后,SDS-PAGE检测分离蛋白的上清液与沉淀,结果显示(图2,图3-A),均有一条大小约为70 kD的诱导蛋白,并与期望结果大小相符(B.f Pif1蛋白+His-Tag+SUMO His-Tag),该目的蛋白可溶性良好。再与Ni-NTA亲和层析柱结合后,穿出液明显下降(图3-A),说明目标蛋白结合镍柱效果优良。

图2 不同IPTG浓度与不同诱导温度诱导B.f Pif1蛋白的表达Fig. 2 Expression of B.f Pif1 protein induced with different IPTG concentrations and different induction temperatures
2.3 镍柱纯化与SUMO酶切
待蛋白上清液流经镍柱后,用含有不同咪唑浓度的洗脱液将融合蛋白从镍柱上洗脱,接收各个洗脱液组分,SDS-PAGE检测结果(图3-B)显示,在300 mmol/L咪唑浓度条件下,重组蛋白被大量洗脱下来(尽管含有部分杂蛋白条带)。SUMO酶切前后的电泳结果(图3-C)显示,融合蛋白解体、目的蛋白与SUMO-Tag等蛋白标签分离。再经第二次镍柱纯化,SDS-PAGE检测纯化结果(图3-D)说明SUMO及His标签已被留在镍柱上;而无标签的目的蛋白在Ni-NTA穿出液内,条带约为45 kD,与理论值相符。
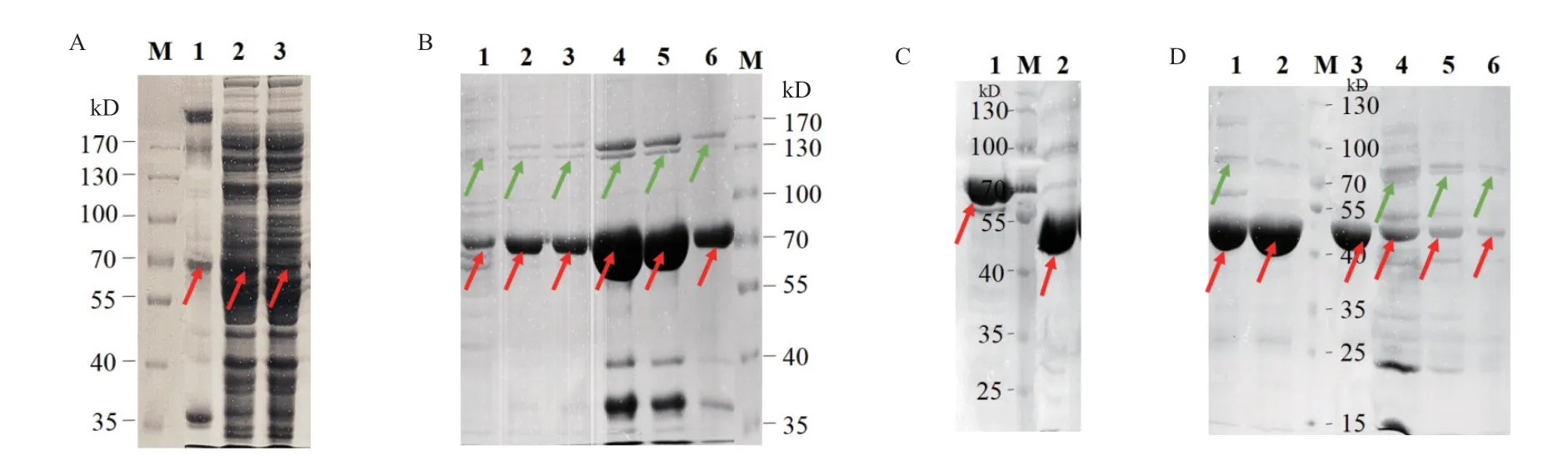
图3 B.f Pif1蛋白的诱导表达、镍柱纯化与SUMO酶切Fig. 3 Induced expression,Ni-NTA purification and SUMO digestion of B.f Pif1 protein
2.4 经DEAE阴离子交换柱层析的纯化
使用DEAE阴离子交换柱对经第二次镍柱洗脱后的蛋白溶液进一步纯化,利用AKTA自带程序监测层析过程中蛋白紫外吸收图谱,准确收集洗脱液(图4-A),结果表明,随着NaCl浓度的梯度增加,B.f Pif1蛋白经过DEAE阴离子交换柱出现了2个特异蛋白吸收峰;对应的SDS-PAGE结果则显示吸收峰A内的目的蛋白更纯,而且浓度较大,经过本步骤纯化,蛋白纯度得到进一步提高至85%,但仍有少量杂蛋白存在。
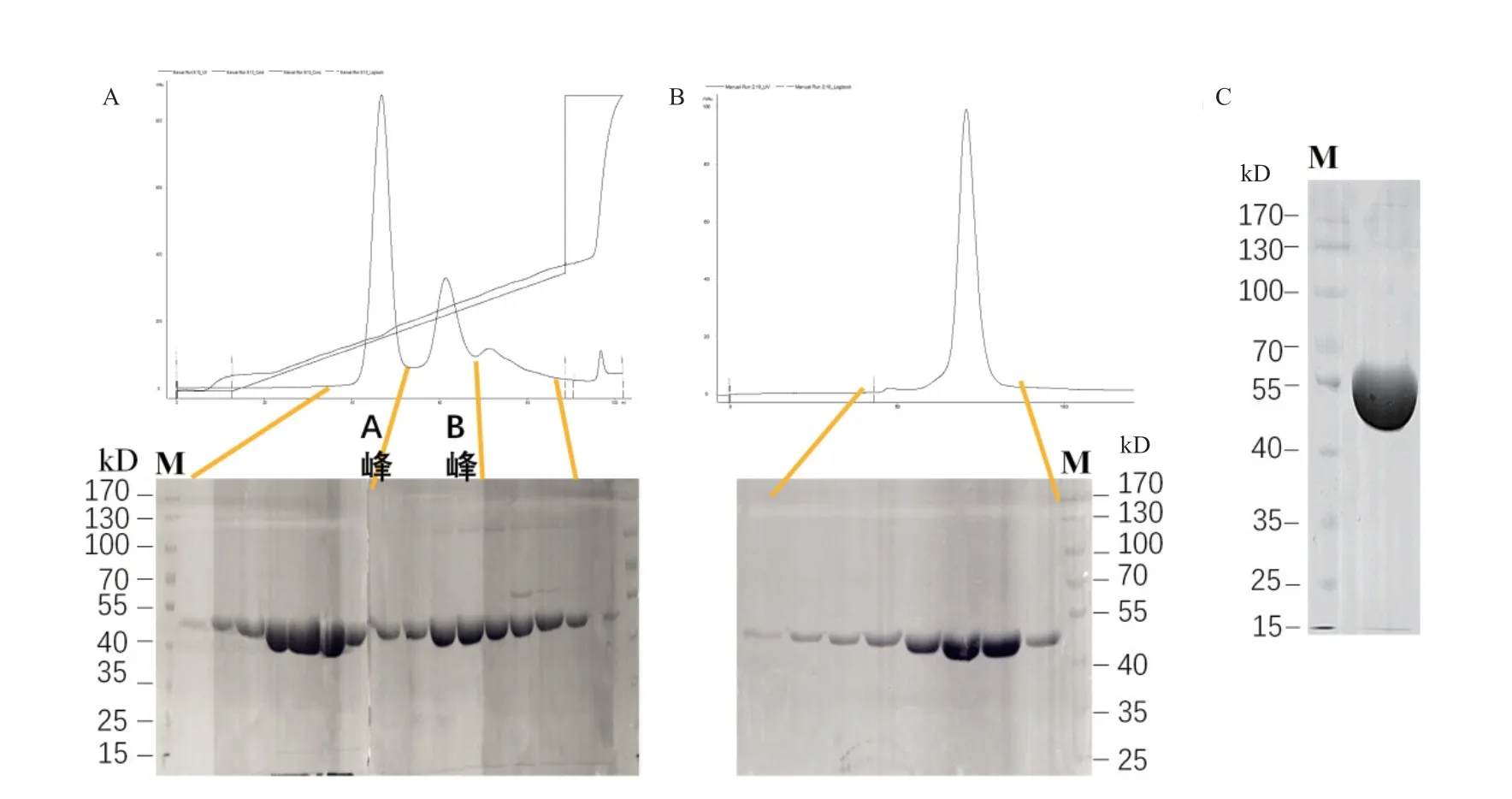
图4 B.f Pif1蛋白的DEAE离子交换层析与S200分子筛纯化Fig. 4 Purifications of B.f Pif1 protein by DEAE ion-exchange chromatography and S200 gel filtration chromatography
2.5 B.f Pif1重组蛋白的凝胶过滤层析
利用蛋白质分子量的差异,将上一步纯化后的蛋白溶液通过凝胶过滤层析柱superdex200(GE Healthcare)作进一步纯化,并去除蛋白多聚体(以利于蛋白结晶的出现)。结果显示(图4-B),若在过分子筛之前加入3 mmol/L DTT处理2 h,再经过S200凝胶过滤层析纯化,B.f Pif1单体状态成为其主要成分,而二聚体含量极低,表明纯化过程中可能产生的B.f Pif1二聚体等被DTT还原其二硫键所抑制。最终纯化产物经10%SDS-PAGE检测与灰度分析,目的蛋白纯度达98.5%(图4-C);蛋白超滤浓缩后,经BCA法测得浓度为17 mg/mL,达到预期要求,有利于后续晶体的生成。
2.6 B.f Pif1蛋白的生物学活性验证
若想了解B.f Pif1解旋酶的蛋白晶体结构,必须保证表达纯化后的目的蛋白具有良好的生物学活性,即揭示其蛋白结构必须为其天然构象。利用Stopped-flow FRET检测技术验证纯化所得B.f Pif1蛋白是具有活性的解旋酶(图5-A),纯化后的B.f Pif1蛋白可利用ATP解旋dsDNA与含G4 DNA的底物(荧光信号显著增加);而且还发现B.f Pif1解旋含G4 DNA的活性明显优于解旋dsDNA。此外,还验证了B.f Pif1蛋白的解旋极性(图5-B),B.f Pif1解旋5'-ssDNA-G4-dsDNA时荧光信号增加,而与3'-ssDNA-G4-dsDNA反应则几乎无荧光信号变化,表明该蛋白具有Pif1家族解旋酶特异的5'-3'解旋方向性。

图5 纯化后B.f Pif1蛋白具有良好的生物学活性Fig. 5 Purified B.f Pif1 protein showing good biological activity
2.7 B.f Pif1蛋白结晶初筛与结晶条件优化
利用多种蛋白结晶试剂盒对B.f Pif1蛋白晶体进行初筛,结果发现在多个条件下出现微晶;继续培养后这些晶体逐渐生长(图6-A和6-B),1周后其宽度为12-20 μm,长度为110-190 μm,呈细长棒状的孪晶形态;同时使用蛋白结晶专用检测的UY200型显微镜鉴定(图6-C),明确这些结晶为蛋白质晶体,只有蛋白晶体才会在280 nm紫外光下特异显示(图6-C为图6-B在紫外显微镜下的成像)。随后在已筛选培养出蛋白晶体的基础上,大量优化晶体培养条件后(尤其是改变沉淀剂浓度与稀释蛋白浓度),蛋白孪晶聚集现象逐渐减少(图7-A);又更换蛋白结晶点样方式为座滴气相扩散法,在蛋白结晶微滴的边缘处出现了单个的蛋白晶体,不同条件下呈现规则的长方体或立方体晶体(图7-B)。
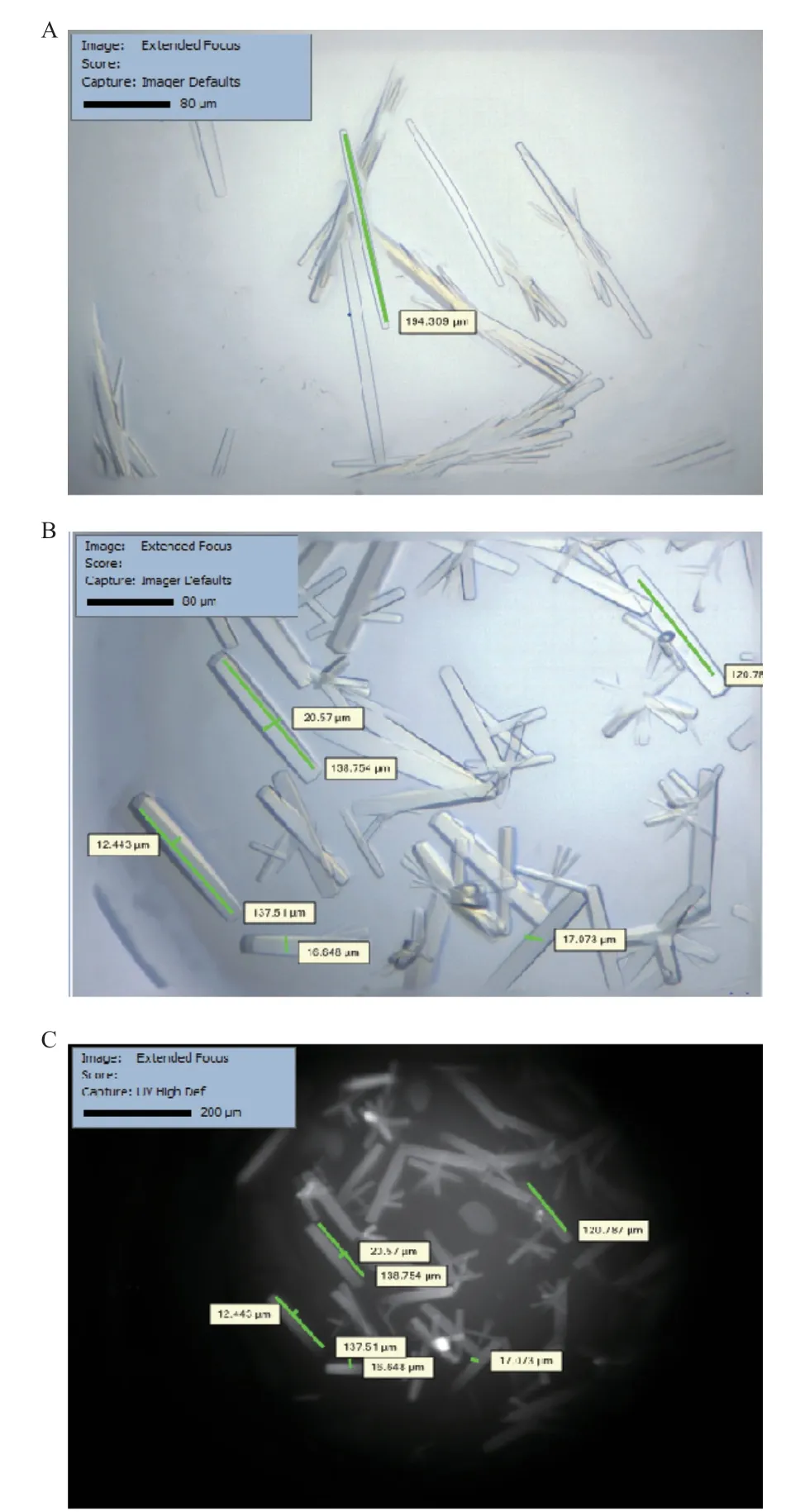
图6 结晶试剂盒初筛得到B.f Pif1晶体Fig. 6 Protein crystals of B.f Pif1 preliminarily screened with different crystallization kits

图7 B.f Pif1蛋白晶体培养条件的优化Fig. 7 Optimization of the culture conditions for B.f Pif1 protein crystals
2.8 B.f Pif1蛋白晶体生长变化与X射线衍射初步结果
在多种蛋白结晶条件优化后,逐步确定了最 佳 结 晶 条 件:9 mg/mL B.f Pif1、100 mmol/L NH4Acetate、16% PEG4000 pH 6.5以 及0.1 mol/L Bis-Tris乙酸(pH 8.3)、0.05 mol/L碳酸氢钠、5%甘油和0.015 mol/L亚精胺或0.002 mol/L PEG2000等。不同条件长出的晶体形态有所差异,但都为形态良好的单晶;并且较长时间观察这些条件下晶体生长与形态变化(图8),其中蛋白晶体最长生长时间是19 d,此后蛋白晶体不再长大,形态规则的长方形晶体;但13 d之后,中心区域晶体出现孪晶现象——因此,后续挑去边缘的单晶独立培养。经多个最佳晶体生长条件下独立培养的蛋白晶体使用德国布鲁克AXS公司CCD单晶X衍射仪进行衍射试验(图9-A、图9-B-a和图9-B-b);其中,最好的衍射分辨率达到3.5 Å(图9-B-c)。随后对衍射良好蛋白晶体溶解后再进行SDS-PAGE电泳验证,结果显示,该蛋白晶体分子量为45 kD左右,证明这些具有良好衍射特征的蛋白晶体就是B.f Pif1解旋酶蛋白。
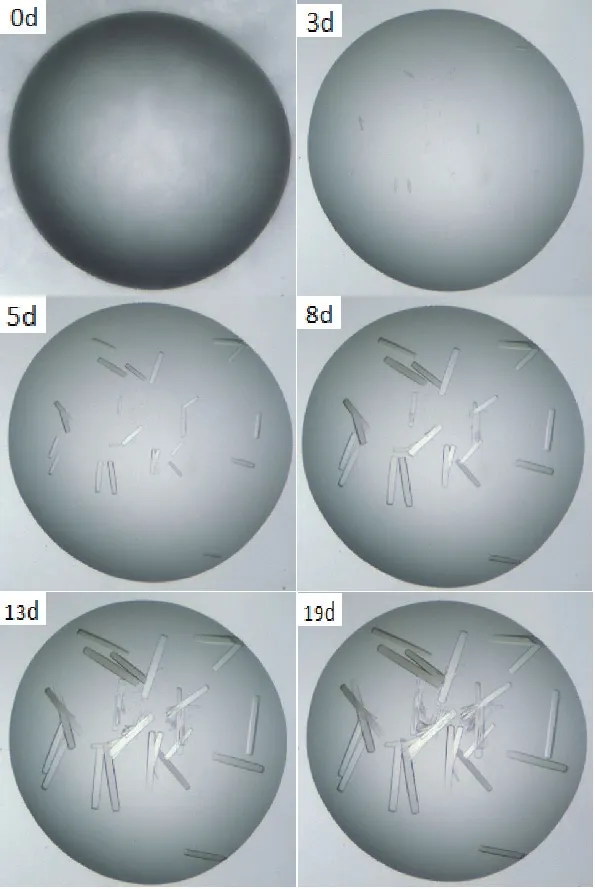
图8 B.f Pif1蛋白晶体生长情况Fig. 8 Growths of B.f Pif1 protein crystals

图9 不同条件下B.f Pif1蛋白单晶的X射线衍射图谱及其对应蛋白电泳Fig. 9 X-ray diffraction patterns of B.f pif1 protein single crystal under different conditions and its corresponding SDS-PAGE
3 讨论
近年来,在脆弱拟杆菌机会致病性研究中其分子机制成为热点[18-19],但此类研究往往关注脆弱拟杆菌病变中某种信号通路改变而激活个别转录因子所产生的致病效应,并未深入探讨其致病时应激变化可导致相关差异基因转录水平或转录后水平调控的原因。但迄今为止,可高效特异解旋G4 DNA从而维持基因组稳定性的脆弱拟杆菌Pif1解旋酶(B.f Pif1)的结构与功能的研究都未见报道。因此,本研究针对B.f Pif1表达纯化与结晶的研究是首次较为深入地探讨该方向的相关研究。
蛋白质三维结构的深入研究,需要首先获得高纯度(纯度>97%)与高浓度(一般高于10 mg/mL)的B.f Pif1蛋白[20]。在优化目的蛋白最佳诱导条件表达后,本研究设计了一系列的蛋白纯化方案,其中SUMO酶切结合Ni-NTA亲和层析最为关键。借鉴Marblestone等[21]关于SUMO表达体系应用的报道,本研究选用SUMO工具酶以利用其以下优势:(1)该融合标签不仅促进蛋白的可溶性,而且还具有分子伴侣功能,能帮助目的蛋白构象的正确折叠[22];(2)其分子量较小,相比于TEV 蛋白酶更加高效,这一点是在之前类似研究基础上的优化与改进;(3)使用本实验室自行纯化并在前期研究中已经验证活性的SUMO蛋白酶[23],在简化纯化需求的同时,成功将蛋白纯度从85%提升至95%;(4)采用SUMO表达体系,经过第二次镍柱纯化后,能够最大限度去除原有的SUMO-Tag及N端的His-Tag标签,不含任何标签的蛋白质本身更容易结晶,并且所结晶体更接近天然构象状态[24]。经过第一步亲和层析后,利用B.f Pif1蛋白pI<7的生化特征,选择DEAE弱阴离子交换层析进行蛋白的分离纯化;但结果中仍有少量的杂蛋白。再借鉴清华大学李海涛课题组相关研究中的纯化思路[25],选取Superdex 200凝胶过滤层析纯化,为有利于蛋白单晶的形成,选用3 mmol/L DTT破坏二硫键以优化蛋白聚集状态,这与此前BsPif1晶体结构研究中结晶前处理相一致[13]。
本研究要进行蛋白结晶与晶体结构分析,还需验证表达纯化产物是具有活性验证,结果显示纯化后的B.f Pif1蛋白具有良好的解旋活性,并且解旋含G4 DNA底物的活性更强,这一点跟前人报道多种Pif1解旋酶的特征相符[11,26];同时还验证出该解旋酶具有Pif1解旋酶家族特异5'-3'解旋极性,揭示本研究获得B.f Pif1解旋酶蛋白具有其天然构象,适于后续蛋白质结构与功能的研究。
不同蛋白的结晶条件千差万别,往往与结晶方法及所需结晶蛋白的纯度、特性、缓冲液等因素相关[27]。本研究中B.f Pif1蛋白结晶进行了大量的筛选,有至少6个初始晶体条件可以筛选出晶型较好、生长稳定重复性好的B.f Pif1蛋白晶体(紫外显微镜与蛋白电泳均证实);在此基础上优化培养晶体,调整沉淀剂浓度与稀释蛋白质浓度以及采用16℃的座滴法,此类优化方法与前人研究类似[14];最终所获蛋白单晶使用X-ray初步衍射其衍射点最高分辨率达到3.5 Å,提示本研究条件下的最佳B.fPif1蛋白单晶生长条件为0.1 mol/L Bis-Tris乙酸(pH 8.3)、0.05 mol/L碳酸氢钠、5%甘油和0.015 mol/L亚精胺。对比分析本研究与其他Pif1解旋酶家族成员的结晶条件[13,15]:不同Pif1解旋酶家族成员(无论是单蛋白晶体还是蛋白复合物共结晶)的结晶条件都各不相同;即使同一Pif1蛋白的高分辨率结晶条件也可以存在多个。待后续B.f Pif1晶体送上海光源高能衍射后为获得更高分辨率,结晶条件可能被进一步优化;随后的硒代培养蛋白的结晶或B.f Pif1与G-rich的ssDNA共结晶晶体的优化条件也必然需要进一步探讨。
尽管西北农林科技大学奚绪光课题组前期曾成功对Bs.Pif1解旋酶蛋白进行晶体研究[26],表明该蛋白是Pif1解旋酶家族中首次被成功结晶与解析的蛋白质;但是本研究所结晶的B.f Pif1与BsPif1在序列与功能上存在一些明显的差异性。首先,同源序列比对与系统进化树分析表明两者间所具有序列保守性,但也存在氨基酸一级序列明显差异位点与区段(数据未给出),这主要源于2种细菌不同生长环境所需维持不同基因组稳定性的Pif1解旋酶进化过程中的差异性[4,23]。其次,功能上差异则主要根据其生理生化特征不同:BsPif1是普通拟杆菌内的一种Pif1解旋酶,其临床意义不大;而本研究探索的B.f Pif1则是与人类肠道菌群中占据优势的脆弱拟杆菌[28]以及其变为机会致病菌[2]的过程中所形成G-rich序列特异调控相关的Pif1解旋酶,曾有报道指出机会致病的脆弱拟杆菌基因组内存在G+C含量异常升高与特异基因表达调控区DNA结构异常变化[4-5],提示在机会致病过程中必然存在高效解旋G-rich序列的解旋酶以维持基因组稳定性。因此,深入研究B.f Pif1解旋酶的结构与功能将为消化道疾病病变患者体内脆弱拟杆菌机会致病过程提供新的研究与诊疗视角,这正是研究本蛋白结晶的意义所在。
在本研究成功表达纯化B.f Pif1重组蛋白、经过多种结晶初筛与条件优化及初步衍射而获得了质量较好蛋白单晶的基础上,后续研究主要将衍射较好的晶体送上海光源进行高能量X-ray衍射,硒代培养基发酵B.f Pif1的纯化与结晶、衍射,以获得足够的衍射数据与相位信息进行B.f Pif1蛋白的晶体结构解析;同时还将研究B.f Pif1与特异GC序列DNA共结晶体的结构,为分析B.f Pif1解旋酶的关键氨基酸作用位点及潜在的治疗药物靶向结合等奠定前期基础,为脆弱拟杆菌机会致病病变提供新的诊断分子靶点和精准治疗路径。
4 结论
成功将B.f Pif1解旋酶进行原核诱导表达与一系列层析纯化,获得具有纯度高(>98.5%)、浓度大(17 mg/mL)、活性强的B.f Pif1蛋白;并利用结晶机器人及棋盘法对结晶条件进行筛选与优化,明确9 mg/mL B.fPif蛋白可在最优的结晶条件为0.1 mol/L Bis-Tris乙酸(pH 8.3)、0.05 mol/L碳酸氢钠、5%甘油和0.015 mol/L亚精胺下生长出较好质量的晶体,其初步X-ray衍射的分辨率可达3.5 Å。
