miR159-GAMYB途径调控植物生长发育的研究进展
2021-11-06黎猛陈跃胡凤荣
黎猛 陈跃 胡凤荣
(1. 南京林业大学风景园林学院,南京 210037;2. 浙江省农业科学院园艺所,杭州 310000)
microRNA(miRNA)是一类在动植物中广泛存在和在进化上保守的一段不具有开放性阅读框、不编码蛋白质的长度为20-24 nt的非编码小分子RNA[1]。microRNA的生物合成通过转录、加工成熟和功能复合体装配3个步骤完成,先后形成初级miRNA(pri-miRNA)、前 体miRNA(pre-miRNA)和双链片段miRNA(miRNA/miRNA*),最后miRNA与AGO蛋白结合成RISC沉默复合物来完成功能调控[2]。microRNA主要通过调控下游的靶基因来发挥作用,其与靶基因的mRNA互补配对来切割mRNA或者抑制mRNA翻译[3],此外microRNA还可以调控基因的甲基化[4-5]。众多研究表明,microRNA广泛参与植物生长发育、信号传导、逆境胁迫响应等多个生命过程[6],因此研究microRNA的机理、生物学功能等具有重要意义。
microRNA159(miR159)家族是一类普遍存在于双子叶植物和单子叶植物中的长度为21 nt的古老microRNA家族[7]。作为一类高度保守的microRNA,大量植物的小RNA测序实验揭示,miR159是植物中表达量最多的一类microRNA[7]。MYB转录因子家族是最大的转录因子家族之一,具有MYB结构域的转录因子叫做MYB转录因子,其N端是高度保守的MYB结构域,根据该结构域R结构的个数和重复种类分为4类:(1)1R-MYB(R1/2,R3),(2)R2R3-MYB,(3)3R-MYB(R1R2R3-MYB)和(4)4R-MYB[8-9],其中R2R3-MYB转录因子是MYB转录因子家族中数量最多的[10]。研究表明一类编码R2R3 MYB转录因子的GAMYB基因是miR159主要的靶基因,因为这类MYB基因在大麦种子糊粉中响应GA信号,该基因编码的MYB转录因子可以激活GA信号下游的α-淀粉酶基因和水解酶基因等基因的表达,所以这类MYB基因又叫“GAMYB”[11]。
miR159调控GAMYB在植物营养生长、开花诱导、雄性生殖、花器官发育、植物育性、果实发育和胁迫响应中有着重要作用,目前基于miR159-GAMYB途径的研究在拟南芥中较为深入,在水稻、黄瓜、葡萄、大麦、草莓、大岩桐、烟草等植物中也有进展,本文总结了近些年来miR159-GAMYB途径调控植物生长发育和胁迫响应的相关研究,为今后相关研究提供参考。
1 miR159-GAMYB表达调控模式
在模式植物拟南芥(Arabidopsis thaliana)中,MIR159基 因 家 族 包 括MIR159a、MIR159b、MIR159c三种,其编码的3种成熟miR159(miR159a、miR159b、miR159c)序列相差1-2个碱基,其中,miR159a与miR159b相 差1个 碱 基,miR159a与miR159c相差2个碱 基[12]。研 究表明miR159a和miR159b是拟南芥miR159家族成员中表达量最高的,有着相同的表达模式且广泛分布于植株各部位,尤其是在芽和根部分生组织中,但是在花药中缺乏,在种子中表达较弱;miR159c表达非常弱,主要分布在花药和顶芽区域[12-14]。
在 拟 南 芥 中 有7个GAMYB-like基 因,包括MYB33、MYB65、MYB81、MYB97、MYB101、MYB104、MYB120[15-16],其 中 除MYB104尚 没 有功能报道外,其余的GAMYB-like基因在拟南芥生命活动中有着重要作用,这些GAMYB-like基因有着保守的miR159结合位点,生物信息学分析和5'-RACE分析表明它们是miR159的靶基因[14],而降解组测序表明MYB33和MYB65是miR159的主要靶 基 因[16-17],对MYB33和MYB65的mRNA结 构分析发现MYB33/65的miR159结合位点旁有独特的二级结构[18],而其他GAMYB-like基因没有,这种结构有助于miR159沉默MYB33/65。组织表达分析发现MYB33和MYB65在全株都有大量表达,MYB81/97/101/120主 要 在 花 药 中 表 达[13,19],而miR159在花药中表达很弱,miR159和GAMYB的这种组织表达差异[20]对于拟南芥生长发育有着重要意义。
在水稻中,Os-miR159a和Os-miR159b有着相同的成熟序列,其靶基因包括1个GAMYB基因和2个GAMYB-like(OsGAMYBL1和OsGAMYBL2)基因,Os-miR159在叶子和花中都表达,3个OsGAMYB同源基因在叶中的表达显著高于花中,且OsGAMYB和OsGAMYBL1的 表 达 显 著 高 于OsGAMYBL2[21]。5'-RACE表 明Os-miR159裂 解OsGAMYB和OsGAMYBL1,不 裂 解OsGAMYBL2,miR159调 控GAMYB机制存在于水稻叶和花中[21]。
miR159裂解靶基因GAMYB来发挥调控功能的机制广泛存在于植物中,miR159-GAMYB途径在植物中高度保守,miR159调控其他靶基因途径在植物中并不具有保守性[22]。
2 miR159-GAMYB调控植物生长发育
2.1 miR159-GAMYB调控植物营养生长
在拟南芥营养组织中,MYB33和MYB65大量转录,miR159通过裂解MYB33和MYB65来保证拟南芥的正常生长,研究表明MYB33和MYB65的表达会带来多种生长缺陷,包括生长延缓、株型矮小、叶子卷曲等。在拟南芥T-DNA功能缺失突变 体mir159ab中,MYB33和MYB65的 表 达 量 上升[13],出现了多种表型缺陷包括生长延缓、叶子卷曲、角果和种子变小、种子畸形等[13-14,19],通过突变MYB33的miR159结合位点构建mMYB33拟南芥,发现mMYB33拟南芥也出现了与mir159ab拟南芥相似的表型缺陷[13,23]。在更进一步的研究中构建了T-DNA myb33myb65mir159ab四突变体,结果表明所有mir159ab双突变体的表型缺陷在myb33myb65mir159ab四突变体中都受到抑制[13]。细胞学上观察mir159ab拟南芥的茎尖组织和叶组织发现,mir159ab拟南芥茎尖分生组织变得肥大,叶片的叶肉细胞数量显著减少,叶表皮细胞尺寸变小和数量减少,说明MYB33和MYB65的表达抑制了细胞的增殖[13]。分子层面分析表明mir159ab拟南芥中MYB33和MYB65的解除导致莲座叶和花组织中与糊粉相关的基因上升,包括一些水解酶和细胞程序性死亡(PCD)相关的基因,如CP1(CYS PROTEINASE1),GASA1(GA-REGULATED GENE1),DMC1(DISRUPTED MEIOTIC CONTROL1),BLX1(BETAXYLOSIDASE1)和BXL2,但是利用台盼蓝染色发现莲座叶中MYB33和MYB65的表达并没有促进细胞程序性死亡[13]。这些研究表明MYB33和MYB65的表达对拟南芥营养生长有害[13],而miR159通过裂解MYB33、MYB65来维持拟南芥正常营养生长。同样,利用人工microRNA靶基因模拟技术构建抑制miR159活性的MIMIC159(MIM159)拟南芥,结果MIM159拟南芥出现植株矮小、叶子上卷变圆、节间缩短等营养生长缺陷[24-26],说明miR159的表达对拟南芥营养生长至关重要。
在 水 稻(Oryza sativa)中miR159-GAMYB调控水稻营养生长。Zhao等[27]利用STTM(short tandem target mimic)技术构建了抑制miR159活性的STTM159水稻,结果表明在STTM159水稻中2个miR159的 靶 基 因OsGAMYB1和OsGAMYBL1(GAMYB-LIKE 1)表达上升,STTM159水稻表现一系列生长缺陷包括植株高度变小,叶、圆锥花序尺寸变小、节间缩短等。对茎和叶脉横截面观察发现,野生型水稻茎比STTM159水稻茎具有更多的小维管束细胞,叶具有更多的小叶脉。GO(gene ontology)富集分析表明在STTM159水稻7 000多个基因中,关于细胞周期、生长、信号传导等基因受到负调控,关于生物胁迫、细胞程序性死亡、营养素水平反应的基因受到正调控。在MIM159水稻中,OsGAMYB1和OsGAMYBL1的表达上升,出现了与MIM159拟南芥相似的表型缺陷,包括植株矮小,生长延缓,剑叶短小等[21]。
Zheng等[21]对另一种模式植物烟草(Nicotiana tabacum)进 行 探 究 发 现,MIM159烟 草 中3个NtGAMYB(NtGAMYB1、NtGAMYB2、NtGAMYB3)同源基因表达量上升,出现了与MIM159拟南芥相似的表型缺陷,包括株型矮小、叶子更小更皱等,对NtGAMYB基因进行烟草遗传转化发现,35S-NtGAMYB2烟草无明显发育表型缺陷,而35S-mNtGAMYB2(miR159结合位点突变)烟草出现了与MIM159烟草相似的表型缺陷,表明miR159裂解调控NtGAMYB来发挥作用。利用GO富集分析发现MIM159烟草中有关胁迫响应、细胞程序性死亡的基因表达上升,有关形态学、细胞周期、细胞大小相关的基因表达下降。这些实验验证了GAMYB对营养生长的抑制功能,表明miR159通过裂解NtGAMYB来保证烟草正常的营养生长。
Kim等[28]对杨树(Populus alba×P.tremula var.Glandulosa)GAMYB-like基 因PtrMYB012进 行 拟 南芥异源表达转化,结果表明35S:PtrMYB012过表达的拟南芥莲座叶上卷、矮小和雄性不育,这与mMYB33拟南芥和mir159ab拟南芥的表型缺陷相似,但是35S:PtrMYB012杨树没有明显的表型缺陷,说明PtrMYB012被杨树的miR159裂解但是不被拟南芥的miR159裂解。对烟草、水稻和日本落叶松(Larix kaempferi)GAMYB基因进行拟南芥异源过表达转化,发现mNtGAMYB2拟南芥、mOsGAMYB拟南芥和mLaMYB33拟南芥这些过表达株系同样出现了与mMYB33拟南芥一样的表型缺陷,包括生长严重迟缓、植物矮小、叶子卷曲等[21],在这些株系中,CP1的表达显著上升,表明了GAMYB在不同植物中激活了相似的下游基因。
以上研究表明,GAMYB的表达对植物营养生长有诸多害处包括生长迟缓矮小、叶子卷曲等且这种功能是保守的[21],miR159通过裂解调控GAMYB来保证植物的正常营养生长。但是这种功能在一些植物中还存在差异:在MIM159番茄(Solanum lycopersicum)中,miR159的 靶 基 因SlGAMYB1和SlGAMYB2表达量上升,MIM159番茄比野生型番茄植株更高,推测GAMYB可能促进茎的伸长[29],这与之前水稻[30-31]中研究相似;在35S:MIM159大岩桐(Sinningia speciosa)中,SsGAMYB表达量显著上升,但并没有表现出营养生长上的缺陷[32];Hou等[33]从青菜(Brassica rapa ssp. Chinensis)中分离1个GAMYB基因BcMYB101,BcMYB101在青菜叶、叶柄、根和花器官中高表达,BcMYB101异源过表达拟南芥表现为拟南芥叶子下卷、莲叶数变多,而通过病毒诱导基因沉默(virus-induced gene silencing,VIGS)技术沉默BcMYB101导致青菜叶子上卷。
在 拟 南 芥 根 中,MYB65促 进 细 胞 增 殖[34]。mir159ab双突变体中,MYB33、MYB65、MYB101表达量上升,mir159ab双突变体比野生型的根更长、分生组织更大、分生区和伸长区的细胞更多更长,且mMYB33/mMYB65/mMYB101拟南芥都表现出与mir159ab拟南芥根相似的特征,这些表明miR159通过裂解MYB33、MYB65、MYB101进而抑制主根生长[34]。
拟南芥GAMYB对根生长具有促进作用,包括促进根伸长生长和细胞增殖;而在其他营养组织中GAMYB具有强烈的抑制作用,包括抑制植株生长和茎叶细胞增殖,这其中的机理还需要进一步探究,同时miR159-GAMYB途径在根中的功能研究还需在其他植物中扩展。
2.2 miR159-GAMYB调控植物花药发育
花药是雄蕊的重要组成,位于花丝顶端,膨大呈囊状。植物花药发育主要分为两个阶段,第一阶段由雄蕊原基开始发育,经过组织特化、减数分裂形成完整的花粉囊壁,从外到内依次是表皮层、纤维层、中层和绒毡层,在药室中心分布着小孢子的四分体结构;第二阶段花药继续膨大,花丝伸长,小孢子由四分体结构发育成花粉粒,花粉囊开裂释放花粉,进而完成授粉受精过程[35]。花药及花粉能否正常发育关系到植物是否可育,因此花药和花粉对植物生命过程有着至关重要的作用。
2.2.1 miR159-GAMYB调控拟南芥花药和花粉发育 在拟南芥花药中,miR159家族中只有miR159c在花药中少量表达,研究表明MIR159c不是1个假基因,但是活性非常弱其作用可以忽略[14],而GAMYB-like基因主要在花药中表达[13,19],这种组织表达差异对拟南芥花药发育至关重要。
绒毡层是花粉囊最内层的由花药次级壁细胞分化而成的特殊体细胞,包围着小孢子,绒毡层在小孢子从四分体释放后开始降解,在花粉成熟时期完全降解。它在花药和花粉的发育中发挥着重要作用:为孢子母细胞提供营养物质;合成分泌孢粉素到花粉壁上,增强花粉的稳定性;合成并分泌可以分解四分体的胼胝体外壁的胼胝体酶,从而四分体释放小孢子。绒毡层的降解是一个细胞程序性死亡的过程,调控绒毡层细胞程序性死亡的一些基因的突变常会使绒毡层不能正常降解,从而使花药不能正常发育,最终导致雄性不育。
Millar等[23]发现拟南芥MYB33和MYB65调控绒毡层细胞程序性死亡,myb33myb65双突变体在花粉母细胞阶段花药的绒毡层肿大导致花粉减数分裂前的败育,但是在高光强和低温条件会减少败育,myb33或myb65单突变体没有花药表型缺陷,说明MYB33和MYB65在花药发育上功能冗余。在35S:miR159a过表达拟南芥中也出现了雄蕊不育表型缺陷,花药不能释放花粉。
胞质分裂同时植物在雄性减数分裂末期Ⅱ以后,子核胞质区域会形成辐射状微管系统(radial microtubule arrays,RMAs),调节胞质向心收缩进而促进细胞分裂。研究表明拟南芥MYB33和MYB65还可以影响雄性减数分裂Ⅱ时期的辐射状微管排列的形成和胞质分离,在myb33myb65双突变体中,减数分裂胞质分离异常并产生二倍体花粉粒和缺少富含蛋白的细胞外壁,导致花粉壁形态异常,而myb33或myb65单突变体并无此表型缺陷,说明MYB33和MYB65雄性减数分裂上功能冗余[36]。
植物的精细胞谱系发育过程是一个独特重要的生命过程,在此过程中,单倍体小孢子经过不对称有丝分裂产生一个较大的营养细胞和一个包裹其中的较小的生殖细胞,然后生殖细胞继续分裂形成两个精细胞。最近的研究表明MYB81可以促进雄性小孢子发育,Oh等[37]发现拟南芥myb81突变体的花粉有一半异常,其小孢子不能进行有丝分裂第一阶段过程,在极化阶段就中止了,进一步分析发现MYB81作为GAMYB转录因子促进有丝分裂第一阶段和两个雄性细胞谱系形成,对拟南芥的雄性小孢子发育和性成熟至关重要。
花粉管是从花粉萌发孔伸出而形成的管状结构,花粉粒的内壁通过花粉外壁上的萌发孔或沟向外伸出的细管进而形成花粉管,其主要作用是将其携带的精子和其他内容物运至卵器或卵细胞内,来完成受精作用。研究表明拟南芥MYB97、MYB101、MYB120影响花粉管感应雄配子,MYB97、MYB101、MYB120主要在成熟花粉粒中表达,在成熟花粉中,MYB97、MYB101、MYB120的表达量明显高于其他几类GAMYB基因且它们有着相同的表达模式[38],三 突 变 体(myb97-1 myb101-1 myb120-3,myb97-1 myb101-2 myb120-3 和myb97-1 myb101-3 myb120-3)拟南芥比野生型拟南芥有着更小的角果(这些角果中有许多不育的胚珠)和更低的结实率,雄配子有缺陷[35],且其花粉管不能释放精细胞到胚中,进一步的研究表明MYB97、MYB101、MYB120调控下游花粉管基因的表达(这些基因有关于糖类活性酶、小蛋白、转运蛋白的合成[39]),进而影响花粉管感应雄配子和花粉管细胞促进花粉管分化释放精细胞[38-39],任何一个单突变体或者双突变体都没有出现花粉表型缺陷,说明MYB101、MYB104、MYB120在花药发育上功能冗余[38-39]。
植物受精是植物有性生殖的核心环节,miR159-GAMYB途径在这一过程中对中央细胞受精发育有着重要的作用,影响植物的育性和种子发育。中央细胞是胚囊的组成细胞之一,是一个大型的液泡化细胞,内含二核叫做极核,受精的中央细胞又称“受精极核”,中央细胞在受精后发育为胚乳。Zhao等[40]发现mir159abc拟南芥的中央细胞不能正常分裂而导致结实率降低,在受精前,拟南芥胚囊中央细胞的MYB33和MYB65表达量很高;在受精后,野生型拟南芥中央细胞MYB33和MYB65表达很低,mir159abc拟南芥中央细胞MYB33和MYB65表达依旧很高,且mir159abc拟南芥与mMYB33拟南芥一样,胚乳核分裂受到明显抑制。这些说明花粉中的miR159传输到中央细胞来降解MYB33和MYB65进而促进胚乳核分裂。
2.2.2 miR159-GAMYB调控其他植物花药和花粉发育 在其他植物花药中,GAMYB的正常表达对于花药的正常发育有着重要作用,miR159通过调控GAMYB进而调控花药发育。
在水稻花药中,miR159和OsGAMYB共表达,miR159对OsGAMYB的表达起着微调(fine-tune)的作用,在花药发育期间miR159a水平下降导致其2个靶基因OsGAMYB和OsGAMYBL1表达上升[30]。水稻花药中,miR159-GAMYB影响乌氏体和外孢壁的发育。乌氏体是花药绒毡层内表面上的一种仅数微米大小的颗粒物,乌氏体参与绒毡层壁的降解、花粉外壁的形成、识别蛋白的转运等,对花粉的发育有着重要作用。研究表明水稻gamyb突变体花器官发育异常尤其是花药,表现为绒毡层不能正常程序性死亡、乌氏体和外孢壁有缺陷,从而导致雄蕊不育,更进一步的分析表明GAMYB结合在CYP703A3基因的启动子上来促进其在花药发育中的表达,从而保证乌氏体和外孢壁的正常形成[41]。
植物花药的开裂保证成熟花粉的释放,以完成授粉受精过程。花药壁组织的脱水、酶解和花药药室内壁的次生加厚等过程都会影响花药的开裂,其中药室内壁的次生加厚为花药开裂提供一种机械力量,对花药开裂至关重要。侯丹[42]对毛竹(Phyllostachys edulis)的PhemiR159进 行 拟 南芥过表达发现过表达拟南芥花药内皮层缺乏次生加厚、裂口区缺少机械外力而无法开裂,qRT-PCR结果表明与拟南芥花药开裂相关的MYB26、NST1(NAC SECONDARY WALL THICKENING PROMOTING FACTOR1)、NST2 等基因的表达量在超表达株系中均发生显著变化,推测毛竹PhemiR159可能通过负调控拟南芥AtMYB33来调节这些次生加厚相关基因的表达,从而影响PhemiR159过表达拟南芥株系的花药开裂。
糖是植物光合作用的产物和呼吸作用的底物,叶片光合作用产生的碳水化合物通过韧皮部转运到植物的各个部分,为其生长发育提供碳和能量,如花药发育、花粉管萌发、种子果实的膨大成熟等。研究表明在番茄中GAMYB可以调控糖类代谢基因进而调控花药发育,Zhang等[43]利用RNAi技术沉默番茄中的GAMYB-like基因SlMYB33,发现SlMYB33-RNAi番茄出现花粉成熟异常并导致低育性,进一步分析表明SlMYB33-RNAi番茄花粉中有关于蔗糖、淀粉代谢和糖类运输的基因表达受到抑制。
胡 紫 蔚[44]构 建 了 白 菜(Brassica campestris)MIR159a和MIR159c过表达载体,遗传转化菜心,结果发现过表达35S:MIR159a白菜和35S:MIR159c白菜都会引起花粉败育,且花粉败育都是由于花粉粒内含物降解导致花粉内壁消失,进而引起花粉皱缩,不过白菜过表达MIR159a和 MIR159c植株花粉出现败育的时期不同,过表达MIR159a白菜产生的花粉败育比例要高于过表达MIR159c白菜,且过表达MIR159a白菜的花粉管萌发异常[44-45]。
在黄瓜中,GAMYB可以调控雌雄花的比例,利用RNAi技术沉默黄瓜中的CsGAMYB1,结果为CsGAMYB1-RNAi黄瓜雄花和雌花的比例降低[46],黄瓜CsGAMYB1在拟南芥中异源过表达会导致拟南芥雄性不育[46]。
过表达HvGAMYB会导致大麦花粉不育,花药体型变大、颜色更亮[47]。在小麦Ubi∷TamiR159异源过表达水稻中,表现为育性降低,花药中无花粉,但Ubi∷TamiR159水稻中绒毡层能够正常分解,其雄性不孕花粉不能正常产生的原因还不清楚[48]。
2.3 miR159-GAMYB调控种子萌发和果实发育
2.3.1 miR159-GAMYB调控种子萌发 糊粉粒是植物细胞内储藏蛋白质的结构,每个糊粉粒是一个液泡,其中储藏大量蛋白质。糊粉粒可以转运养分和积累营养物质,在种子萌发中,糊粉开始细胞程序性死亡,为种子萌发提供营养和水解酶,禾本科植物种子的糊粉粒集中在胚乳的外层细胞中,形成糊粉层。GAMYB早期被发现在大麦糊粉中调控细胞程序性死亡[26,49],这一功能后来在拟南芥、水稻都被证实。
在拟南芥种子中,MYB33、MYB65、MYB101促进糊粉的细胞程序性死亡,研究表明在myb33myb65myb101三突变体中出现了糊粉细胞空泡化,同时对mir159ab双突变体拟南芥营养组织中进行深入探究,发现MYB33和MYB65的解除导致了有关糊粉的基因表达上升,包括一些水解酶和细胞程序性死亡相关的基因,如CP1、CP、GASA1、BXL1和BXL2,这些基因在myb33myb65myb101三突变体的种子中表达都下降了[19]。值得注意的是,miR159在拟南芥种子和GAMYB共表达,研究表明随着种子萌发MYB33的表达水平逐渐降低,miR159的活性处于衰减状态,miR159对MYB33的表达只是微调的作用[50]。在水稻种子中,OsGAMYB促进糊粉细胞的细胞程序性死亡,不过在水稻中,miR159的表达很低并不参与调控OsGAMYB[14]。番茄的GAMYB-like基因LeGAMYBL1在种子的胚和胚乳中表达,并且在种子萌发中表达量上升[51]。
2.3.2 miR159-GAMYB 调控果实发育 miR159-GAMYB在番茄和葡萄中可以促进单性结实。在番茄中,miR59和SlGAMYB在开花前的子房中共同表达,SlMIR159过表达导致SlGAMYB表达下降,并致使果实早熟单性结实[29]。在葡萄中,外源GA处理促进葡萄单性结实,并且GA处理使VvmiR159c受到正调控,VvGAMYB受到负调控[52]。
miR159-GAMYB可以调控草莓花托的发育。在草莓花托发育不同阶段,草莓的Fa-MIR159a、Fa-MIR159b表现为不同程度的表达,且与它们的靶基因FaGAMYB呈负相关[53]。Vallarino等[54]用RNAi沉默草莓中的FaGAMYB,发现FaGAMYB-RNAi草莓中FaGAMYB下降并且花托成熟中止,颜色形成受到抑制。
在番茄中,GAMYB可以促进果实增大。研究表明,SlMYB33-RNAi番茄比野生型的番茄果实更小[43]。对番茄SlGAMYB进行过表达转化,发现SlMYB33过表达番茄的果实更大[55]。
2.4 miR159-GAMYB调控植物开花
植物开花诱导受内源因素和外源因素共同影响,主要受光周期途径、春化作用、自主途径和赤霉素途径四大途径的影响,这些途径最后都汇 聚 于LFY(LEAFY)、SOC1(SUPPRESSOR OF OVEREXPRESSION OF CO1)、FT(FLOWERING LOCUS T)等调节因子的转录上。miR159-GAMYB途径在植物开花诱导上的功能目前还尚有争论[18]。
在拟南芥中,MYB33可以结合在LFY的启动子上来激活其表达并促进开花[56],35S:miR159a过表达拟南芥(Landsberg型)在短日照(SD)下延迟开花,花中的MYB33和LFY表达下降,推测是MYB33调控LFY下降从而延迟开花[57];小麦Ubi∷TamiR159异源过表达水稻开花延迟[48];在葡萄中通过外源性GA处理实验表明miR159裂解VvGAMYB进而抑制VvGAMYB下游的VvLFY的表达来抑制开花[58];在大岩桐中miR159调控GAMYB影响了其下游有关开花的SsLEAFY和3个MADS-box基因即SsAP1(APETALA1),SsAP3,SsAG基因的表达,在短日照条件下35S:miR159a过表达导致大岩桐开花延迟,35S:MIM159中miR159被抑制则导致大岩桐开花提前[32];在番茄中,SlMYB33-RNAi番茄表现为开花延迟[43]。这些表明GAMYB促进植物开花,而miR159通过抑制GAMYB进而抑制植物开花。
然而,Schwab等[59]发现35S:miR159a过 表达拟南芥(Columbia型)花中没有表现MYB33、MYB65的水平降低,且没有开花时期的变化。在短日照下mir159ab拟南芥(Columbia型)表现为开花延迟(可能有mir159ab拟南芥营养生长缺陷的影响),myb33myb65拟南芥开花时间与野生型一样,这些说明MYB33和MYB65并不会促进或者是抑制开花[19]。MIM159烟草与mir159ab拟南芥一样表现为植株矮小、叶片又小又皱等营养生长缺陷和开花延迟[21]。mMYB33拟南芥和外源性赤霉素处理野生拟南芥(Landsberg型)导致的MYB33过表达只是轻微提前开花[57]。张波等[55]对番茄SlGAMYB进行过表达转化,发现SlGAMYB过表达番茄开花延迟,推测可能是因为剂量效应,即SlGAMYB的过量会起到反效果。以上这些说明GAMYB可能抑制开花,这与GAMYB普遍表现为促进开花相矛盾。
miR159-GAMYB在开花调控中存在较大差异,尤其是GAMYB的功能差异,这可能是亚型的差异、其他调控机制[60]的影响或是其他原因还尚不得知。植物开花诱导是一个及其复杂的调控过程,miR159-GAMYB调控植物开花诱导的分子机理还需进一步研究。
在 拟 南 芥[24-25]和 大 岩 桐[32]中,miR159-GAMYB途径还调控植物花器官发育。这些说明,miR159-GAMYB途径对植物生长发育的各个过程有着重要作用(表1),因此研究miR159-GAMYB的调控机理、生物功能等有着极高的价值、意义和广泛的前景。
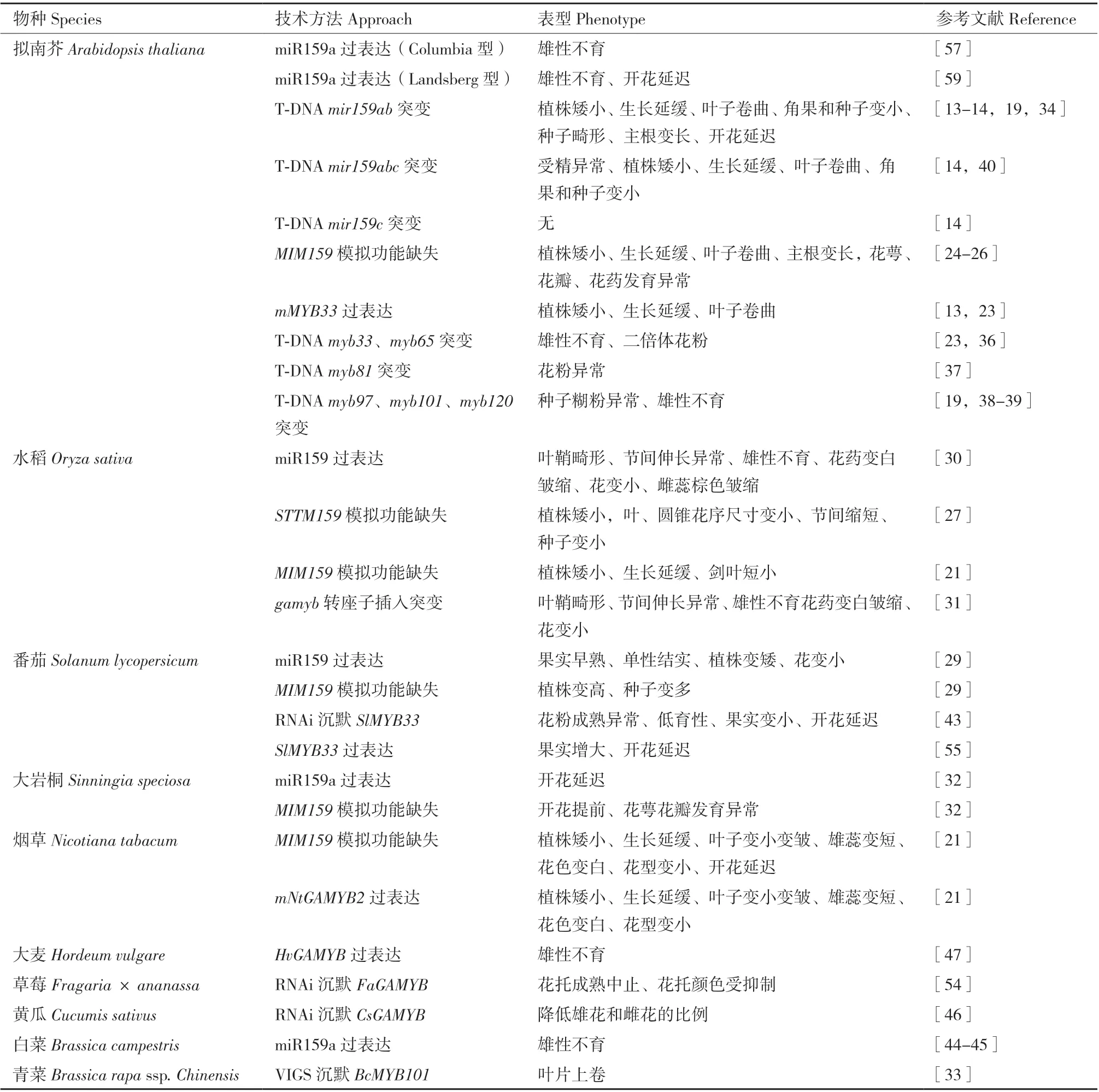
表1 miR159-GAMYB途径调控植物生长发育研究进展Table 1 Research progress of miR159-GAMYB pathway regulating plants growth and development
3 miR159-GAMYB途径参与植物逆境胁迫响应
3.1 miR159-GAMYB参与植物生物胁迫响应
miR159-GAMYB途径响应病原菌感染。最近的研究发现在百合(Lilium regale)中,Lre-miR159a抑制其靶基因LrGAMYB来响应植株抵御灰霉菌(Botrytis elliptica),对拟南芥进行异源过表达发现Lre-MIR159a拟南芥比野生型和LrGAMYB拟南芥(比野生型对灰霉菌感染更敏感)对灰霉菌有更强的抵御能力,Lre-MIR159a拟南芥中MYB33/65的水平下降,进一步分析发现Lre-MIR159a拟南芥中茉莉酸和水杨酸相关的基因表达上升,包括AtPR1(ATHOGENESIS-RELATED PROTEINS),AtPR2,AtNPR1(NONEXPRESSOR OF PATHOGENESISRELATED),AtPDF1.2(PLANT DEFFINSIN1.2)和AtLOX(LIPOXYGENASE)[61]。在烟草中,miR159-GAMYB响应疫霉菌(Phytophthora parasitica)感染,Zheng等[21]发现MIM159烟草比野生型显著增强了对疫霉菌的抵抗力,进一步分析发现MIM159烟草和mNtGAMYB烟草叶片中关于防御响应的PRs等基因显著上升,但是在MIM159拟南芥、MIM159水稻和mGAMYB(mAtMYB33、mOsGAMYB、mLaGAMYB和mNtGAMYB)拟南芥中PRs基因并没有明显变化,说明这种胁迫的分子调控机制并不具有保守性。
miR159-GAMYB途径响应根结线虫。植物受病原刺激或虫害而出现的局部增生叫做虫瘿,感染根结线虫拟南芥的根部虫瘿中miR159表达上升,MYB33∷GUS只在虫瘿早期表达而在后期则无表达,说明了miR159调控MYB33响应根结线虫,并且拟南芥mir159abc三突变体能显著增强对根结线虫的抵抗力[62]。miR159-GAMYB响应根结线虫的机理还需深入研究。
病毒感染可以破坏拟南芥miR159的活性并造成与mir159ab拟南芥相似的生长缺陷。研究表明非洲木薯(Manihot esculenta)花叶病毒编码的AC4蛋白[63]和黄瓜花叶病毒编码的CMV(Cucumber mosaic virus)2b蛋白[64]可以与拟南芥miR159相结合,阻 止miR159对MYB33和MYB65的 调 控,MYB33和MYB65的表达上升。Li等[65]用编码沉默抑制蛋白P0的病毒构建了35S-P0过表达拟南芥,发现35S-P0拟南芥表型与mir159ab相似,进一步研究发现莲座叶中MYB33/65表达上升,但是表达量只有几倍上升,说明病毒蛋白的沉默效果不是很强。
3.2 miR159-GAMYB参与植物非生物胁迫响应
miR159-GAMYB响应干旱胁迫。在种子萌发中,ABA水平下降来促进种子萌发成苗,研究表明ABA-miR159-GAMYB通路影响种子萌发,在干旱条件下,拟南芥种子中miR159响应ABA并且表达量上升,MYB33和MYB101水平下降,进一步研究发现MYB33和MYB101对ABA敏 感,而miR159通过抑制MYB33和MYB101来响应非生物胁迫,进而影响种子萌发[66]。在马铃薯(Solanum tuberosum)中,干旱胁迫下miR159表达下降GAMYB表达上升[67]。对 小 麦 的miR159和TaGAMYB1进 行 水 稻异源过表达,发现Ubi∷miR159水稻比野生型对干旱胁迫更敏感,表现为植株枯萎和生长缓慢,而Ubi∷mTaGAMYB1水稻无明显变化,说明小麦
miR159裂解水稻OsGAMYB参与干旱胁迫响应,进一步研究发现,myb33myb65拟南芥在干旱胁迫下与Ubi∷miR159水稻的表型相似,对干旱胁迫敏感[48]。这些说明miR159-GAMYB途径响应干旱胁迫在植物间并不具有功能保守性。在盐胁迫下,miR159的响应在不同植物间也出现了差异[68],这其中的机理尚不清楚。
miR159在拟南芥营养组织中强烈沉默MYB33/65,且这种机制不受任何胁迫的影响。在ABA、干旱、寒冷、高温等胁迫下,mir159abmyb-33myb65拟南芥与野生型一样无响应,而且进一步研究表明这些胁迫无法抑制野生型拟南芥miR159从而使MYB33和MYB65表达[65]。拟南芥营养组织中miR159-GAMYB途径响应非生物胁迫的机理还尚不清楚。
4 miR159-GAMYB调控体系
miR159-GAMYB途径在植物中高度保守,miR159通过裂解靶基因GAMYB在植物生长发育、逆境胁迫、信号传导等有着重要作用。然而越来越多的研究表明,miR159-GAMYB还与其他众多途径相互影响,比如脱落酸(ABA)[66]、赤霉素(GA)等激素的调控,与其他microRNAs间的联合互作,GAMYB-likes间的二级调控[14]等。这对全面了解miR159-GAMYB途径的功能和机理有着重要作用。
4.1 GA-miR159-GAMYB信号通路
赤霉素(gibberellins,GAs)是一种普遍存在于高等植物的二萜羧酸类化合物,是一类重要的植物激素,目前发现的100余种赤霉素中只有少量具有活性,如GA1、GA3、GA4、GA7等[69]。赤霉素几乎参与植物所有的生长发育过程,包括种子萌发、幼苗生长、根茎叶的伸长生长、花期、花器官发育和果实成熟等[70]。近些年分子生物学的发展表明GA信号通路的主要调控路径为GA-GID1-DELLA[71-72],这种模式在维管束植物中是高度保守的[71],其中GID1(GIBBERELLIN INSENSITIVE DWARF1) 是GA的受体蛋白,DELLA蛋白是一类阻遏蛋白,属于GRAS蛋白家族且广泛分布于植物中,是GA信号中的抑制子。拟南芥基因组中含有5个DELLA蛋 白 成 员,分 别 是GA-INSENSI-TIVE(GAI)、REPRESSOR-OF-GAL-3(RGA)、RGA-LIKE1(RGL1)、RGL2和RGL3,水稻中只有1个DELLA成员,即SLENDER RICE1(SLR1)[73]。GA通 过GID1蛋 白和DELLA蛋白结合成GA-GID1-DELLA三聚体复合物,从而调控植物生长发育。当GA浓度较低时,受体GID1不与GA结合,DELLA蛋白则与调控植物生长发育的转录因子结合,抑制植物生长发育。当GA浓度较高时,GA-GID1-DELLA形成三聚体来抑制DELLA蛋白的阻遏作用,同时促进DELLA蛋白与泛素E3连接酶复合体(SCFSLY1/GID2)结合,导致DELLA蛋白泛素化,随之被26S蛋白酶降解掉,从而消除DELLA蛋白对植物生长的抑制作用[74]。
4.1.1 GA-GAMYB信号通路 GAMYB与GA有着紧密的关系,因为在大麦种子中这类MYB基因编码的MYB转录因子可以结合在GA信号下游基因(包括细胞程序性死亡、水解酶等相关基因)启动子GARE元件中的TAACAA/GA序列上,进而激活这些基因的表达,所以命名为GAMYB[9]。GA-GAMYB途径还存在拟南芥[19]和水稻[30,41]种子糊粉中,番茄种子胚、胚乳[51]和子房[29]中,拟南芥[36]、水稻[30,41]、大麦[47]等植物花药中,黄瓜花芽[46]中,青菜[33]中等。但是在拟南芥营养组织中,GAMYB不响应GA信号,GAMYB不参与拟南芥GA信号调控开花[19]。
在种子糊粉细胞和花药绒毡层中,GAMYB响应GA信号促进细胞程序性死亡。GA通过DELLA类蛋白进而调控种子和花药中的GAMYB,包括拟南芥RGA、GAI蛋白[36],水稻SLR1蛋白[30,41],大麦SLN1(SLENDER1)蛋 白[47]等,GA-DELLAGAMYB通路表现为GA通过解除DELLA蛋白的抑制作用进而促进GAMYB的表达。在番茄子房中,GA可能通过生长素来调控SlGAMYB[29]。
Aya等[75]分析进化起源中GA与GAMYB的关系,发现GA调控通路可能起源于GAMYB调控通路,在苔藓(Physcomitrella patens)(缺少GA信号通路)中,其GAMYB同源基因的敲除产生了不正常的孢子,不能形成雄性器官,而是形成异常的雄性器官;在中国石松(Selaginella moellendorffii)中,GA处理能够促进小孢子外壁的形成,通过GA合成抑制则干扰其发育,由这种功能的相似性推测出GAMYB调控系统先于GA感应系统。
4.1.2 GA-miR159信号通路 miR159响应GA信号通路目前还存在很多差异,这其中包括不同种和不同品种间的差异和同一物种不同种类miR159的响应差异。
在水稻[30]和拟南芥[19]中,miR159不响应GA信号,但是葡萄[52,58,76-77]、草莓[53]、大麦[57]等植物的miR159响应GA信号。在葡萄品种(Vitis vinifera L.‘Wink’)中,GA处 理 导 致VvmiR159水平下降,VvGAMYB水平上升[77],而在葡萄品种“醉金香”中,GA处理导致VvmiR159c水平上升,VvGAMYB水平显著下降[52]。这些说明miR159响应GA信号存在物种间和品种间的差异。在‘白罗莎里奥’葡萄(Rosario Bianco)中,外源赤霉素处理后除VvmiR159b在果肉中被GA3上调表达外,VvmiR159a/c在果皮、果肉中被GA3处理后均下调其表达[76]。“醉金香”葡萄中,外源赤霉素处理发现VvmiR159c在整个开花期间表达上升,但是VvmiR159a/b却无明显变化[52]。在草莓花托中,VvGAMYB受到miR159b的调控,外源性GA处理导致Fa-MIR159a显著降低,而Fa-MIR159b无明显变化,VvGAMYB无明显变化[53]。这些表明在同一物种中不同miR159响应GA信号有差异。
研究发现GA通过DELLA类蛋白调控miR159,这其中包括葡萄、大麦等植物。在葡萄中,外源赤霉素处理导致VvmiR159c表达上升,两类编码DELLA类 蛋 白 的VvSLR1和VvRGL1基 因 表 达 显著下降,说明GA通过解除DELLA类蛋白来促进VvmiR159c表达[52]。在大麦中,GA解除DELLA蛋白SLN1的抑制作用来促进大麦miR159的表达[57]。
4.2 microRNAs联合调控机制
miR159-GAMYB途 径 与 另 一 种microRNA即miR319及其靶基因TCP(TEOSINTE BRANCHED1、CINCINNATA、PROLIFERATING CELL FATOR)有联合互作关系。在拟南芥中miR159与miR319有高度的相似性,其21个核苷酸有17个核苷酸相同,miR319可以调控miR159的靶基因GAMYB,但是miR159却不能调控miR319的靶基因TCP,不过miR319调控GAMYB的作用非常弱,而且相对于miR159在植株中广泛大量表达,miR319在植株中表达丰度低且范围小[14,78-79],这也表明miR159在进化上与miR319的紧密关系[22,45]。在MIM159拟南芥中除植株矮小、叶子上卷变圆、节间缩短等表型缺陷外,还出现了花萼花瓣小发育不完整,花小,花药发育不完整,并且这与MIM319拟南芥的表型缺陷相似[24-25],进一步研究表明,TCP4和MYB33转录因子可以独立或者互作形成异源二聚体激活MIR167A的启动子,miR159和miR319通过抑制MYB33和TCP4进而抑制miR167的表达,从而促进miR167与花发育相关的靶基因ARF6/8(AUXIN RESPONSE FACTOR)的表达,进而调控植物花器官发育[25],这说明了miR159-miR319-miR167联合调控植物花器官发育。在番茄中,miR159-SlGAMYBmiR167-SlARF8调控子房发育和坐果[29]。
植物营养生长幼年向成年转变是植物发育的重要过程之一,是植物开花生殖生长的基础,植物的营养阶段转变受到保守的miR156-SPLs(SQUAMOSA PROMOTER BINDING PROTEIN-LIKE)途 径 的 调控。研究表明miR156-SPL-miR172联合调控植物营养阶段转变,在幼苗时期,miR156的表达非常高,miR172的表达非常低,随着植物生长,miR156的表达逐渐降低,其靶基因SPL9和SPL10的表达上升,SPL9/10转录因子可以结合在miR172的启动子上来激活其表达,miR172的表达上升,进而完成营养生长从幼年到成年的转变[80]。Guo等[60]发现mir159ab拟南芥延迟了营养生长且miR156的表达量上升,进一步的研究表明miR159的靶基因MYB33可以结合在MIR159A、MIR159C及它们的靶基因SPL9的启动子上来促进这些基因的表达进而调控植物的营养生长转化,这些说明了miR159-MYB33可以调控下游的miR156和SPL基因发育来调控营养生长转化。miR156-SPL途径还可以调控植物由营养生长向生殖生长转变[81]。这些为miR159-GAMYB途径调控花期提供参考,比如mir159ab拟南芥花期延迟。
5 总结与展望
miR159-GAMYB途径对植物生长发育(图1)和胁迫响应有着重要意义,其中营养生长、雄性生殖、种子育性和萌发、果实发育和胁迫响应方面的调控对农作物高产和抗逆培育有着重要参考价值,花期调控、花器官发育和营养生长方面的调控为观赏植物培育提供了新思路。目前基于此类的研究多在模式植物中开展,受限于转基因遗传转化技术等条件的制约,在其他一些经济作物和园艺观赏植物中研究缓慢,这是今后研究的一个重要方向。

图1 miR159-GAMYB途径调控植物生长发育功能分析Fig.1 Function analysis of miR159-GAMYB pathway regulating plants growth and development
当下研究中miR159-GAMYB调控途径还有很多争论和问题:(1)拟南芥营养组织(不包括根)中MYB33/65的表达抑制营养生长,这其中引起了什么下游事件?激活了什么下游基因?miR159强烈裂解沉默MYB33/65来保证正常营养生长发育,这种看似多余的调控机制有何生物学意义?GAMYB在拟南芥根和茎叶中功能完全相反,这其中的机理是什么?(2)虽然众多研究表明GAMYB抑制植物营养生长,但是GAMYB这种功能是否具有保守性?为什么MIM159番茄的植株更高、MIM159大岩桐无明显营养生长缺陷?目前miR159-GAMYB调控植物开花还尚有很多争论,GAMYB在开花诱导上的功能是什么?(3)miR159和GAMYB在拟南芥种子中共表达,miR159对GAMYB微调的机理是什么(这种微调作用也存在众多其他植物组织中)?mir159ab拟南芥产生了畸形种子,miR159-GAMYB对畸形种子形成的调控机理是什么?(4)MYB33/65的mRNA独特二级结构是如何让miR159沉默MYB33/65?这其中的作用机制是什么?(5)目前miR159-GAMYB响应逆境胁迫的研究多是集中在形态学和简单的分子学分析上,其中miR159响应逆境胁迫的机理还尚不明确。(6)miR159响应GA信号表现出巨大的差异,包括不同miR159的响应差异及组织和物种间差异,这种差异的分子机理是什么?有何生物学意义?
miR159-GAMYB调控途径需要很多完善和补充,其中了解更多的miR159-GAMYB上下游基因、更多层次的调控网络和完善准确的调控机理尤为重要。
