纳米粒子载体对灰飞虱RNAi效率的影响
2021-11-06朱先敏张海波韩召军杨荣明王康旭1
周 晨, 朱先敏, 朱 凤, 张海波, 韩召军, 杨荣明,*, 王康旭1,,*
(1. 南京财经大学食品科学与工程学院, 江苏省现代粮食流通与安全协同创新中心, 南京 210023;2. 江苏省植物保护植物检疫站, 南京 210036; 3. 南京农业大学植物保护学院, 南京 210095)
灰飞虱Laodelphaxstriatellus是一种极具破坏性的水稻害虫,给我国水稻生产造成了严重的损失,影响了我国粮食和食品安全(程家安等, 2008)。目前最普遍的灰飞虱控制策略是在水稻生长期内施加化学杀虫剂,但是灰飞虱对现有的主要杀虫剂已经发展出较高水平的抗药性,降低了化学防治对于灰飞虱的有效性(徐鹿等, 2018)。因此,探寻防治有效而环保的灰飞虱的防治方法具有重要意义。RNA干扰(RNA interference, RNAi)是由双链RNA (double-stranded RNA, dsRNA)引发的转录后基因沉默现象(Tsaietal., 2015)。该技术通过抑制必需基因的表达能够导致害虫适应性下降和死亡,进而在害虫防治领域显示出巨大潜力(Maoetal., 2007; Zhu and Palli, 2020)。由于灰飞虱基因组数据已解析(Zhuetal., 2017),使得有更多的基因功能需要被注释,同时也产生了许多RNAi候补靶标基因可以用于灰飞虱的防治,因此RNAi技术在灰飞虱功能基因组学和虫害防治领域展现出极大的应用前景。其中,dsRNA喂食是最具经济效益的dsRNA递送方式,可直接用于虫害防治(Yang and Han, 2014; Zottietal., 2018)。然而在灰飞虱研究中,大量的数据表明,相较于dsRNA注射,dsRNA喂食产生的 RNAi效率较低(张倩等, 2012; Jiaetal., 2015),这直接影响了RNAi技术在灰飞虱害虫防治中的应用。目前的研究发现,dsRNA在害虫体内的快速降解和低效的细胞吸收能力可能是导致部分昆虫RNAi敏感性较低的重要因素(Garbuttetal., 2013; Luoetal., 2013; Renetal., 2014; Wynantetal., 2014)。因此发展可靠的喂食递送方法,提高dsRNA的体内稳定性和细胞吸收能力是实现RNAi技术在灰飞虱防治应用的关键。
纳米粒子(nanoparticle, NP)介导的RNAi防治逐渐发展成为害虫防治中的热点。Whyard等(2009)发现被脂质体(liposomes)包裹的dsRNA在喂食后可以在不同的果蝇品种中产生高效RNAi效应。在亚洲玉米螟Ostriniafurnacalis中,一种阳离子荧光纳米粒子(FNP)介导的喂食RNAi可以有效地沉默亚洲玉米螟关键发育基因的表达,产生高致死率(Heetal., 2013)。在大豆蚜Aphisglycines中,Zheng等(2019)利用聚合物携带dsRNA突破了害虫体壁屏障。在冈比亚按蚊Anophelesgambiae中,壳聚糖(chitosan)能够显著提高试虫对于喂食dsRNA的敏感性(Zhangetal., 2010)。然而在半翅目昆虫中,尤其是飞虱科害虫中很少有关于纳米粒子介导的RNAi实验报道,因此本研究选择灰飞虱为研究对象,探索纳米载体对其RNAi效率的影响。本研究通过应用纳米粒子介导的dsRNA喂食对灰飞虱若虫进行RNAi,对3种代表性纳米粒子[壳聚糖,碳量子点(carbon quantum dot, CQD)和脂质体(lipofectamine 2000)]介导的dsRNA喂食,在基因沉默和防控中的效率进行系统性比较,初步确定了针对灰飞虱的dsRNA高效纳米递送载体,为基于RNAi的害虫防控奠定了基础。
1 材料与方法
1.1 供试昆虫
本实验采用的灰飞虱品系采自江苏兴化田间,室内用稻苗饲养。养虫室温度为28±1℃,相对湿度维持在65%~70%,光周期为16L∶8D。灰飞虱RNAi实验从初孵若虫阶段开始统一收集,待其长至2龄若虫后,用于后续dsRNA喂食处理。
1.2 总RNA提取和cDNA合成
20头灰飞虱若虫虫体经过液氮研磨后,利用RNeasy Mini Kit试剂盒进行总RNA的提取,利用NanoDrop ND-1000测定其浓度,利用2%的琼脂糖凝胶电泳检测核酸质量,总RNA样品于-80℃超低温冰箱内保存待用。利用反转录试剂盒(PrimeScriptTMRT Reagent Kit)进行反转录合成cDNA第1链,保存于-20℃冰箱内待用。
1.3 dsRNA的合成
根据已知的灰飞虱膜结合型海藻糖酶基因LsStre序列(GenBank登录号: JQ027051)设计引物,扩增产物克隆入载体,以测序正确的重组质粒DNA作为模板,采用300~400 μL的体系进行PCR扩增,产物用1.5%的琼脂糖凝胶进行电泳分离,回收模板DNA条带,选择Wizard SV Gel and PCR Clean-Up System回收试剂盒进行模板纯化,用T7 RiboMAXTMExpress RNAi System试剂盒体外合成dsRNA,利用NanoDrop ND-1000测定dsRNA的浓度。同时以绿色荧光蛋白基因(Egfp)为模板,以相同方法合成对应dsEgfp作为对照组。最后,用于喂食灰飞虱的dsRNA分别为dsLsStre(420 bp)以及对照dsEgfp(414 bp),用于dsRNA合成的特异性引物见表1。

表1 本研究使用的引物Table 1 Primers used in this study
1.4 NP-dsRNA复合物的制备
使用Zhang等(2010)描述的方法准备壳聚糖包裹的dsRNA复合物。将≥75%脱乙酰化壳聚糖溶解于0.1 mol/L醋酸钠中配成0.02% (m∶v)壳聚糖溶液,再将100 μL壳聚糖溶液加入100 μL含有32 μg dsRNA的硫酸钠溶液之中,55℃孵育1 min后迅速在涡旋仪上高速涡旋30 s形成壳聚糖/dsRNA颗粒。使用微波法制备CQD(Dasetal., 2015)。将9 mL的PEG-200加至2 mL去核酸酶水中,再将100 mg PEI溶于2 mL去核酸酶水后同制好的PEG溶液混匀,再放入微波炉中800 W处理3 min,CQD和含有dsRNA的硫酸钠在4℃下进行过夜孵育,CQD与dsRNA的比例为20∶1(v/v)。将dsRNA同lipofectamine 2000混匀和处理得到dsRNA-脂质体复合物。为了测定这几种NP的包裹效率,将NP-dsRNA复合物在21 000 g下离心30 min,使用光谱仪测量上清中dsRNA含量。通过比较起始dsRNA与上清中残存的dsRNA含量,计算与NP形成复合物的dsRNA所占百分比(即dsRNA装载率)。
1.5 dsRNA喂食
利用褐飞虱人工饲料饲养方法进行灰飞虱dsRNA喂食处理(张倩等, 2012)。首先将双通管(12 cm×3 cm)一端用细纱布封口,之后将25~30头的2龄初期灰飞虱若虫吸至管内,将封口膜(parafilm)拉伸后封住双通管,再将50 μL包含1.75 μg dsEgfp或dsLsStre的NP-dsRNA液体饲料吸打在封口膜上,之后再用另一块封口膜贴在包含dsRNA的液体饲料上重复封口,使得双通管一端形成饲料膜包;将双通管横放在养虫架上,用湿润的黑布将其包裹,露出带有饲料的一端,利用趋光性让灰飞虱进行取食。每天更换饲料,并使用细头毛笔挑出死虫进行记录数据,连续记录6 d数据。每个处理进行5次独立重复实验,每次实验设3~5管重复。
1.6 靶基因表达量的qPCR分析
使用实时荧光定量PCR(qPCR)检测靶标基因LsStre的表达水平来评价RNAi效果。选用喂食处理2 d后的试虫将其保存在液氮内,进行总RNA提取和cDNA合成,利用AceQ qPCR SYBR Green Master Mix进行qPCR测定。反应程序:95℃ 30 s; 95℃ 5 s, 60℃ 34 s, 40个循环。内参基因为β-actin(Act)。每个样品至少设置5组生物学重复,每组进行3次技术重复测定。采用2-ΔΔCt方法计算基因的相对表达水平,dsEgfp被用作阴性对照来计算dsRNA产生的RNAi效率。qPCR中使用的引物见表1,靶标基因LsStre和内参基因Actin的qPCR引物的扩增效率分别为96.4%和93.5%。
1.7 数据分析
使用GraphPad 8.0软件进行统计分析和作图,qPCR数据以平均数±标准误进行表示,mRNA相对表达量采用单因素方差分析,并进行Tukey氏检验。采用Abbott公式(刘影等, 2008)计算试虫的校正死亡率,其中,以喂食dsEgfp的为对照对无载体递送的裸dsLsStre进行校正,以不同NP-dsEgfp喂食为对照对相应NP-dsLsStre喂食处理组进行校正计算,公式如下:
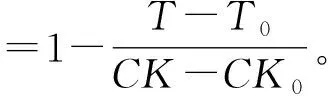
式中:T0为喂食dsLsStre灰飞虱的初始数量,T为喂食dsLsStre灰飞虱的终期数量,CK0为喂食dsEgfp灰飞虱的初始数量,CK为喂食dsEgfp灰飞虱的终期数量。
之后,利用如下公式来计算不同纳米载体的增效系数,其中,增效系数大于1.6的为增效作用(Jonkeretal., 2005)。

2 结果
2.1 NP-dsEgfp复合体的制备
本研究首先以Egfp基因为模板合成的dsEgfp,再将dsEgfp与不同的纳米粒子复合制成不同组合的NP-dsEgfp复合体。NP-dsEgfp复合物离心后,使用光谱仪测量上清中dsEgfp含量。通过比较起始dsEgfp与上清中残存dsEgfp含量,测定纳米材料对dsEgfp的包裹装载能力。结果表明,不同纳米载体的dsEgfp装载率都在95%以上(图1: A)。另外,由于很多纳米粒子对生物体都存在潜在的毒性,因此我们向灰飞虱2龄若虫喂食含有不同NP-dsEgfp复合物的人工饲料和含有相同含量dsEgfp的人工饲料。通过连续喂食实验,在处理7 d后对不同处理组的死亡率进行比较,发现各组间死亡率无显著差异(P>0.05),表明这3种纳米载体对灰飞虱2龄若虫的毒性均较小(图1: B)。
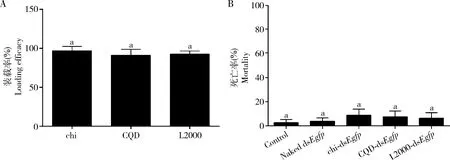
图1 不同纳米粒子的dsEgfp装载率(A)及不同纳米粒子介导dsEgfp喂食处理7 d后灰飞虱2龄若虫的死亡率(B)Fig. 1 dsEgfp loading efficacy of different nanoparticles (NPs) (A) and mortality of the 2nd nymphs of Laodelphax striatellusfeeding with dsEgfp mediated by different NPs for 7 d (B) chi: 壳聚糖Chitosan; CQD: 碳量子点Carbon quantum dots; L2000: Lipofectamine 2000; Control: 空白对照Blank control; Naked dsEgfp: 未用纳米粒子包裹的dsEgfp (dsEgfp not encapsulated with nanoparticles); chi-dsEgfp: 壳聚糖包裹的dsEgfp (dsEgfp encapsulated with chitosan); CQD-dsEgfp: 碳量子点包裹的dsEgfp (dsEgfp encapsulated with carbon quantum dots); L2000-dsEgfp: Lipofectamine 2000包裹的dsEgfp (dsEgfp encapsulated with lipofectamine 2000). 图中数据为3次重复的平均值±标准误;柱上相同小写字母代表不同处理之间差异不显著(P>0.05, Tukey氏检验)。Data in the figure are mean±SE of three replications. The same lowercase letters above bars indicate no significant difference between different treatments (P>0.05, Tukey’s test).
2.2 喂食NP-dsLsStre复合体后靶标基因表达量变化
将NP-dsLsStre复合物同灰飞虱人工饲料混合,分别利用裸dsEgfp和添加了NP-dsEgfp的人工饲料作为对照,保证人工饲料中dsRNA含量为35 ng/μL。由于在开始喂食后2~3 d灰飞虱的死亡情况出现明显增加,因此选择在开始dsRNA处理后的第2天对靶标基因LsStre的mRNA水平进行检测(图2)。qPCR数据表明,同喂食dsEgfp的对照组相比,使用无载体递送的dsLsStre喂食后的灰飞虱2龄若虫中LsStre表达量的抑制率为46%,而使用壳聚糖和CQD包裹后的dsLsStre能够显著增强LsStre的RNAi效率,对LsStre表达量的抑制率分别达到78%和84%;与此同时,由lipofectamine 2000介导的dsLeStre喂食对LsStre表达量的抑制率为52%,分析可知,脂质体lipofectamine 2000不能显著提高LsStredsRNA的RNAi效率。
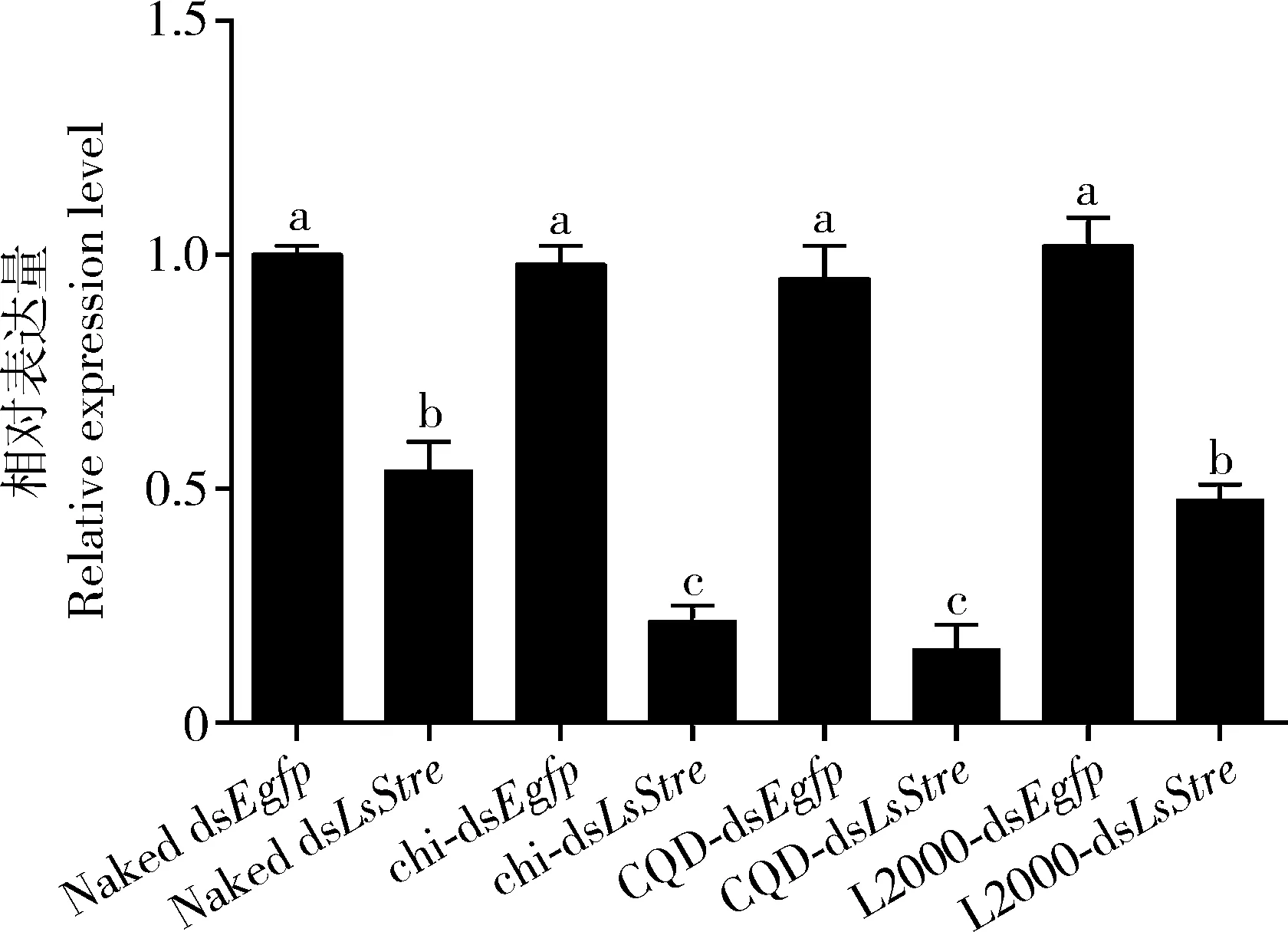
图2 不同纳米粒子介导dsRNA喂食2 d后灰飞虱2龄若虫中的LsStre相对表达量Fig. 2 Relative expression levels of LsStre in the 2nd nymphs of Laodelphax striatellus after feeding with dsRNA mediated by different nanoparticles (NPs) for 2 d Naked dsEgfp: 未用纳米粒子包裹的dsEgfp (dsEgfp not encapsulated with nanoparticles); chi-dsEgfp: 壳聚糖包裹的dsEgfp (dsEgfp encapsulated with chitosan); CQD-dsEgfp: 碳量子点包裹的dsEgfp (dsEgfp encapsulated with carbon quantum dots); L2000-dsEgfp: Lipofectamine 2000包裹的dsEgfp (dsEgfp encapsulated with lipofectamine 2000); Naked dsLsStre: 未用纳米粒子包裹的dsLsStre (dsLsStre not encapsulated with nanoparticles); chi-dsLsStre: 壳聚糖包裹的dsLsStre (dsLsStre encapsulated with chitosan); CQD-dsLsStre: 碳量子点包裹的dsLsStre (dsLsStre encapsulated with carbon quantum dots); L2000-dsLsStre: Lipofectamine 2000包裹的dsLsStre (dsLsStre encapsulated with lipofectamine 2000). 图中数据为 3 次重复的平均值±标准误;柱上不同小写字母代表不同处理之间差异显著(P<0.05, Tukey 氏检验)。Data in the figure are mean±SE of three replications. Different lowercase letters above bars indicate significant difference between different treatments (P<0.05, Tukey’s test).
2.3 NP-dsLsStre复合体介导的灰飞虱致死效应
通过连续喂食实验,利用2龄灰飞虱若虫来研究不同NP-dsLsStre复合物喂食后的致死情况。采用NP-dsEgfp作为对照来计算NP-dsLsStre引起的校正死亡率。如图3所示,在NP-dsLsStre开始喂食的2 d后,壳聚糖、CQD和lipofectamine 2000介导的2龄若虫的校正死亡率分别为23%, 19%和9%;4 d后,校正死亡率分别上升到53%, 64%和22%;而在连续喂食第6天2龄若虫的校正死亡率则分别达到76%, 82%和38%。而使用无载体递送的裸dsLsStre喂食6 d后所导致的2龄若虫校正死亡率则为35%。计算可知,喂食6 d后,壳聚糖、CQD和lipofectamine 2000介导的致死增效系数分别为2.17, 2.34和1.09。结果表明,同脂质体lipofectamine 2000相比,壳聚糖和CQD可以显著提高dsLsStre的致死效率。
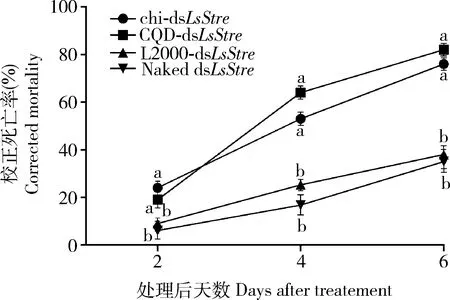
图3 用不同纳米粒子介导dsLsStre喂食处理6 d内灰飞虱2龄若虫的校正死亡率Fig. 3 Corrected mortality of the 2nd nymphs of Laodelphaxstriatellus feeding with dsLsStre mediated by different nanoparticles (NPs) within 6 d Naked dsLsStre: 未用纳米粒子包裹的dsLsStre (dsLsStre not encapsulated with nanoparticles); chi-dsLsStre: 壳聚糖包裹的dsLsStre (dsLsStre encapsulated with chitosan); CQD-dsLsStre: 碳量子点包裹的dsLsStre (dsLsStre encapsulated with carbon quantum dots); L2000-dsLsStre: Lipofectamine2000包裹的dsLsStre(dsLsStre encapsulated with lipofectamine2000). 图中数据为3 次重复的平均值±标准误;不同小写字母代表同一时间点不同处理之间差异显著(P<0.05, Kruskal-Wallis检验)。Data in the figure are mean±SE of three replications. Different lowercase letters indicate significant difference between different treatments at the same time point (P<0.05, Kruskal-Wallis test).
3 讨论
RNAi已经展示了在害虫防治方面的重要前景(Baumetal., 2007; Zhangetal., 2015),但是dsRNA在昆虫体内的快速降解和较低的细胞吸收效率,导致了昆虫RNAi效果不佳的问题,限制了这种新型害虫防治技术的进一步应用(Zhu and Palli, 2020)。研究表明,纳米粒子可以通过提高dsRNA体内持续性和跨膜运输能力增强了其在生物体内的活性(Wangetal., 2020)。然而RNAi增效载体在昆虫学研究中的范例较少,尤其在半翅目这种RNAi较为不敏感昆虫中的探索相对缺乏。因此,我们挑选了水稻上重要的半翅目害虫灰飞虱作为试虫,来系统性地测试纳米载体介导的RNAi的增效作用。团队前期研究发现,膜结合型海藻糖酶基因LsStre受抑制后会导致灰飞虱试虫的死亡(校正死亡率为39%)(张倩等, 2012)。在此基础上,我们利用纳米粒子壳聚糖、CQD以及lipofectamine 2000建立了纳米载体对RNAi干扰LsStre的增效评价系统。首先对3种纳米粒子的dsRNA包裹效率进行了检测,发现3种载体的dsRNA装载率均在95%以上(图1);之后,对纳米载体介导的LsStredsRNA喂食灰飞虱2龄若虫后LsStre的RNAi效率和对应的2龄若虫死亡率进行了比较研究,发现壳聚糖和CQD能够显著提高LsStre的RNAi效率(抑制率分别为78%和84%)(图2);同时在确认3种纳米粒子对灰飞虱若虫的毒性较弱后,我们发现壳聚糖和CQD大大提高了LsStredsRNA的致死效应,连续喂食6 d后灰飞虱若虫的校正后死亡率分别达到76%和82%(增效系数分别为2.17和2.34),而脂质体lipofectamine 2000的增效能力较弱(增效系数为1.09)(图3)。
纳米载体主要通过提高dsRNA体内稳定性和跨膜运输效率来影响RNAi效率(Patiletal., 2011; Gilleronetal., 2013; Madanietal., 2013; Mysoreetal., 2013; Rameshetal., 2016; Vermeulenetal., 2018)。目前对于纳米载体提高dsRNA在昆虫体内稳定性的机制较为清楚,研究表明,在东亚飞蝗Locustamigratoriamanilensis、德国小蠊Blattellagermanica和甜菜夜蛾Spodopteraexigua等害虫中(Luoetal., 2013),以脂质体为代表的递送载体可以通过保护dsRNA免受体液核酸酶的降解,显著提高了dsRNA在昆虫体内的半衰期(Linetal., 2017)。而目前对于跨膜增效现象的报道较多,例如在亚洲玉米螟和赤拟谷盗Triboliumcastaneum中,部分纳米载体能够显著提高dsRNA的细胞膜穿透性(Heetal., 2013; Avilaetal., 2018),同时在草地贪夜蛾Spodopterafrugiperda细胞系和二化螟Chilosuppressalis等害虫中,部分高效纳米载体还具有辅助dsRNA穿透胞内运输屏障,显著提升了dsRNA内体逃逸效率(Wangetal., 2020)。但是,纳米载体提高dsRNA跨膜运输能力的内在机制尚不明确(Cooperetal., 2019)。本研究中,我们发现在3种代表性纳米粒子中,脂质体的增效能力最弱,这同在二化螟中研究结果相似,而这可能是由于脂质体无法介导dsRNA完成内体逃逸过程所致(Wojnilowiczetal., 2019)。这表明不同纳米粒子的对于RNAi的增效机制存在明显差异,具体机制尚需进一步研究。
以dsRNA为基础的核酸农药被认为具有广泛应用的潜力。但是,稻飞虱等刺吸式口器害虫的喂食RNAi敏感性普遍较弱,限制了这一技术的应用,而唾液腺中核酸酶的快速降解可能是导致这一现象的关键 (Zottietal., 2018)。因此,可以提高喂食dsRNA在害虫体内的持续时间来增加害虫防治效果:其一是如本文所述,通过纳米粒子等递送介质的作用,保护dsRNA免受体内核酸酶的降解;其二是利用转基因技术将靶向害虫的dsRNA在作物中进行表达,以增加dsRNA的暴露时间,提高防治效果。同时,研究人员还发现dsRNA可能具有穿透蚜虫体壁从而产生RNAi效果的能力,而特定多聚物具有提高dsRNA穿透蚜虫表皮的能力(Zhengetal., 2019)。这些都表明在刺吸式害虫中,dsRNA可能兼具胃毒和触杀两种作用模式,后续研究需要进一步明确这两种方式下的dsRNA作用机理,以便开发出针对该类害虫的RNAi高效防治技术。
本研究发现,壳聚糖和CQD纳米载体能够显著提高灰飞虱对于喂食dsRNA的敏感性,而脂质体的RNAi增效作用较弱。研究结果有助于评价纳米载体在灰飞虱RNAi中的增效作用,为进一步开发和筛选有效的RNAi纳米载体,实现害虫绿色防控,提供理论依据和应用策略。
