乙基多杀菌素多代胁迫对西花蓟马解毒酶活性、发育和繁殖的影响
2021-11-06李定银郅军锐岳文波
李定银, 郅军锐, 张 涛, 岳文波
(贵州大学昆虫研究所, 贵州省山地农业病虫害重点实验室, 贵阳 550025)
西花蓟马Frankliniellaoccidentalis是世界范围内的重大害虫(Ullmanetal., 2012)。该虫不仅可通过锉吸植物汁液和产卵于植物组织内造成直接危害,还能传播多种病毒,例如番茄斑萎病毒(tomato spotted wilt virus, TSWV)和凤仙花坏死斑病毒(impatiens necrotic spot virus, INSV)等(Reitzetal., 2009; Websteretal., 2011)。对该虫的防治目前主要依赖于杀虫剂,但随之而来的抗药性问题日益凸显。在很多国家和地区,西花蓟马已对有机氯、有机磷、氨基甲酸酯和拟除虫菊酯等类型杀虫剂产生较高水平的抗性(Espinosaetal., 2005; Bielza 2008; Dlaminietal., 2019; Gao and Reitz, 2021),但对多杀菌素类、新烟碱类和印楝素等植物源杀虫剂的抗性相对较低(王圣印等, 2014; Otienoetal., 2016; 王彭等, 2017; 张治科等, 2019),尤其是多杀菌素类杀虫剂,在许多地方仍对西花蓟马具有较好的防治效果(Wang ZHetal., 2016)。
昆虫抗药性发展的内在生理机制主要是调节体内解毒酶活性来增强对杀虫剂的代谢能力,外在表现主要是种群适合度的改变(李培征等, 2014; 王芹芹等, 2017)。因此,昆虫体内的解毒酶如羧酸酯酶(CarE)和谷胱甘肽S-转移酶(GSTs)活性对杀虫剂的响应变化通常反映了昆虫解毒能力的强弱(Zhangetal., 2017; Tangetal., 2021)。以P450为主体构成的酶系多样,如细胞色素P450单加氧化酶(P450s)和多功能氧化酶(MFOs)等(Feyereisen, 1999),也有学者认为P450s是MFOs酶系的一个组成部分,存在于生物体某些细胞的光滑内质网上,参与多种杀虫剂以及其他外源性和内源性化合物代谢,同时也在昆虫的生长发育和对环境的适应性方面起着非常重要的作用(冯纪年等, 2004; Feyereisen, 2011)。例如,对拟除虫菊酯类杀虫剂产生抗性的二斑叶螨Tetranychusurticae和草地小爪螨Oligonychuspratensis体内酯酶活性显著升高(Yangetal., 2002);烟蚜Myzuspersicae体内MFOs和CarE活性与杀虫剂敏感性间存在明显的负相关性(李勇和何林, 2016);西花蓟马抗噻虫嗪种群体内MFOs, P450s和CarE活性均显著高于敏感种群(马绍智, 2013)。此外,昆虫抗药性发展还常与杀虫剂对昆虫具有亚致死效应有关,在杀虫剂选择压力下存活下来的昆虫,其生长发育、繁殖力和抗性会发生改变,且这种改变还具有一定的遗传效应,进而影响昆虫种群的发展(韩文素等, 2011; 杨广明等, 2016)。
乙基多杀菌素(spinetoram)是多杀菌素的换代产品(Sparksetal., 2008; 华乃震, 2015),其作用机理是干扰昆虫神经中烟碱型乙酰胆碱受体(nAChR)和γ-氨基丁酸受体(GABAR),影响正常的神经活动,直至死亡(Orretal., 2009)。该药剂具有杀虫谱广、活性高、易降解、对非靶标生物毒性低、抗性风险低等优点,既具备生物农药的安全性,又具有化学农药的快速杀虫效果(柴洪新等, 2011; 武怀恒等, 2016)。乙基多杀菌素对蓟马(Renkemaetal., 2020; Gaoetal., 2021)、害螨(Wang Letal., 2016)和鳞翅目害虫(张丽丽, 2014)等都具有较好的防治效果。但乙基多杀菌素在长期使用后,仍然没有避免靶标害虫的抗药性发展,例如在我国北京和云南等地区西花蓟马对乙基多杀菌素已产生较高水平的抗性,且抗性仍在逐年增加(侯文杰, 2012; 万岩然等, 2016),但在山东(马凯悦, 2017)和宁夏(张治科等, 2019)等地区作物上西花蓟马抗性相对较低。不同昆虫或同一昆虫不同解毒酶对多杀菌素类杀虫剂的代谢响应存在明显差异,例如抗多杀菌素的西花蓟马品系,其体内CarE, GSTs和MFOs活性显著高于敏感品系(龚佑辉等, 2009);乙基多杀菌素对小菜蛾体内MFOs活性具有明显的抑制作用,对CarE活性的影响具有明显的时间效应(田雪莲等, 2016)。
乙基多杀菌素对蓟马的防效可达99%以上,且不易与其他杀虫剂产生交互抗性(刘勇等, 2012; 王彭等, 2017),是防治蔬菜上西花蓟马的首选药剂之一。关于乙基多杀菌素短时处理对西花蓟马解毒酶活性和生长发育的影响已有报道(杨广明等, 2016),但西花蓟马世代周期短,繁殖快,在田间通常会受到杀虫剂连续多代胁迫。因此,本研究以LC25浓度的乙基多杀菌素对西花蓟马连续汰选6代后,测定了西花蓟马抗药性、解毒酶活性、发育和繁殖的变化,旨在明确西花蓟马对乙基多杀菌素多代胁迫的生化响应和种群适合度变化,以期为西花蓟马的抗药性研究和综合治理提供理论参考。
1 材料与方法
1.1 供试材料
1.1.1供试昆虫:西花蓟马2016年采自贵州省贵阳市花溪区菜豆植株上,以菜豆Phaseolusvulgaris豆荚在人工气候箱(RXZ系列)(温度25±1℃,相对湿度70%±5%,光周期14L∶10D)内饲养50代以上,饲养过程不接触任何农药。
1.1.2供试寄主:供试菜豆品种为金束鹿泰国地豆王(购自河北省辛集市盛农种子公司),以灭菌营养土种植,期间不接触任何药剂,并用防虫网隔离,避免虫伤。 待植株长至第2真叶后期叶片较大时取用。
1.2 毒力测定
采用叶片浸渍法进行毒力测定。用去离子水将60 g/L爱绿士悬浮剂先配成100 mg/L母液,再等比稀释成6个浓度,取健康的菜豆植株叶片剪成直径为2.5 cm的圆片(保留部分叶柄,以减缓叶面水分散失),分别浸入不同浓度药液20 s后取出晾干待用。将处理好的叶片置于扎孔透气透明圆形塑料盒(高3.5 cm,直径4 cm)内,然后每盒接入西花蓟马2龄初期若虫20头,接虫72 h后统计死亡量。以去离子水处理的西花蓟马2龄若虫作对照。
1.3 西花蓟马对乙基多杀菌素的抗性汰选
采用浸叶法。以前期获得的杀死西花蓟马25%的浓度即LC25浓度(0.0033 mg/L)乙基多杀菌素(李定银等, 2020)浸泡菜豆植株,20 s后取出晾干,然后将茎秆插入底部加有清水的自制饲养盒(直径15 cm,高16 cm)内,去离子水浸泡作对照。分别接入室内长期以菜豆豆荚饲养的西花蓟马2龄初期若虫(F0代)约200头/盒,置于人工气候箱(条件同1.1.1节)内饲养,羽化后的成虫转移到无药菜豆植株上饲养,每天更换菜豆植株(保证产卵时间的一致性),将产卵后的植株移入干净的饲养盒内待孵化。下一代2龄若虫再次用药液浸泡过的菜豆植株饲养,如此循环。每隔3代按1.2节的方法测定西花蓟马分别取食无药处理和药液处理菜豆植株西花蓟马的敏感性变化,每次用于处理植株的药液浓度为上一次测得的LC25,连续胁迫饲养6代(F6)。
1.4 西花蓟马体内解毒酶活性测定
收集LC25浓度乙基多杀菌素汰选所得西花蓟马F6代2龄第2天的若虫,每管50头为一个重复,测定CarE, GSTs, MFOs和P450s的活性,以及蛋白质的含量,以去离子水处理的菜豆植株饲养的同代西花蓟马作对照,实验重复4次。CarE和GSTs活性测定根据苏州科铭生物技术有限公司的试剂盒说明书的操作步骤进行。MFOs和P450s活性按照酶联免疫(ELISA)试剂盒说明书操作进行。测定原理如下:
CarE:CarE能催化乙酸-1-萘酯生成萘酯,固蓝显色;在450 nm波长下的光吸收增加速率,计算CarE活性。
GSTs:GSTs催化谷胱甘肽(GSH)与1-氯-2,4二硝基苯(CDNB)结合,结合产物的吸收峰波长为340 nm,通过测定340 nm波长处吸光度上升速率即可计算出GSTs活性。
MFOs:采用双抗体夹心法酶联免疫吸附试验(ELISA)。往预先包被昆虫混合功能氧化酶(MFO)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的昆虫MFOs呈正相关,测定450 nm波长下吸光度,计算样品浓度。
P450s:采用ELISA法。往预先包被P450s抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的P450s呈正相关,测定450 nm波长下吸光度,计算样品P450s浓度。
酶活性最终以对应样本的蛋白含量进行标定。
在农业技术的推广过程中,由于资金投入的不足,导致农业技术的推广受到很大的阻碍。从数据上来看,发达国家在农业技术推广中投入的经费远远大于我国,其在农业总产值中所占的比例为0.6%-1.0%。即使是发展中国家,农业技术推广经费在农业总产值中所占的比例也有0.5%左右,而我国在这方面的投入还不到0.2%。在这样的情况下,人均经费多么的不足便可想而知。经费的不足,导致农业技术的推广十分被动,很难将新技术有效地运用到农业生产中,这也是我国农业发展缓慢的一个重要原因。
1.5 蛋白质含量测定
蛋白质含量测定采用二喹啉甲酸法(bicin chonininc acid, BCA)法,按苏州科铭生物技术有限公司试剂盒说明书进行。
1.6 西花蓟马的繁殖力及后代发育历期、繁殖力、存活率和子代性比测定
选择LC25浓度乙基多杀菌素胁迫所得西花蓟马F6代成虫,单对配对后,转移至底部预先垫有吸水的滤纸片和加入新鲜菜豆叶片的透明塑料盒(规格同1.2节)中,在人工气候箱(条件同1.1.1节)内饲养。去离子水处理菜豆植株饲养的同代西花蓟马作对照,实验重复3次(每个重复10对)。每天记录成虫的寿命,同时更换新鲜菜豆叶片以供产卵。产卵后的叶片转移至新的塑料杯中待孵化,保存6 d以上,每天检查卵的孵化情况。由于西花蓟马将卵产于植物组织中,故以孵化出的若虫数代表产卵量(Watts, 1934)。
收集F7代初孵若虫,用新鲜菜豆叶片进行单头饲养,每1~2 d更换一次叶片,饲养装置和方法同上,以去离子水处理的菜豆植株饲养的同代西花蓟马作对照。重复3次,每个重复30头,每天观察2次(早8∶00,晚20∶00),记录各虫态的发育和存活情况,羽化后的雌雄成虫立即进行配对后按上述方法观察其寿命和繁殖力。每天收集产卵的菜豆叶片,每天继续观察2次记录若虫孵出情况,并将其移出,连续观察6 d,统计卵期。每个处理实验重复5次。并继续饲养至成虫后随机挑选300头鉴定雌雄,统计性比。
1.7 数据处理和生命表构建
试验数据采用Microsoft Excel 2016进行整理,用SPSS 24.0软件的Probit模块拟合毒力回归方程,并确定杀虫剂不同致死率对应的浓度,敏感性的变化以抗性倍数表示:抗性倍数=汰选前LC50/汰选后LC50。参照年龄-阶段两性生命表理论(Chi and Liu 1985; Chietal., 1988; 齐心等, 2019)统计记录的西花蓟马种群(F7)原始数据,并用TWOSEX-MSChart软件(http:∥140.120.197.173/Ecology/prod02.htm)计算西花蓟马汰选种群和对照后代(F7)的特定年龄-阶段存活率(sxj)、特定年龄-阶段生命期望值(exj)、特定年龄存活率(lx)和生命表参数,x为按存活时间划分的年龄,j代表发育阶段(Chi and Su, 2006; Tuanetal., 2014a, 2014b; Changetal., 2016)。采用10万次bootstrapping法确定其平均值和标准误(Huang and Chi, 2013),西花蓟马发育历期、繁殖力和生命表参数间的差异显著性用paired bootstrap test (TWOSEX-MSChart)程序进行分析(Chi, 2018)。
2 结果
2.1 乙基多杀菌素多代汰选后西花蓟马敏感性的变化
西花蓟马经LC25浓度的乙基多杀菌素胁迫不同世代后敏感性发生了明显的变化(表1)。西花蓟马2龄若虫以最初的乙基多杀菌素LC25浓度(0.0033 mg/L)连续汰选3代后,抗性倍数达到2.5倍。第4-6代以第3代测得的LC25浓度(0.0043 mg/L)再次胁迫汰选,第6代的抗性倍数达到了6.4倍。结果说明随着汰选代数的增加西花蓟马对乙基多杀菌素的敏感性降低,抗性增强。未经药剂胁迫的西花蓟马从菜豆豆荚转移至菜豆植株后,对乙基多杀菌素的敏感性也有所下降。
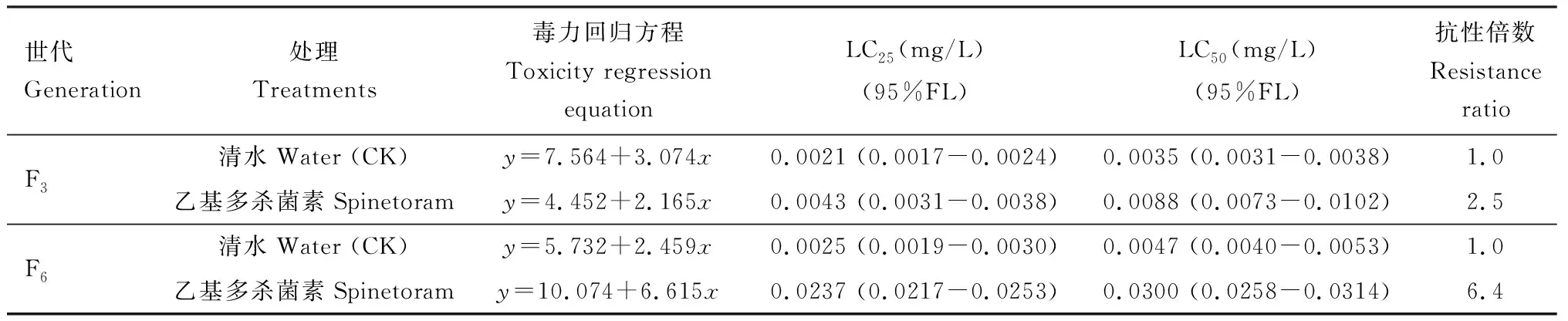
表1 乙基多杀菌素对西花蓟马2龄若虫的毒力测定Table 1 Toxicity of spinetoram to the 2nd instar nymphs of Frankliniella occidentalis
2.2 LC25浓度乙基多杀菌素汰选6代后西花蓟马2龄若虫体内解毒酶活性的变化
LC25浓度乙基多杀菌素对西花蓟马连续汰选6代后,西花蓟马F6代2龄若虫体内4种解毒酶活性均发生了明显的变化,但不同酶的活性变化并不相同(图1)。西花蓟马体内CarE和GSTs被激活,其活性分别为对照的1.26倍和1.21倍,且与对照差异显著(P<0.05)。而MFOs和P450s活性则受到明显抑制,其活性分别只有对照的54.00%和51.78%(P<0.05)。
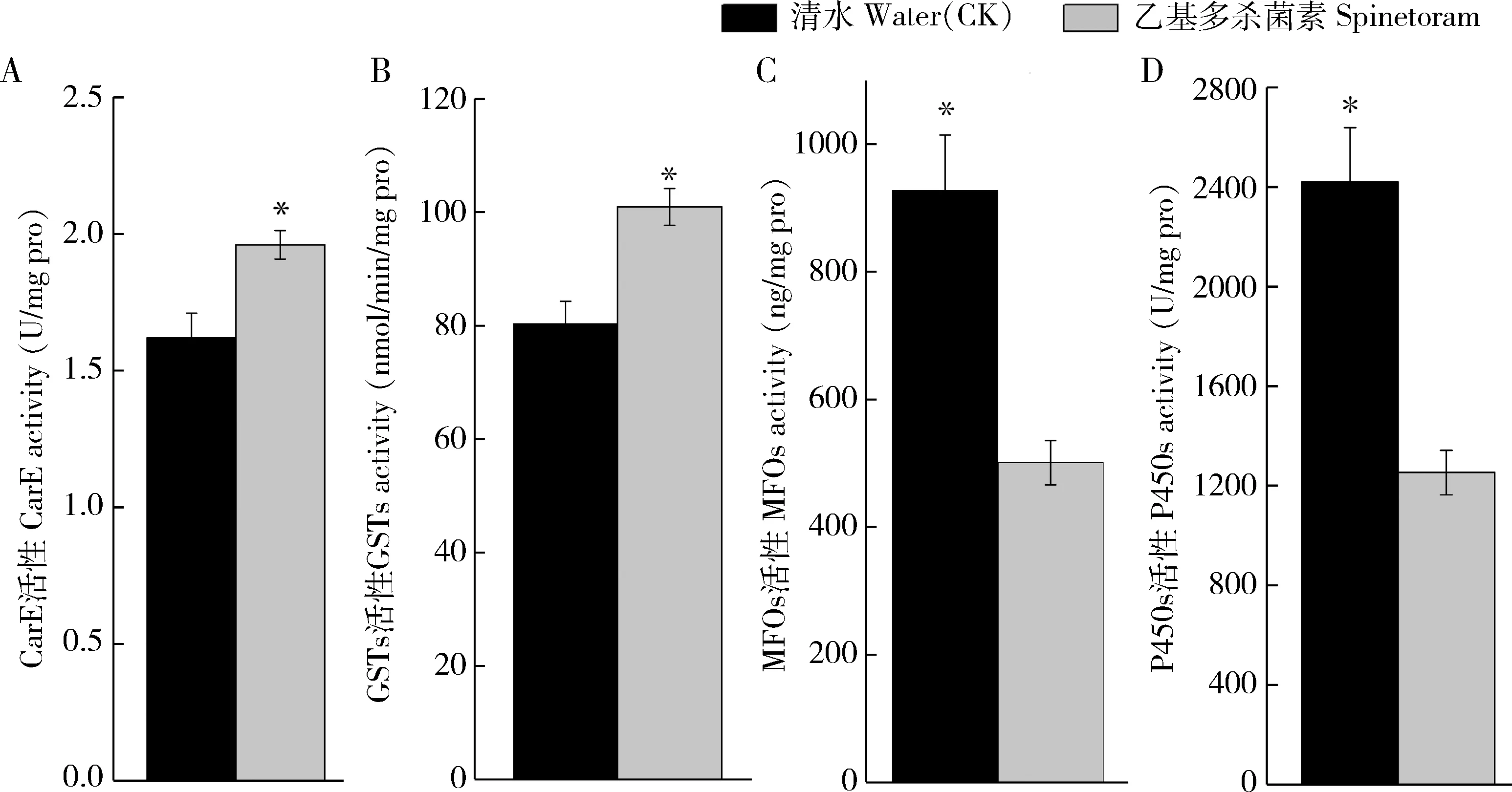
图1 LC25浓度乙基多杀菌素连续汰选6代后西花蓟马2龄若虫体内CarE(A), GSTs(B), MFOs(C)和P450s(D)活性变化Fig. 1 Changes in the activities of CarE (A), GSTs (B), MFOs (C) and P450s (D) in the 2nd instar nymphs ofFrankliniella occidentalis after selection with LC25dosage of spinetoram for six generations图中数值为平均值±标准误;柱上星号表示处理与对照组之间差异显著性(P<0.05, t检验);收集乙基多杀菌素连续汰选6代后的西花蓟马2龄第2天的若虫,测定其体内解毒酶活性活性变化,清水处理同时期的若虫作对照。Data in the figure are mean±SE. The asterisk above bars indicates significant difference between the treatment and the control (P<0.05, t-test). The day-2 2nd instar nymphs of F. occidentalis screened by spinetoram for 6 generations were collected to assay the detoxification enzyme activities. F. occidentalis nymphs at the same developmental stage treated with clear water were used as the control.
2.3 LC25浓度乙基多杀菌素汰选6代后西花蓟马的繁殖力
西花蓟马在LC25浓度的乙基多杀菌素连续汰选6代后繁殖力变化见表2。由表可知,西花蓟马雌成虫寿命(19.33 d)和产卵期(16.80 d)均显著缩短(P<0.05);平均单雌产卵量仅有69.80粒,显著低于对照组(83.17粒)(P<0.05);乙基多杀菌素汰选后西花蓟马产卵前期(2.60 d)有所延长,产卵后期(0.33 d)有所缩短,但与对照差异不显著(P>0.05)。

表2 LC25浓度乙基多杀菌素汰选6代后西花蓟马的繁殖力Table 2 Fecundity of Frankliniella occidentalis after selection with LC25 dosage of spinetoram for six generations
2.4 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的两性生命表
2.4.1对F7代生长发育与繁殖的影响:LC25浓度的乙基多杀菌素6代胁迫对西花蓟马后代(F7代)发育历期和繁殖力产生明显的影响(表3)。西花蓟马卵期(3.24 d)、预蛹期(1.15 d)、雌成虫寿命(16.82 d)和雄成虫寿命(8.29 d)极显著缩短(P<0.01),单雌产卵量极显著降低(P<0.01),1龄(1.19 d)、2龄(3.31 d)若虫历期和预蛹期均显著缩短(P<0.05),蛹期(2.92 d)极显著延长(P<0.01),后代雌雄性比(2.28)显著增加(P<0.05),是对照(1.03)的2.21倍。
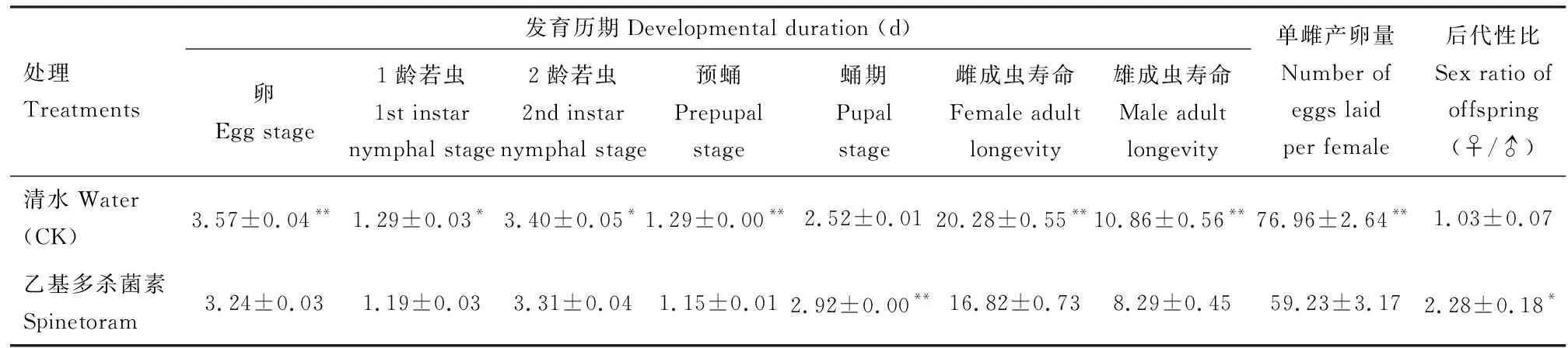
表3 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的发育和繁殖Table 3 Development and reproduction of offspring (F7 generation) of Frankliniella occidentalis after selectionwith LC25 dosage of spinetoram for six generations
2.4.2对F7代的存活率与繁殖力的影响:年龄-阶段特征存活率(sxj)曲线的重叠程度代表西花蓟马个体间发育速率的差异。如图2所示,西花蓟马杀虫剂汰选品系和对照的sxj曲线重叠程度较低,说明西花蓟马各阶段的发育速率比较一致。经乙基多杀菌素汰选后的西花蓟马雌雄成虫存活率和存活时间均低于对照,卵期、若虫期、预蛹期和蛹期存活率无明显变化。

图2 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的年龄-阶段特征存活率(sxj)Fig. 2 Age-stage specific survival rate (sxj) of offspring (F7 generation) of Frankliniella occidentalisafter selection with LC25 dosage of spinetoram for six generationsA: 清水Water (CK); B: 乙基多杀菌素Spinetoram. 下图同The same for the following figures.
种群特定年龄存活率(lx)曲线是x年龄的存活率,描述了西花蓟马存活率随年龄的变化。如图3所示,不论是乙基多杀菌素胁迫还是对照组,西花蓟马存活曲线前期坡度均较平缓,表明西花蓟马在未成熟期的死亡率低,自蛹开始羽化后存活率迅速下降。乙基多杀菌素胁迫组和对照组分别在第35和第38天全部死亡,且乙基多杀菌素汰选组西花蓟马在不同年龄时期的存活率均低于对照组。乙基多杀菌素胁迫组和对照的种群特定年龄繁殖力(mx)整体先增后降,中间存在多个峰值,并在15~20 d之间达到繁殖最高峰,雌虫特定年龄繁殖力(fx)也存在相同的变化趋势。lxmx是x年龄时所有存活个体的繁殖值,即单雌产卵量,由图3可知,乙基多杀菌素胁迫后西花蓟马特定年龄单雌产卵量明显低于对照。

图3 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的特定年龄存活率(lx)、雌虫特定年龄繁殖力(fx)、群体特定年龄繁殖力(mx)和特定年龄繁殖值(lxmx)Fig. 3 Age-specific survival rate (lx), female age-specific fecundity (fx), age-specific fecundity of total population (mx) and age-specific maternity (lxmx) of offspring (F7 generation) of Frankliniella occidentalis after selection with LC25 dosage of spinetoram for six generations
特定年龄-阶段生命期望值(exj)表示西花蓟马在x年龄j阶段个体的剩余存活时间(图4)。乙基多杀菌素胁迫组和对照组西花蓟马的生命期望值均随年龄增长逐渐下降,且乙基多杀菌素胁迫下各年龄阶段的生命期望值均低于对照。
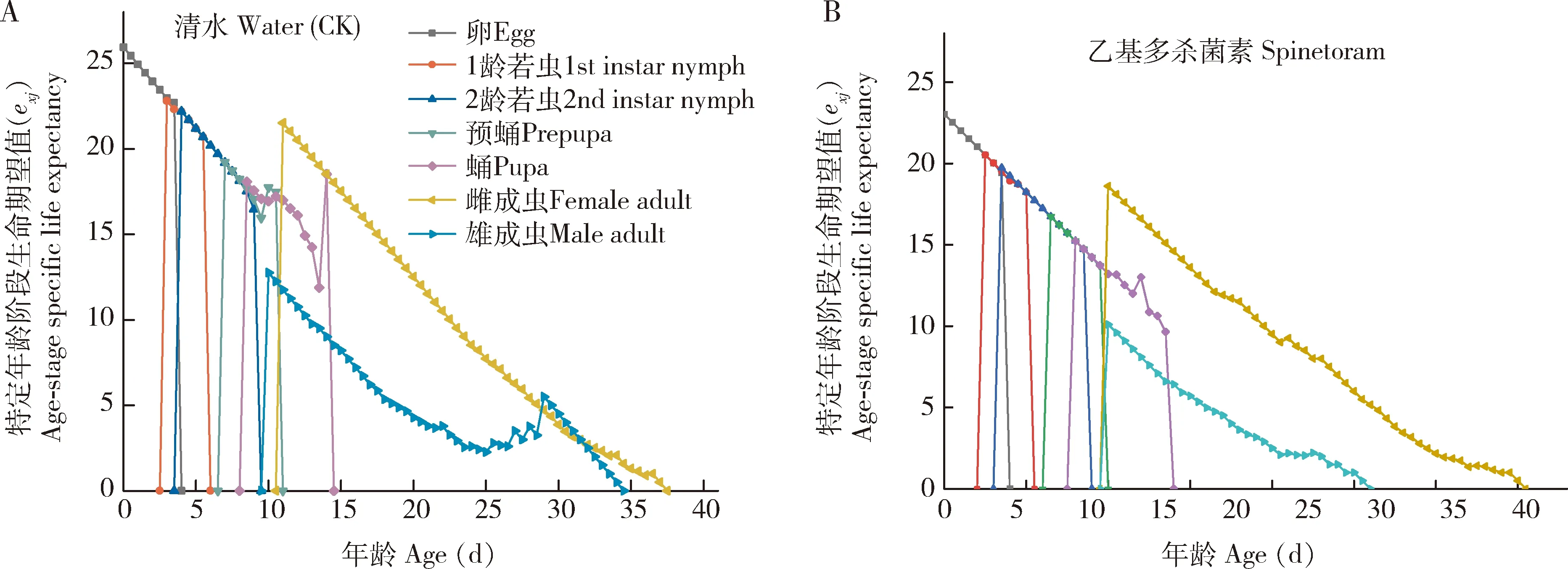
图4 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的特定年龄-阶段生命期望(exj)Fig. 4 Age-stage specific life expectancy (exj) of offspring (F7 generation) of Frankliniella occidentalisafter selection with LC25 dosage of spinetoram for six generations
特定年龄-阶段繁殖值(vxj)是指西花蓟马x年龄j阶段的个体对未来种群发展的平均贡献值(图5)。乙基多杀菌素胁迫组和对照组西花蓟马雌成虫繁殖值均随年龄的增长呈先增后降的趋势,且均在第15天达到了繁殖最高峰。
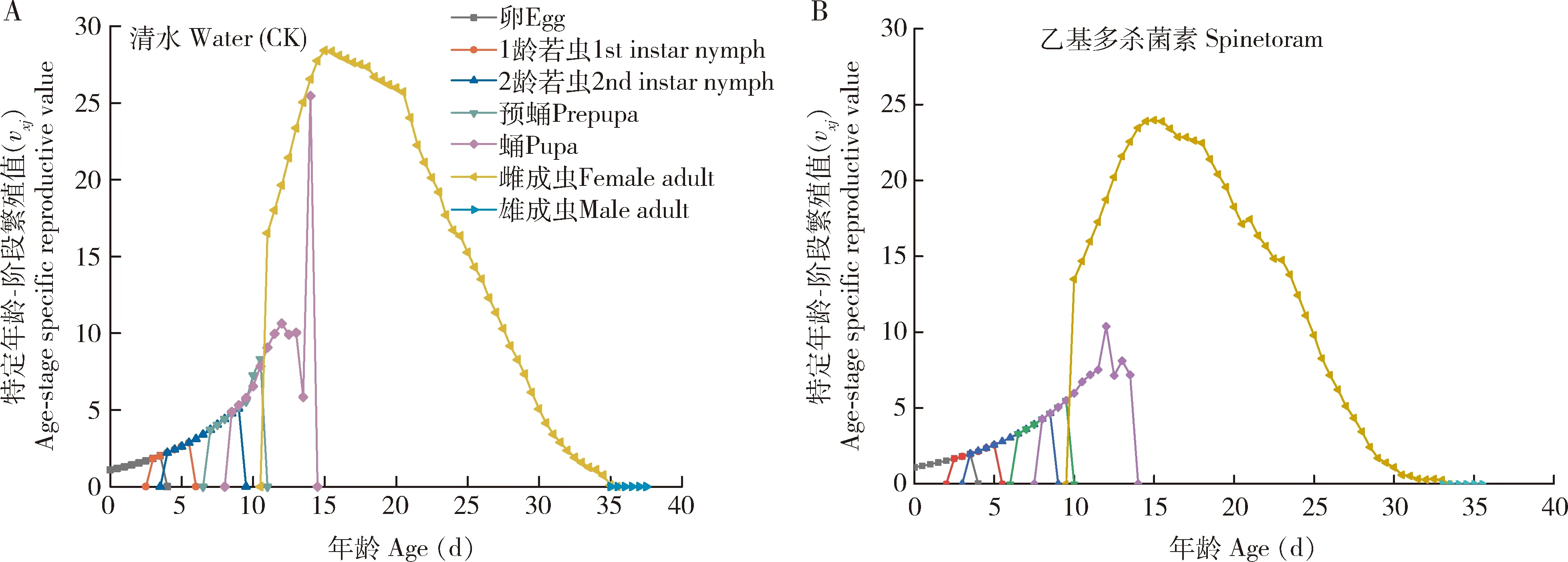
图5 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的特定年龄-阶段繁殖值(vxj)Fig. 5 Age-stage specific reproductive value (vxj) of offspring (F7 generation) of Frankliniella occidentalisafter selection with LC25 dosage of spinetoram for six generations
2.4.3对F7代两性生命表参数的影响:乙基多杀菌素多代胁迫后西花蓟马后代(F7)种群生命参数见表4。由表可知,乙基多杀菌素胁迫后西花蓟马的净增殖率(R0=25.9636)、内禀增长率(rm=0.1689)、 周限增长率(λ=1.1840)、 平均世代周期(T=19.2352 d)与对照(R0=35.2099,r=0.1731,λ=1.1885,T=20.5852 d)相比均有所降低,但差异不显著。

表4 LC25浓度乙基多杀菌素汰选6代后西花蓟马后代(F7代)的种群生命参数Table 4 Life-table parameters of offspring (F7 generation) of Frankliniella occidentalis after selectionwith LC25 dosage of spinetoram for six generations
3 讨论
前人研究表明,低浓度的杀虫剂胁迫不仅可影响昆虫的繁殖力、生长发育、生态行为和害虫抗药性等特征,产生亚致死效应,也可激活或抑制昆虫体内的解毒酶,为害虫抗药性进化提供动力(Lee, 2000; Chatonetal., 2001),本研究也有类似的发现。本研究以LC25浓度的乙基多杀菌素对西花蓟马进行逐代汰选后,发现西花蓟马对该药剂抗性不断增加,汰选第3代和第6代后抗性倍数分别为2.5和6.4倍,产生了低水平的抗性(表1),表明西花蓟马对乙基多杀菌素的抗性与用药时间的推移呈正相关关系。侯文杰(2012)研究发现西花蓟马对多杀菌素的抗性在1-42代内发展呈“J”型增长,当乙基多杀菌素胁迫多代会造成西花蓟马抗性激增,因此长期持续用药可能会导致西花蓟马种群的再暴发;而龚佑辉等(2010)的研究结果显示低剂量多杀菌素继代处理西花蓟马40多代后,抗性倍数仅有6.7倍。不同学者研究结果不同,可能是由于在不同浓度杀虫剂选择压力下,西花蓟马的抗性发展速率不同。此外,本研究还发现,长期以菜豆豆荚饲养的西花蓟马更换菜豆植株饲养后,对乙基多杀菌的敏感性也逐代下降,推测原因可能是西花蓟马从菜豆豆荚转移至菜豆植株后,随着取食代数的增加对新寄主的适应能力逐渐增强,对杀虫剂的抵抗力也有所增强。陈锐芬(2011)也发现西花蓟马在寄主转换初期表现出明显的不适应,如繁殖力和存活率下降。
代谢解毒是昆虫抵抗杀虫剂的重要途径,本研究发现经乙基多杀菌素多代胁迫后西花蓟马体内CarE和GSTs活性显著升高。此结果与龚佑辉等(2009)研究多杀菌素汰选36代后西花蓟马抗性品系体内CarE和GSTs活性显著升高的结果相似,说明西花蓟马可通过提高体内CarE和GSTs活性来增强对多杀菌素类杀虫剂的代谢。本研究中,乙基多杀菌素(LC25)胁迫6代后西花蓟马2龄若虫体内MFOs和P450s活性降低(图1),与侯文杰(2012)研究显示多杀菌素(LC50)汰选46代后的西花蓟马高抗品系CarE, GSTs和MFOs活性与敏感品系均无显著差异的结果不同,原因可能是胁迫时间或药剂浓度不同造成西花蓟马体内生化响应程度差异,也可能与西花蓟马抗性增加后靶标位点的敏感性下降有关,还可能是因为LC25浓度乙基多杀菌素长期胁迫削弱了此2种酶在代谢解毒过程中的作用(Espinosaetal., 2005)。
本研究发现经LC25浓度乙基多杀菌素汰选6代的西花蓟马雌成虫寿命、产卵期和产卵量均显著下降(表2),这与付步礼等(2017)研究表明抗乙基多杀菌素种群黄胸蓟马Thripshawaiiensis雌虫寿命、繁殖力和存活率低于敏感品系的结果相似。说明西花蓟马可通过以降低种群适合度为代价来增强对杀虫剂的抗性(Wanetal., 2021)。本研究还发现LC25浓度乙基多杀菌素处理后也可造成西花蓟马后代发育历期缩短,繁殖力降低(表3),说明药剂汰选对昆虫影响的累积效应。龙贵云等(2017)也发现吡蚜酮不仅能降低白背飞虱SogatellafurciferaF0代的繁殖力,抑制种群增长,对F1代也有影响。本结果表明乙基多杀菌素对西花蓟马种群的净增殖率和内禀增长率等种群参数没有明显影响(表4),这可能是种群参数反映了昆虫生长发育时间、存活率、繁殖力及性比等各因素的综合影响(张孝羲, 2002),乙基多杀菌素处理虽对西花蓟马寿命、产卵量有明显的不利影响,但明显缩短发育历期、提高雌性比,最后正负作用相互抵消导致综合影响不显著,种群参数没有明显改变。此外,经乙基多杀菌素汰选的西花蓟马后代雌性比明显升高,说明西花蓟马雌性个体比雄性对杀虫剂具有更强的抵抗力。
综上所述,本研究结果表明,乙基多杀菌素连续胁迫下,西花蓟马一方面通过调节体内解毒酶活性对杀虫剂进行代谢解毒作为生化响应,另一方面以缩短发育历期、降低繁殖力和存活率等作为抗性发展的代价。此外,乙基多杀菌素连续处理6代后,西花蓟马生化响应以及发育和繁殖改变与杨广明等(2016)用该药剂只处理1代后对西花蓟马的影响不同,故推测乙基多杀菌素对西花蓟马的影响具有累积效应,其抗性会随西花蓟马的世代逐渐增加。因此在使用该药剂防治西花蓟马时,建议与其他类型杀虫剂轮换使用,以减缓抗性的发展。
