纤维蛋白原B β链-1689、HinfⅠ基因多态性位点单倍体型与胃癌的关联性分析*
2021-11-06严芝强成兴真王杨聂微杨芳
严芝强, 成兴真, 王杨, 聂微, 杨芳**
(1.贵州医科大学附属医院 胃肠外科, 贵州 贵阳 550004; 2.贵州医科大学 医学检验学院 临床血液教研室, 贵州 贵阳 550004)
胃癌(Gastric cancer,GC)是全球最常见的恶性肿瘤之一,最新癌症统计数据表明,GC在全球发病率居第五位、死亡率居第四位[1]。GC的发病机制仍不清楚,其发病涉及遗传、环境等多种因素,认为在细胞癌变过程中起关键作用的是遗传学和表观遗传学变化累积作用的结果[2]。为此,研究胃癌发病的相关性遗传因子,以期用于胃癌的筛查高危人群、早期预防以及临床治疗。纤维蛋白原(fibrinogen,Fg)是一种源至于肝细胞生产的大分子糖蛋白,参与凝血过程促进血栓形成[3-4]。大多数恶性肿瘤患者存在凝血异常改变,这种改变表现在体内的肿瘤细胞既可能同时激发肝细胞产生相应的Fg,也可能同时通过分解形成相应的纤维蛋白,从而为癌细胞的浸润、生长及转移提供结构上的支持;此外,Fg也可作为一种黏附分子的配体,使癌细胞与血小板之间的黏附结合更加紧密[5]。Fg由6条多肽链通过二硫键连接成的对称性二聚体,分别由3个独立的基因FgA、FgB和FgG编码,其中FgB编码的β链是Fg合成的限速步骤,同时也是血浆功能表达的主导因素[6-7],认为编辑β链的基因通常是影响血浆Fg浓度的主要因素,所以当前的研究探索大多聚焦于FgB基因的多态性分析上[8-11]。在FgBβ链基因多态性位点的研究中,对于近5′端的第1内含子1689T/ G和3′端非转录区的HinfIA/C位点的研究较少[12],为了对FgB的 β链-1689T/G以及HinfIA/C位点基因多态性进行研究,本研究利用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction- restriction fragment length polymorphism,PCR-RFLP)方法探讨胃癌与其基因多态性的联系。
1 材料与方法
1.1 材料
1.1.1标本来源 收集2013年6月—2015年2月151例经病理活检确诊GC患者的血液标本(所有病例为汉族人群、且无血缘关系),研究获得医院伦理委员会批准【批件号:2020伦审第(108)号】,患者及家属签署《知情同意书》,女性患者62人、男性患者89人, 26~85岁、平均67岁;其中Ⅰ期患者有36人、Ⅱ期患者有29人、Ⅲ期患者有73人、Ⅳ期患者有13人。对照组是151名健康体检者,其中女性60人、男91人, 29~86岁,平均64岁。胃癌组和对照组之间的性别、年龄分布差异无统计学意义(P>0.05)。
1.1.2主要试剂和仪器 引物合成为生工生物工程技术有限公司;琼脂糖(BIOWEST公司),2×Hotstart Taq PCR Master Mix (天根生化科技有限公司),限制性内切酶 Ava Ⅱ(MBI Fermentas公司),限制性内切酶 HinfⅠ(MBI Fermentas公司)。 TGL-16高速离心机(国华电子设备公司),DYY-III-5型稳压稳流电泳仪(六一仪器厂),PE9700扩增仪(Applied Biosystems公司),DNA成像分析器Gel Doc EQ(Bio-Rad公司)。引物序列及内切酶见表1。

表1 引物序列及内切酶Tab.1 Primer sequences and endonuclease
1.2 方法
1.2.1标本收集 收集胃癌组及对照组的空腹全血(EDTA-K2抗凝)各151份,采集后使用酚-氯仿法提取白细胞层中的基因组DNA,并保存于-20 ℃的环境中备用。
1.2.2基因型检测 通过PCR-RFLP技术对FgB的 β链-HinfIA/C和β链-1689位点进行基因分型。FgB的β链-1689及-HinfIA/C位点的引物序列设计参考元小冬等人[13]的方法。25 μL PCR 反应体系中特异性引物取1 μL、DNA模板取1 μL、上,下游引物取1 μL、2×Hotstart Taq PCR Master Mix取13 μL,共计16 μL,再补ddH2O 9 μL至25 μL。PCR的反应条件为:温度调节至 95 ℃后预变性5 min,继续在95 ℃环境温度中变性60 s,再调节环境温度至54 ℃并退火55 s,调节环境温度至72 ℃延伸60 s,相同的步骤扩增30个循环,最后在72 ℃的环境温度中延伸5 min;取其8 μL,加入Buffer2 μL和内切酶AvaⅡ/HinfⅠ 0.9 μL,再用ddH2O补至20 μL;将上述液体混匀后并进行瞬时离心,再将离心后的液体放进37 ℃的恒温水浴箱中进行16 h的水浴,最后通过2%琼脂糖凝腔电泳和EB染色,最后置于凝胶成像系统下进行观察,记录其实验结果。
1.3 统计学分析
计数资料比较采用χ2检验或Fisher’s精确检验(性别、年龄、基因型)。等位基因频率采用基因计数法计算,χ2检验通过基因型的Hardy-Weinberg平衡吻合度来验证。多态性位点间的连锁不平衡关系应用SHEsis 在线软件(http://analysis.bio-x.cn/myAnalysis.php)计算连锁不平衡系数,病例对照研究中应用SHEsis 在线软件构建单倍型,如单倍体型频率<3%时、将被自动删除,不再进行后续分析,并计算相对危险度的比值比(OddsRatio,OR)及95%CI。FgBβ链多态性位点与胃癌患病风险之间的相关性用OR及其95%CI表示。
2 结果
2.1 两基因位点基因型
2.1.1FgBβ链-1689T/G基因多态性FgBβ链-1689T/G基因多态性呈T-G两态,其中G等位基因中含有AvaⅡ酶切位点,如果当G突变为T的时候,结果显示G等位基因就会丢失AvaⅡ酶切位点,1689位点TT型表现为252 bp片段,TG型表现为252 bp、192 bp和60 bp片段,而其中的GG型则表现为60 bp和192 bp两个片段。见图1。
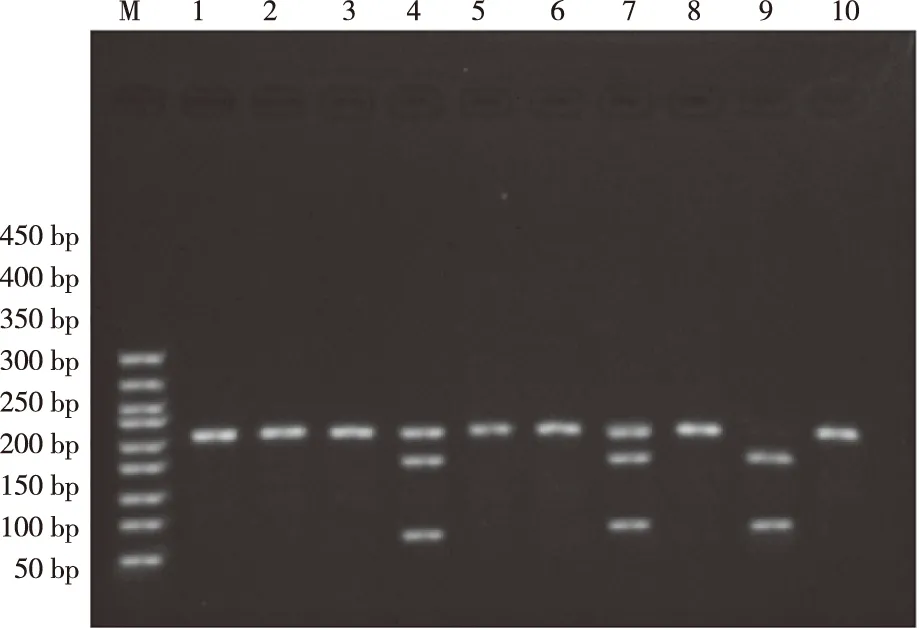
注:M为DNA Marker, 1、2、3、5、6、8、10为TT基因型,4、7 为TG基因型,9为GG基因型。图1 FgB β链-1689T/G位点琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis of FgB β chain-1689T/G site
2.1.2FgBβ链-HinfⅠA/C基因多态性FgBβ链-HinfⅠA/C基因多态性呈A-C两态,其中在A等位基因上存在着HinfⅠ酶切位点,如果基因位点上的A变异为C时,结果显示A等位基因就会丢失HinfⅠ酶切位点;其中在HinfⅠ基因位点上的CC型表达出240 bp一个片段,而AA型则分别展示出100 bp及140 bp两个片段,剩下的AC型则分别表达出100 bp、140 bp及240 bp片段。见图2。

注: M为DNA Marker,1、2、4、5、6、8、10为 AA基因型,3、7 为AC基因型,9为CC基因型。图2 FgB β链-HinfⅠA/C位点琼脂糖凝胶电泳结果Fig.2 Agarose gel electrophoresis of FgB β chain-HinfⅠA/C at A/C site
2.2 两组人群的性别及年龄的分布比较
结果表明,胃癌组年龄、性别分布与对照组比较差异无统计学意义(χ2=0.468,P>0.05;χ2=0.055,P>0.05)。见表2。
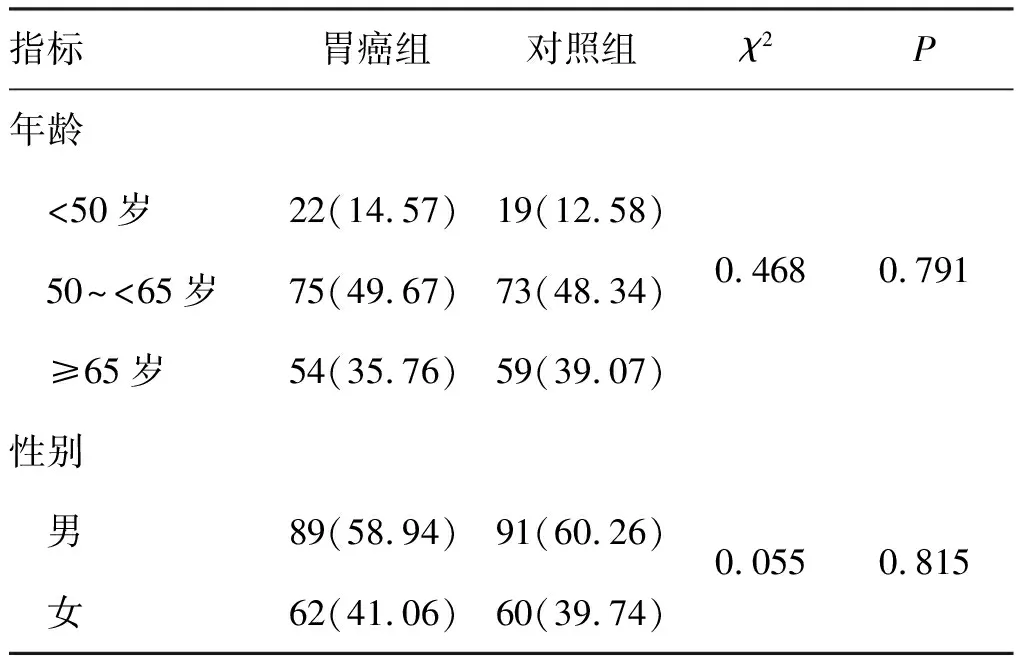
表2 胃癌组和对照组的性别及年龄分布[n(%)]Tab.2 Comparison of gender and age distribution between the gastric cancer group and the control group[n(%)]
2.3 FgB β链-1689T/G和β链-HinfIA/C基因型频率的Hardy-Weinberg平衡检验
采用χ2检验对胃癌组及对照组的FgBβ链-1689T/G、HinfIA/C的基因型频率进行Hardy-Weinberg平衡检验,均符合Hardy-Weinberg平衡(P>0.05),提示本项研究人群具有群体代表性。见表3。
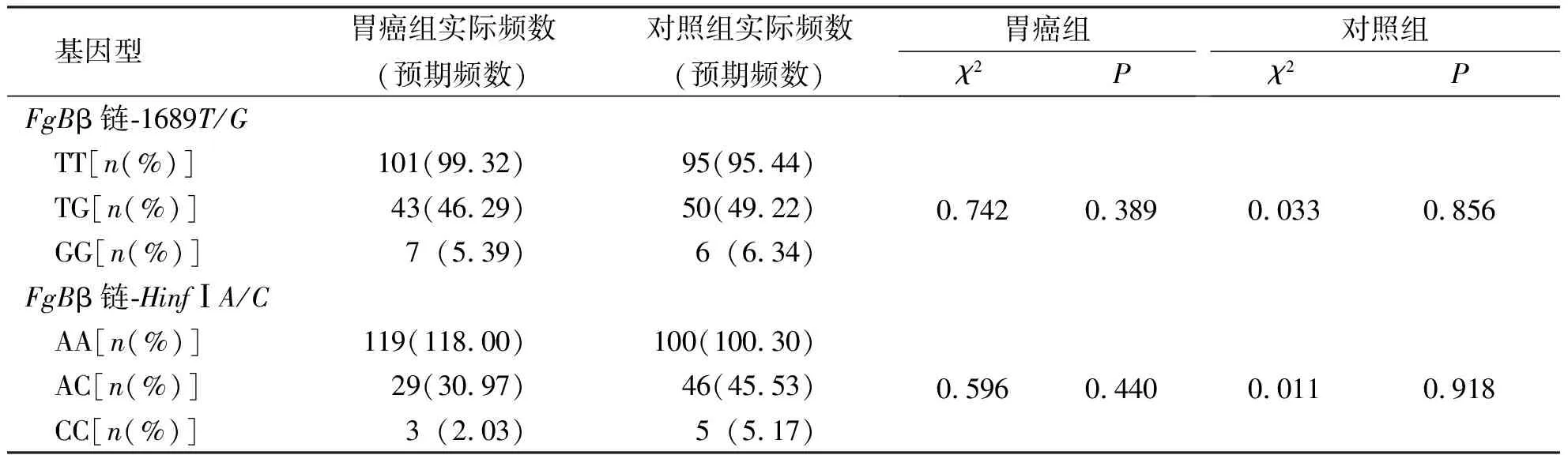
表3 FgB β链-1689T/G和HinfIA/C基因位点基因型频率Hardy-Weinberg平衡检验Tab.3 The Hardy-Weinberg balance test of the genotype frequency of two gene loci of FgB β chain-1689T/G and HinfIA/C
2.4 FgB β链-1689T/G和β链-HinfIA/C基因多态性与胃癌的临床分期、转移的关系
不同病理分期和有、无淋巴结转移的胃癌患者FgBβ链-1689T/G和HinfIA/C基因的基因型的分布比较,差异无统计学意义(P>0.05),提示FgBβ链-1689T/G和β链-HinfIA/C基因多态性与胃癌的临床分期及转移无关。见表4。
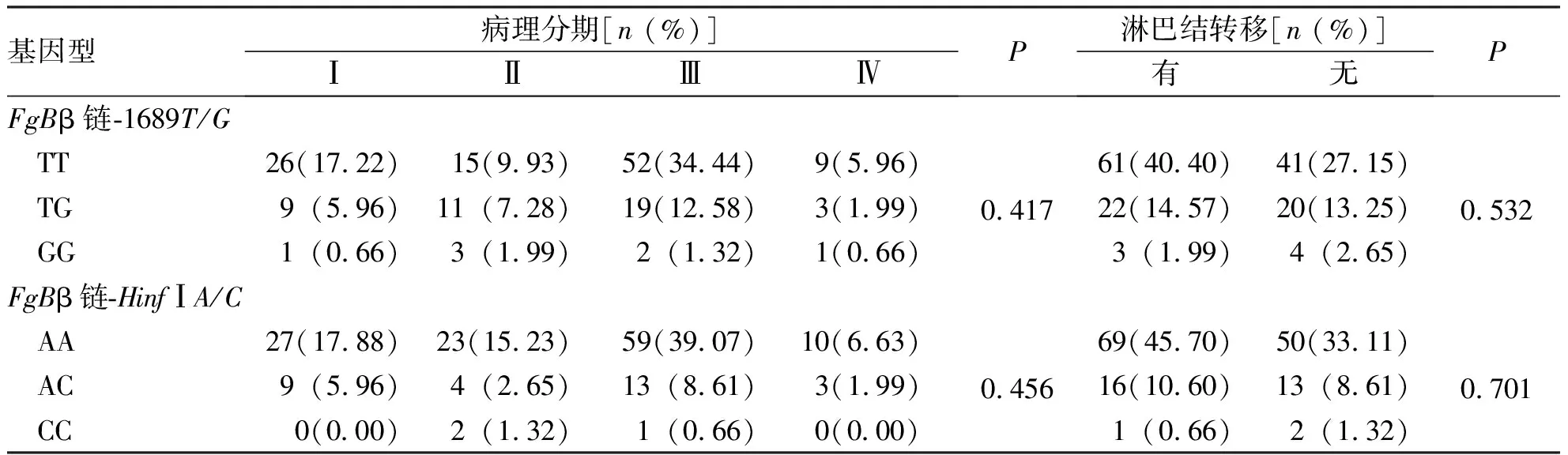
表4 FgB β链-1689T/G和HinfIA/C位点的基因多态性与临床病理分期及淋巴结转移的关系Tab.4 The relationship between genetic polymorphisms of FgB β chain-1689T/G and HinfIA/C loci with different pathological stages and the presence or absence of lymph node metastasis
2.5 胃癌组及对照组FgB β链-1689T/G和β链-HinfIA/C基因型分布和等位基因频率分布
结果显示, 胃癌组FgBβ链-1689T/G位点不同基因型及等位基因分布与对照组比较差异无统计学意义(P>0.05);FgBβ链-HinfⅠA/C位点的基因型和等位基因在胃癌组与对照组之间的分布上均具有相关性 (P<0.05)。提示FgBβ链-HinfⅠA/C位点基因多态性可能与胃癌发病相关。见表5。
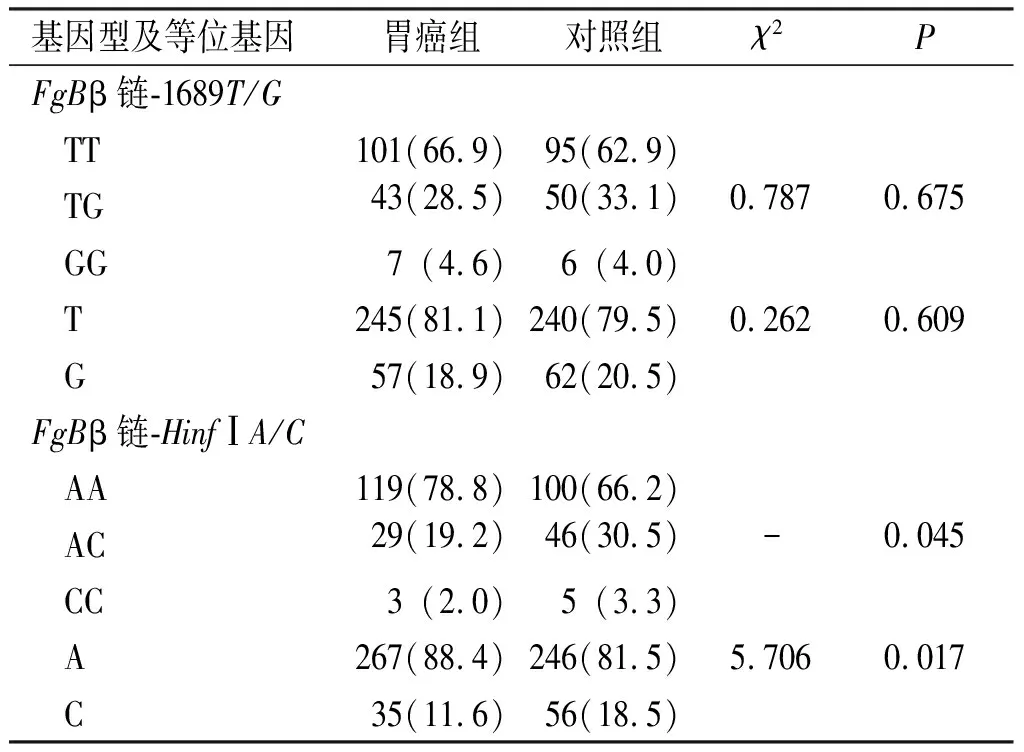
表5 胃癌组及对照组FgB β链-1689T/G、HinfIA/C基因型和等位基因频率分布[n(%)]Tab.5 FgB β chain-1689T/G, HinfIA/C genotype and allele frequency distribution in gastric cancer group and control group[n(%)]
2.6 FgB β链-1689T/G和FgB β链-HinfIA/C位点不同基因型在胃癌中的OR分析
通过OR分析FgBβ链-1689T/G和β链-HinfIA/C基因与胃癌发病的相关性,结果显示,FgBβ链-1689T/G位点的基因型和等位基因频率与胃癌发病没有关联性,FgBβ链-HinfⅠA/C位点的AC基因型和C等位基因与胃癌有相关性(95%CI为1.105~3.224,OR=1.888,χ2=5.488,P<0.05;OR=1.737,95%CI为1.100~2.741,χ2=5.706,P<0.05)。提示AC基因型和C等位基因与胃癌的发病相关。见表6。
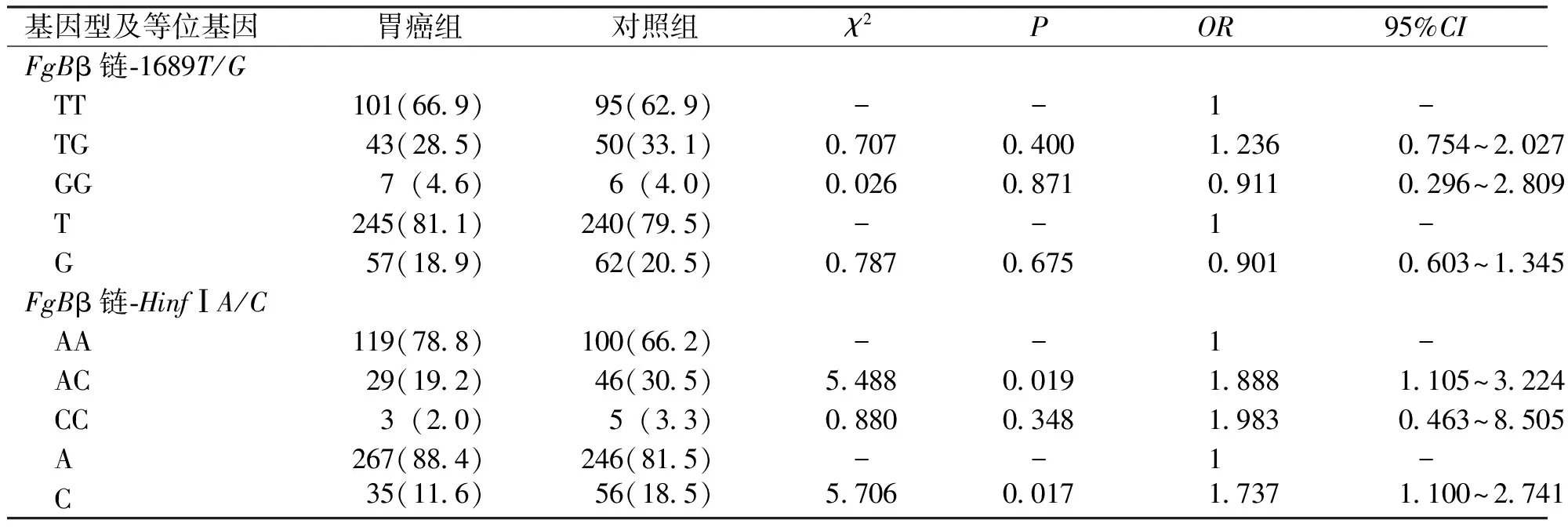
表6 FgB β链-1689T/G和HinfIA/C位点各基因型及等位基因对胃癌的相对危险度[n (%)]Tab.6 The relative risk of each genotype and allele of FgB β chain-1689T/G and HinfIA/C to gastric cancer[n (%)]
2.7 胃癌组和对照组FgB β链-1689T/G和β链-HinfⅠA/C位点基因连锁不平衡分析
通过计算连锁不平衡系数分析基因间是否存在连锁平衡。结果显示,FgBβ链-1689T/G和β链-HinfⅠA/C位点在胃癌组为弱连锁不平衡(r2=0.017),在对照组为弱连锁不平衡(r2=0.032)。见表7。

表7 FgB β链-1689T/G和HinfIA/C位点的连锁不平衡分析Tab.7 Analysis of linkage disequilibrium between FgB β chain-1689T/G and HinfIA/C
2.8 FgB β链-1689T/G和β链-HinfⅠA/C位点的单倍体型分析及各单倍体型对胃癌的相对危险度比较
结果显示,胃癌组T*A单倍体型和对照组比较差异有统计学意义(χ2=4.239,P<0.05),提示T*A单倍体型可能与胃癌发病有关联(OR=1.430,95%CI为1.017~2.011)。T*C 和G*A 单倍体型在胃癌组和对照组之间的分布差异无统计学意义(χ2=5.336,P>0.05;χ2=0.167,P>0.05)。G*C单倍体型分布频率因2组均<3%、而被删除,不再继续进行分析。见表8。

表8 FgB β链-1689T/G、HinfIA/C位点的单倍体型分析及各单倍体型对胃癌的OR比较Tab.8 Haplotype analysis of the two gene loci of FgB β chain-1689T/G and HinfIA/C and comparison of OR of each haplotype to gastric cancer
3 讨论
Fg作为体内重要的凝血因子之一,它的调控功能和功能表达的研究热度居高不下。在近年的研究中,Humphries等[14]揭示Fg的三条链具有多个基因多态性的位点,并对基因的遗传调控在Fg表达水平上的影响进行了初步研究,显示大概有51%的Fg表达水平异常和结构功能异常与基因遗传缺陷有一定的相关性[15];也有学者认为在FgBβ链合成mRNA 的过程是调节Fg 分子合成的关键步骤,因此它的基因学特点是决定Fg功能表达的重要影响因素之一[16]。另外,研究显示在基因的结构上,FgBα链位于整个基因群的中间,而γ链和β链基因位于基因群的两侧,链和链基因被前后串联在一起,向模板链基因相反的方向进行转录,这3种基因的转录是相互协调进行的,如果增加其中一条链的mRNA 转录也能增加其它两条链的转录,进而增加了Fg的分泌和合成。 整个FgBβ链的转录区拥有8.1 kb的基因长度,7个内含子占据6.2 kb,大概占据总长度的76.5%,而剩下的8个外显子仅占据基因总长度23.5%,只有1.9 kb。由于绝大多数的基因突变发生在内含子当中,而且内含子区域里的基因位点并没有直接参与到mRNA转录合成,这些因素导致了人体对基因突变的耐受能力得到了显著增加。
在本次研究中,胃癌组和对照组的性别、年龄分布差异都无相关性,而且这两个基因的多态性位点在胃癌组及对照组的等位基因频率分布都与Hardy-Weinberg 平衡定律相吻合,提示此次研究的人群具有群体代表性。本研究结果显示FgBβ链-1689T/G等位基因G频率为 20.5% ,与LiuY等[17]报道的G1689频率24.0%接近,与吴方等人[18]对上海正常人群G1689频率研究结果为55.2%相比过低。在本次的研究中发现FgBβ链-HinfIA/C等位基因C频率为11. 6%,有学者对我国海南正常汉族人群中的C频率研究结果为13.4%[19],这与本研究的结果基本相同。在本次研究中,FgBβ链-1689T/G位点的基因型和等位基因的分布在两组被检者之间没有差异性,而FgBβ链-HinfIA/C位点的基因型和等位基因在两组之间之间有差异性,提示FgBβ链-HinfIA/C位点基因多态性与胃癌的发病有一定的相关性。胃癌组危险度评价结果显示, 在FgBβ链-1689T/G位点中以TT基因型和T等位基因相比较,有TG、GG 基因型和G等位基因的胃癌发病风险分别是有TT基因型和T等位基因的1.236倍、0.911倍和0.901倍,P>0.05,差异无统计学意义。在FgBβ链-HinfIA/C位点中以AA型和A等位基因相比较,结果显示,有AC基因型和C等位基因的胃癌发病率是有A等位基因的1.737倍、P=0.017,是有AA基因型的1.888倍、P=0.019,具有统计学差异;而有突变纯合子CC型胃癌的发病风险是拥有AA型的1.983倍、P>0.05,没有明显差异性,由此得出FgBβ链-HinfIA/C位点基因的突变可能是胃癌发生的重要因素。另外,C等位基因可能也是胃癌发生的因素之一,对FgBβ链-HinfIA/C和β链-1689T/G基因的多态性与胃癌的转移及临床分期相比较,可以发现FgBβ链-HinfIA/C和β链-1689T/G位点的基因多态性在胃癌的转移及临床分期方面均无明显统计学意义(P>0.05)。
通过基因连锁不平衡分析发现,FgBβ链-1689T/G和β链-HinfⅠA/C之间存在弱连锁不平衡,这与元小冬等[13]、梁亮等[20]的研究结果一致。对胃癌组及对照组FgBβ链-1689T/G和HinfIA/C间的配对单倍体型分析,当FgBβ链-1689T/G和β链-HinfIA/C两位点间呈单倍体型T*A时、胃癌的发病率明显高于对照组,而当其呈单倍体型T*C时、胃癌的发病率明显低于对照组,此结果提示当等位基因T1689和AHinfⅠ同时存在时可能存在协同作用、从而增加胃癌发生的危险性,而单倍型T*C可能与降低胃癌的风险相关,可能是保护性单倍体型。
本项研究结果提示,FgBβ链-HinfIA/C和β链-1689T/G位点的基因多态性与胃癌的发病存在较大的相关性,两位点间形成的T*A单倍体型能极增加胃癌的发生率(P<0.05),而单倍体型T*C能降低胃癌的发生率;另外,FgBβ链-HinfIA/C位点的C等位基因有可能是胃癌发生的遗传风险因素之一。
