金樱子天然硒多糖的结构表征及其体外活性
2021-11-04刘学贵张雪迈德高品一李丹琦
刘学贵,张雪,迈德,高品一,李丹琦,
1.沈阳化工大学功能分子研究所(沈阳 110142);2.沈阳化工大学制药与生物工程学院(沈阳 110142);3.沈阳化工大学国际教育学院学院(沈阳 110142);4.硼镁资源开发与精细化工技术国家地方联合工程实验室(沈阳 110142);5.辽宁省绿色功能分子设计与开发重点实验室(沈阳 110142)
金樱子(Rosa laevigataMichx.)为蔷薇科常绿蔓性灌木[1],富含多糖类、黄酮类、三萜类及其衍生物等有效成分。其中,金樱子果实中多糖含量最为丰富,现代药理研究表明,金樱子果实多糖具有抗氧化[2]、抗肿瘤[3]、抗病毒和调节免疫等功能。近年来,金樱子多糖的功能性研究成为科研工作者关注的热点[4]。
硒是人体所必需的微量营养元素,可以增强机体的抗氧化能力,抵御相关疾病的发生。中国是一个缺硒大国[5],开发高效的天然硒食品具有重要意义[6]。天然硒多糖具有毒性低、生物功效好等特点,越来越受到关注。天然硒多糖不仅具有高免疫活性和良好的生物相容性,而且可以提高硒元素的生物利用度,发挥硒的功能性作用[7]。Huang等[8]的研究发现灰树花植物中天然硒多糖的生物活性通常高于硒和天然多糖,且更容易被人体吸收利用;Gu等[9]研究结果表明,茶叶中天然硒多糖SeTPS-1和SeTPS-2均表现出良好的抗氧化能力和对H2O2诱导的DNA损伤的保护作用;还有研究者发现水稻胚芽硒多糖对小鼠具有极低的毒性和较高的生物吸收能力。同时,其体外抗氧化活性试验结果表明,水稻胚芽硒多糖清除羟基、DPPH和超氧自由基的能力高于天然多糖[10]。
试验以金樱子果实为原料,使用热水法提取多糖,酶解法联合Sevage法去除蛋白,分离纯化得到一个新的天然硒多糖(Se-RLFP-1-1),通过傅立叶变换红外光谱、核磁共振光谱、高效液相色谱等对天然硒多糖的结构特征进行表征分析;研究天然硒多糖的体外抗氧化活性和神经保护活性,结果表明该天然硒多糖具有明显的抗氧化活性和神经保护活性。
1 材料与方法
1.1 材料与试剂
金樱子(来源于安徽省亳州市);乙醇、正丁醇、二氯甲烷、浓硫酸、高氯酸、硒标准溶液等均为国产分析纯试剂;葡萄糖(Glu)、半乳糖(Gal)、甘露糖(Man)、阿拉伯糖(Ara)等标准品(北京瑞达恒辉科技发展有限公司);1.1-二苯基-2-三硝基苯肼(DPPH),2,2’-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),牛血清蛋白,MTT(中国生物化学试剂科学与技术公司);SH-SY5Y细胞(中国科学院干细胞库)。
1.2 仪器和设备
UV分光光度计(UV-2550)、示差折光检测器RID-20A(日本岛津有限责任公司);Rotavapor R-3旋转蒸发仪(瑞士BUCHI公司);双道原子荧光光谱仪(北京金索坤技术开发有限公司);傅立叶变换红外分光光度计(美国ThermoNicole公司);酶标仪(美国Bio-Rad Laboratories公司)。
1.3 试验方法
1.3.1 粗多糖的制备
取200 g干燥的金樱子果实,将其粉碎后通过0.425 mm孔径筛,加入20倍体积的石油醚加热提取3次,每次1 h,除去脂溶性物质,其残余物留用。称取适量残余物,加热回流提取3次,用4倍体积的乙醇,每次2 h,除去单糖和皂苷等小分子,剩余滤渣烘干待用。准确称取一定量的滤渣,按照料液比1∶50(g/mL)加入蒸馏水,热回流3次,每次1 h,收集浓缩提取液,得到粗提物。用酶解法+3次Sevage法联合[11]去除蛋白,最后放置于50 ℃烘箱中干燥得到粗多糖。
1.3.2 粗多糖的分离纯化
称取200 mg粗多糖样品,加入适量的蒸馏水溶解,上样到大孔树脂柱,挂柱12 h。以蒸馏水作为流动相进行洗脱,收集洗脱液,浓缩后使用透析膜(3500 Da)透析24 h后,将溶液过0.45 μm滤膜,上样到DEAE-52纤维素柱,依次用蒸馏水及0.1 mol/L、0.2 mol/L NaCl 溶液洗脱,每个梯度洗脱体积500 mL左右,使用试管收集洗脱液(每管10 mL,流速0.8 mL/min),采用苯酚-硫酸法[12]在490 nm波长下测定洗脱液的吸光度,绘制洗脱管数与吸光度之间的关系曲线,收集单一对称峰形对应的管数。收集的洗脱液经减压浓缩,装入1000 Da透析袋中透析除去NaCl和小分子化合物,得到样品。选取一定量收集的样品于Sephadex G-200凝胶柱中,用蒸馏水洗脱样品,收集洗脱液(每管10 mL,流速0.5 mL/min),按1.3.2方法进行检测,收集样品冻干后得到纯化后的天然多糖。
1.3.3 天然多糖的理化性质测定
采用苯酚-硫酸法[12]测定多糖含量。以葡萄糖为标准品,用蒸馏水配制成0.01,0.02,0.03,0.04和0.05 mg/mL葡萄糖标准溶液,以吸光度y为纵坐标,以葡萄糖质量浓度x为横坐标,得到标准回归方程y=11.9x-0.011(R2=0.9952),线性范围为0.01~0.05 mg/mL,根据标准回归方程,进一步计算多糖含量,如式(1)所示。

采用考马斯亮蓝法[13]测定粗多糖的蛋白含量。以牛血清蛋白为标准品,取0.20,0.40,0.60,0.80和1.00 mL标准牛血清白蛋白溶液于试管中,以吸光度y为纵坐标,以蛋白质量浓度x为横坐标,得出标准回归方程y=6.42x+1.0058(R2=0.9969),线性范围为0.20~1.00 mg/mL,根据标准回归方程,进一步计算蛋白含量,计算如式(2)所示。

1.3.4 天然多糖的硒含量测定
称取5 mg天然多糖样品于锥形瓶中,加入混合消解液(浓硝酸10 mL、高氯酸4 mL),室温下反应18 h。在180 ℃条件下消化,待溶液呈现无色或微黄色时,加入10 mL的盐酸继续消化,溶液剩余1 mL左右,停止反应进行冷却,同时做1组空白试验。在溶液中继续加入10 mL盐酸和19.5 mL蒸馏水稀释(使比色管中盐酸浓度10%),对天然多糖进行硒含量检测。
标准曲线的配制:取2.5 mL硒标准溶液(100 μg/mL)用10%盐酸配成0.1 g/mL储备液。将储备液配制成不同质量浓度的硒标准溶液(0,5,10,20和40 ng/mL)。
试验条件:灯电流80 mA;负高压-380 V;主气流量600 mL/min;主泵流速100 r/min;采样延时12 s;积分时间5 s。
1.3.5 天然硒多糖的分子量测定
称取葡聚糖标准品(T4,T10,T20,T40,T200和T500),分别用纯净水制成10 mg/mL标准品溶液,过滤膜进示差液相,记录每个色谱峰的保留时间,以出峰时间为横坐标,标准葡聚糖的分子量对数(lgMr)为纵坐标,绘制标准曲线方程;将天然硒多糖样品配制成10 mg/mL溶液,过滤膜后进液相色谱,将样品保留时间带入标准曲线得出其相对分子质量。
色谱条件:A TSK gel G5000PW column(I.D.=7.5 mm,L=300 mm);流动相为0.02 mol/L KH2PO4;流速0.6 mL/min;进样量40 μL。
1.3.6 天然硒多糖的单糖组成测定
配制标准单糖混标溶液(葡萄糖、半乳糖、木糖、甘露糖等),各取5 mg混合,用1 mL(V乙腈∶V水=82∶18)溶解,配制成5 mg/mL混合标准溶液,过0.22 μm有机滤头待用。根据标准品单糖的色谱图来确定待测多糖样品中的单糖组成。
采用酸水解方法[14]确定单糖组成。称取20 mg天然硒多糖(Se-RLFP-1-1),用10 mL 4 mol/L三氟乙酸溶解,在110 ℃油浴条件下反应6 h;于50 ℃旋蒸,少量多次加入甲醇带走残留的三氟乙酸,过滤后进行液相色谱分析。
色谱条件:sugar column(I.D.=4.6 mm,L=250 mm);流动相为V乙腈∶V水=82∶18;流速0.4 mL/min;进样量50 μL。
1.3.7 天然硒多糖的红外光谱测定
取3.0 mg干燥的天然硒多糖样品和适量干燥KBr粉末,一起放于玛瑙研钵中,研磨并混合后压片,多糖的红外光谱测定在4000~500 cm-1扫描范围内进行[8]。
1.3.8 天然硒多糖的核磁共振波谱测定
准确称取30 mg天然硒多糖样品加入1 mL D2O(重水)充分溶解后,装入核磁管中,在25 ℃下测定其1H-NMR和13C-NMR。
1.3.9 天然硒多糖的体外活性
1.3.9.1 DPPH自由基清除试验[8]
将待测多糖样品和VC标准品配制成不同质量浓度(0.005,0.020,0.080,0.300,0.800,2.000和5.000 mg/mL)的溶液,依次加入0.2 mmol/L的DPPH乙醇溶液,在室温下避光反应30 min,在517 nm波长下测定不同浓度溶液的吸光度,以VC溶液为阳性对照,每个浓度做3组平行试验,DPPH自由基清除率(R)按式(3)计算。
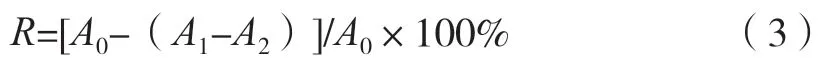
式中:A0为无水乙醇+DPPH乙醇溶液的吸光度;A1为待测样品+DPPH乙醇溶液的吸光度;A2为待测样品+无水乙醇的吸光度。
1.3.9.2 ABTS自由基清除试验[9]
将待测多糖样品和VC标准品配制成不同质量浓度(0.005,0.020,0.080,0.300,0.800,2.000和5.000 mg/mL)的溶液,按顺序依次加入一定量的7 mmol/L的ABTS工作液,混合完全后,在室温下避光反应10 min,在734 nm波长处检测吸光度,以VC溶液为阳性对照,每个浓度做3组平行试验,ABTS自由基清除率(R)按式(4)计算。
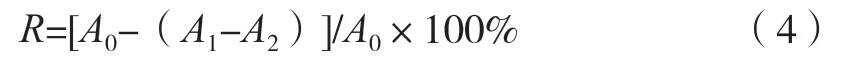
式中:A0为无水乙醇+ABTS溶液的吸光度;A1为待测样品+ABTS溶液的吸光度;A2为待测样品+无水乙醇的吸光度。
1.3.9.3 神经细胞保护活性
采用MTT方法进行检测[15]。取对数生长的SH-SY5Y细胞,加入50 μL 850 μmol/L H2O2溶液损伤细胞,作用1 h后,样品组加入不同浓度的多糖溶液(25,50和100 μmol/L),作用4 h后,每孔加入20 μL MTT溶液,置于培养箱孵育4 h;每孔加入150 μL二甲基亚砜(DMSO)溶液,轻微振荡10 min,使结晶充分溶解。在490 nm波长下测吸光度,以维生素E溶液为阳性对照,重复每组试验3次,神经细胞保护活性存活率R(%)按式(5)计算。

式中:A空白对照为基础培养基+H2O2+MTT+DMSO的吸光度;A阳性对照为SH-SY5Y细胞+H2O2+MTT+DMSO的吸光度;A给药组为SH-SY5Y细胞+样品+H2O2+MTT+DMSO的吸光度。
2 结果与分析
2.1 多糖的分离与纯化
金樱子果实经石油醚除脂、乙醇除去皂苷小分子、除色素、去蛋白、透析烘干等步骤后,得到粗多糖。粗多糖通过DEAE-52纤维素柱分离,以0,0.1,0.2,0.3和0.5 mol/L NaCl溶液洗脱;其中用0.2 mol/L NaCl洗脱时得出1个明显主峰,见图1(a),命名为Se-RLFP-1。Se-RLFP-1继续使用凝胶G-200进行纯化,见图1(b),得到单一的洗脱峰,收集、透析、浓缩和冻干后得到淡黄色粉末,命名为Se-RLFP-1-1。
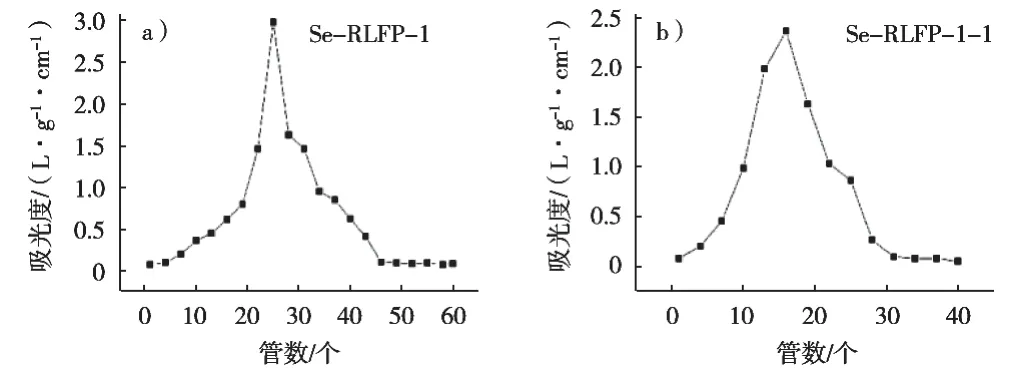
图1 DEAE-52纤维素柱(a)洗脱曲线和Sephadex G-200凝胶柱(b)洗脱曲线
2.2 粗多糖的理化性质分析
2.2.1 多糖含量的测定
依据1.3.3苯酚-硫酸法测定粗多糖中的糖含量,多糖含量为82.32%;测定纯天然硒多糖(Se-RLFP-1-1),多糖含量为86.23%。
2.2.2 多糖的蛋白测定
依据1.3.3考马斯亮蓝法测定粗多糖中的蛋白质含量,使用酶解法+3次Sevage法后测定的蛋白含量基本稳定在0.56%,如图2所示。
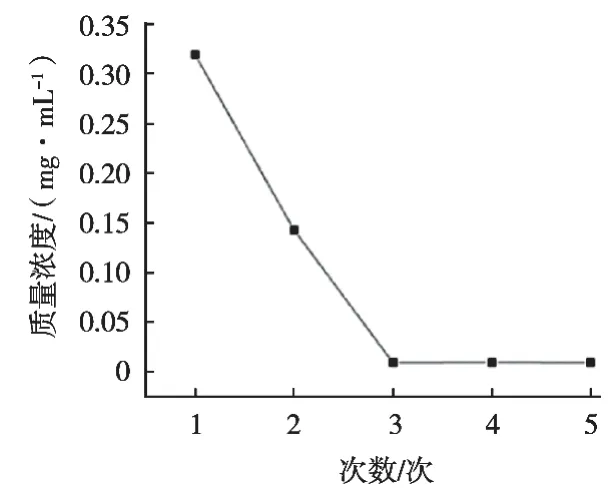
图2 蛋白含量与Sevage法的次数的相关曲线
2.3 天然多糖的硒含量测定
依据1.3.4方法,得到的标准曲线回归方程为y=39.9675x+120.0875(R2=0.9990)式中,x为浓度(ng/mL),y为荧光强度;计算得到Se-RLFP-1-1的硒含量为19.72 μg/g。
2.4 天然硒多糖的分子量及其单糖组成
如表1所示:根据1.3.5绘制的标准曲线方程为lgMw=-0.53506RT+12.9917(R2=0.9948),Se-RLFP-1-1进入液相,出峰时间为15.998 min,相对分子质量为27.0 kDa。
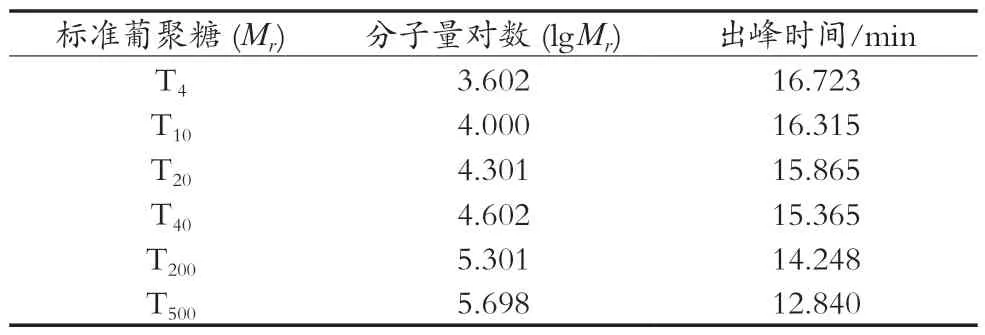
表1 标准葡聚糖出峰时间
如图3(a)所示:在色谱条件下对7种标准单糖混合物进行分离。如表2所示,将每种单糖的出峰时间和峰面积绘制为每种单糖的标准曲线,所测试的7个单糖标准品的峰面积与标准品的浓度具有良好线性关系,并且拟合度很高。Se-RLFP-1-1根据1.3.6色谱条件下测定,结果见图3(b),Se-RLFP-1-1的单糖组成为鼠李糖、木糖、甘露糖、葡萄糖,其摩尔比为0.13∶0.49∶0.05∶0.34。
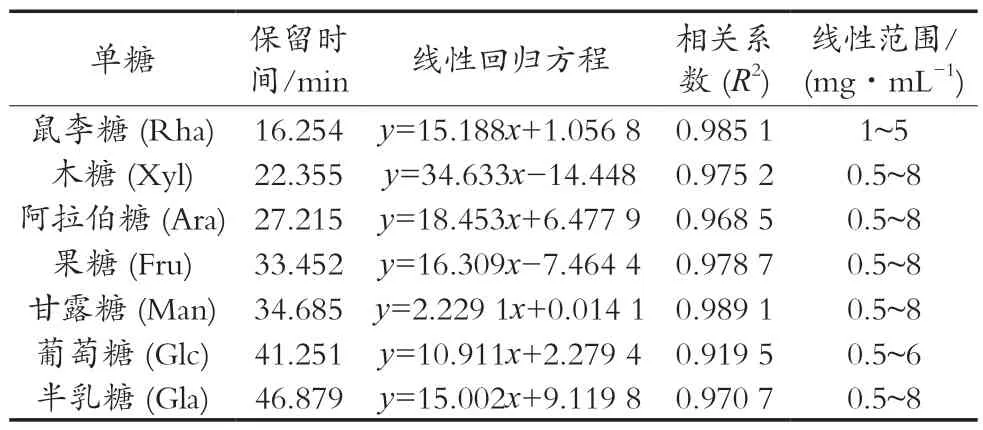
表2 单糖的标准曲线方程
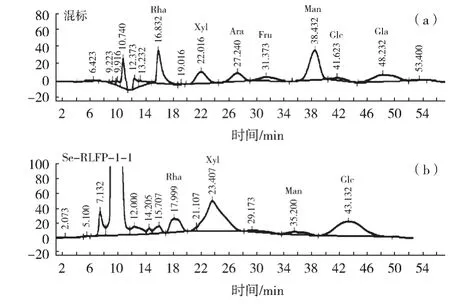
图3 7种单糖标准品混合物的高效液相色谱图(a)及Se-RLFP-1-1的高效液相色谱图(b)
2.5 天然硒多糖的红外图谱分析
如图4所示:Se-RLFP-1-1的红外光谱图具有多糖类物质的典型特征吸收峰[7],在3423 cm-1处的吸收宽峰归属于O—H伸缩振动[16],在2926 cm-1处的峰值被归属于鼠李糖甲基的C—H对称伸缩振动引起的[17],在1631 cm-1处的吸收峰归属于Se-RLFP-1-1的结合水(H—O—H)伸缩振动[18],在1419 cm-1处的峰值为多糖的CH2剪切振动和弯曲振动引起[19],在1230 cm-1处为C—O—C或C—O的伸缩振动吸收峰。在843 cm-1附近的吸收峰是α-糖苷键的特征吸收峰[20],这个吸收峰出现在539 cm-1处,是由于Se—O—C或Se—OH非对称拉伸振动导致的,表明硒元素与多糖上的—OH相连[21]。
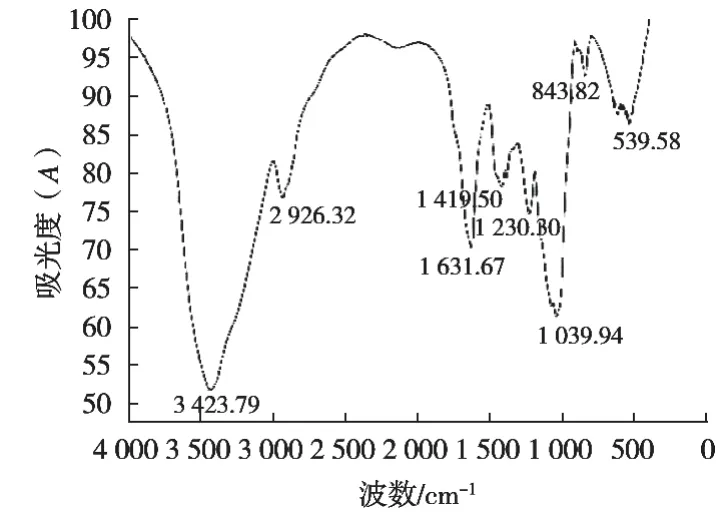
图4 Se-RLFP-1-1红外光谱图
2.6 天然硒多糖的核磁共振谱图分析
在图5(a)中,在δ1.18和1.24 ppm处的信号代表Se-RLFP-1-1中鼠李糖甲基的存在[22]。信号在δ1.98 ppm处为乙酰基质子信号[23]。δ3.27~4.10 ppm的信号范围代表糖苷环上的H-2到H-5(或H-6)质子信号[24]。在多糖的氢谱中,化学位移δ5~6 ppm为α端基质子信号,δ4.4~5 ppm为β端基质子信号[25]。在Se-RLFP-1-1的1H谱中,δ5.10和5.13 ppm分别为甘露糖和鼠李糖的的α端基质子信号,δ4.44和4.45 ppm分别为半乳糖和木糖β端基质子信号[26]。
在图5(b)中,端基碳原子信号出现在δ90~110 ppm,非端基碳原子信号出现在δ60~85 ppm。高场区的δ21.9 ppm为鼠李糖的甲基信号。δ65.8~83.4 ppm为Se-RLFP-1-1中其他连氧碳信号,由于糖残基中C-2到C-6的共振引起[27]。
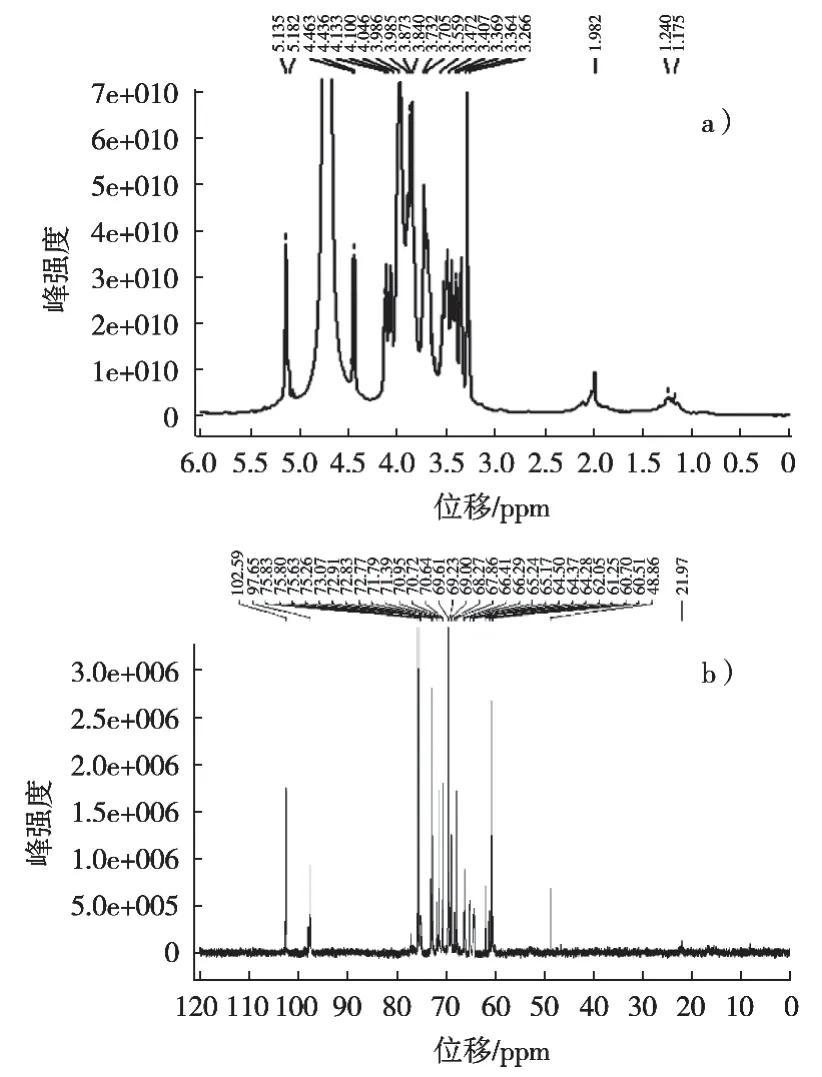
图5 Se-RLFP-1-1的1H NMR谱图(a)和13C NMR谱图(b)
2.7 天然硒多糖的体外活性
2.7.1 DPPH清除自由基试验
如图6所示,Se-RLFP-1-1对DPPH自由基的清除能力随浓度增加而逐渐升高。结果表明,Se-RLFP-1-1清除DPPH自由基的IC50值为0.0612 mg/mL;在0.005~0.3 mg/mL浓度范围内的自由基清除力较低,可能是多糖中供氢能力减弱导致DPPH自由基结合较少,影响其抗氧化活性[28]。在0.8~5 mg/mL范围内自由基清除能力有较大幅度升高,特别在5.0 mg/mL浓度下,Se-RLFP-1-1的清除率达到84.96%,说明该天然硒多糖具有明显的DPPH自由基的清除能力。
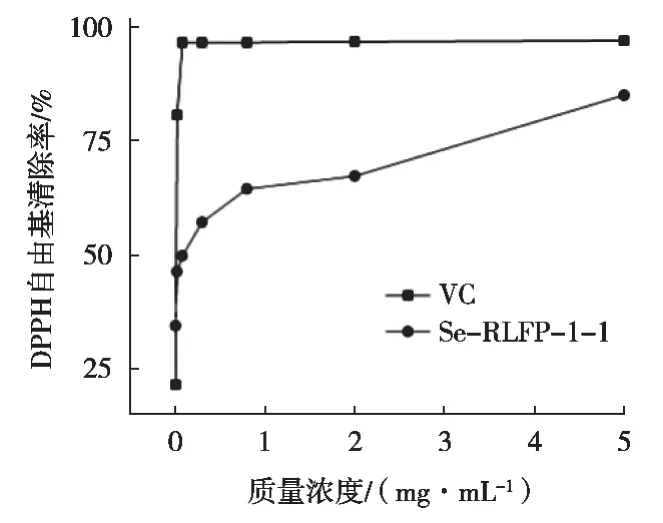
图6 VC和Se-RLFP-1-1对DPPH自由基的清除能力
2.7.2 ABTS清除自由基试验
如图7所示:Se-RLFP-1-1对ABTS自由基有清除能力随浓度增加而升高,说明其具有一定的ABTS清除自由基能力;浓度达到最大值时,Se-RLFP-1-1多糖的清除能力同时也达到最大值,且质量浓度0.08~0.8 mg/mL时清除率逐渐趋于稳定,说明H原子转移的自由基淬灭或通过单电子转移的还原,对稳定自由基ABTS产生清除能力较为稳定[29]。
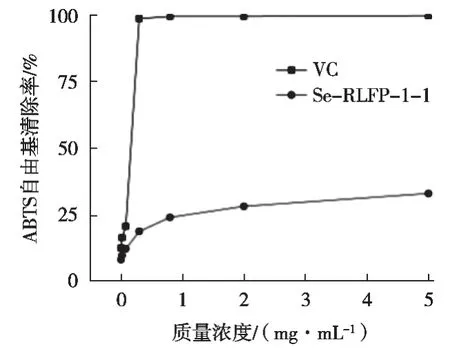
图7 VC和Se-RLFP-1-1对ABTS自由基的清除能力
2.7.3 神经细胞保护活性
如图8所示:与空白组细胞相比细胞存活率为100%,SH-SY5Y细胞经H2O2处理后的模型组细胞存活率降低至62%;多糖对SH-SY5Y细胞的保护活性随着样品浓度增加而增加;浓度为最大100 μmol/L时,神经保护活性为84%,明显高于阳性对照组(维生素E)77.75%,同时在其他浓度下也都高于阳性对照(维生素E),说明该天然硒多糖具有显著的神经细胞保护活性作用。
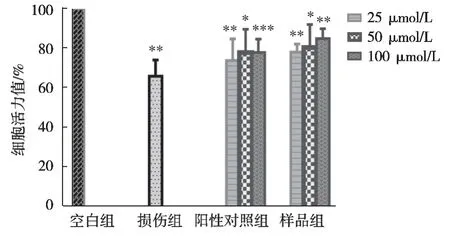
图8 Se-RLFP-1-1对H2O2诱导的SH-SY5Y细胞神经保护活性
3 结论
从金樱子果实中提纯到一个新的天然硒多糖(Se-RLFP-1-1),通过原子荧光光谱仪测出Se-RLFP-1-1的硒含量为19.72 μg/g。其单糖组成和摩尔比为鼠李糖∶木糖∶甘露糖∶葡萄糖=0.13∶0.49∶0.05∶0.34。该天然硒多糖的红外光谱及核磁共振谱图进一步推断出其的初步结构。体外活性试验表明,该多糖对于DPPH自由基和ABTS自由基均具有明显的清除作用,且随浓度增加清除率逐渐升高;而其对H2O2诱导SH-SY5Y细胞损伤表现出显著的保护作用。制备的天然硒多糖具有明显的抗氧化活性和神经细胞保护活性,为金樱子天然硒多糖的研究提供理论依据,并为金樱子在功能性食品及神经细胞保护疾病药物的开发奠定基础。
