不同发酵条件对糙米酵素中植酸酶和GABA的影响
2021-11-04杨闯邢志超李境艺李帅于靖辉王俊玲
杨闯,邢志超,李境艺,李帅,于靖辉,王俊玲
吉林农业科技学院(吉林 132101)
发芽糙米是一种具有全营养概念及特殊营养价值的功能性主食或配料[1]。发芽糙米制备工艺研究是实现发芽糙米产业化的首要环节[2]。糙米酵素是以糙米为营养来源,加入一定量的蜂蜜、玉米胚油,利用酵母菌发酵制得的[3]。经过发酵后,其中所含有的γ-氨基丁酸(GABA)等生理活性成分含量均显著提高。
植酸,因其含有6个磷酸基团,又被称为肌醇六磷酸,是一种抗营养因子,具有很强的金属螯合能力,与金属反应容易产生不易溶解的盐类[4]。植酸酶,是能将磷酸残基从植酸上水解下来的一类酶的总称[5],广泛存在于植物、微生物、动物组织中,微生物中的细菌、酵母菌和霉菌都可以产生植酸酶[6]。植酸酶的使用可替代饲料中所添加的无机磷,从而可以缓解中国磷资源匮乏、磷供应不足的局面,其社会效应显著[7]。
植酸酶和GABA是糙米酵素中的关键营养元素,因此,试验以发芽糙米为原料,利用酵母菌发酵制备糙米酵素,以植酸酶酶活力和γ-氨基丁酸质量浓度为指标探究最佳发酵条件,为进一步提高糙米酵素中的营养成分及生产糙米酵素相关食品奠定基础。
1 材料与方法
1.1 材料
马铃薯、糙米等(市售);安琪活性干酵母(市售);次氯酸钠、氯化钙、葡萄糖、硫酸镁、磷酸氢二钾、硫酸铵、氯化钠、γ-氨基丁酸标准品、碳酸钠、四硼酸钠、苯酚、乙醇、琼脂、蔗糖、磷酸二氢钾、植酸钙、钼酸铵、钒酸铵、硝酸、乙酸等(均为分析纯)。
1.2 仪器与设备
MLS-3750高压蒸汽灭菌锅(三洋电机株式会社);SW-CJ-2FD净化工作台(上海新苗医疗器械制造有限公司);UV-2700紫外分光光度计(日本岛津公司);AL204-IC电子天平(梅特勒-托利多仪器上海有限公司);DK-V205三用恒温水浴锅(上海精宏实验设备有限公司);HZQ-F160A高低温恒温振荡培养箱(上海一恒科技有限公司);DHG-9240A电热鼓风干燥箱(上海一恒科学仪器有限公司);HC-100T多功能粉碎机(河城工贸有限公司);GL-20G-Ⅱ高速离心机(上海安亭科学仪器厂)。
1.3 糙米的预处理
参照侯利娟等[8]的方法处理后,备用。
1.4 菌种的制备
将酵母菌接种到2%蔗糖溶液中,调节pH 4.5~5.0,于38 ℃水浴30 min,于恒温摇床中培养过夜。第2天,将其接种至PDA平板培养基上培养过夜。第3天,培养基上生长出菌落后,筛选出长势良好、活力旺盛、表面光滑有光泽的单菌落,接种于PDA液体培养基中,振荡培养过夜即为可直接用于接种的酵母菌菌种。
1.5 植酸酶酶活力测定
无机磷标准曲线的绘制[9-10]:按需求精确称取已烘至恒重的KH2PO4粉末,充分溶解,用容量瓶定容,制备成浓度50.0 mmol/L的KH2PO4溶液。将配制好的KH2PO4溶液按比例稀释成25,12.5,6.25,3.125和1.5625 mmol/L不同梯度浓度。分别取0.1 mL不同梯度浓度的标准液,分别加入0.9 mL 0.25 mol/L的乙酸缓冲液,充分振荡后,在37 ℃水浴锅中放置5 min,依次加入2 mL 7.5 mmol/L的植酸钙溶液,充分振荡后,放置于37 ℃水浴锅中反应30 min,向各个反应体系中分别加入2 mL提前配制好的钒钼终止液,充分混匀,在波长415 nm处测定吸光度。绘制相应的无机磷标准曲线。
酶活性单位(U)定义为在37 ℃的条件下,每分钟从0.005 mol/L的植酸钙溶液中释放出1 nmol无机磷所需要的酶量为1个酶活单位。
样品中植酸酶酶活力的测定[11]:将所制得的样品离心,取其上清液,按照表1反应顺序进行反应,在波长415 nm处测定吸光度。将所测定的吸光度代入到所制得的方程中,同时结合所绘制的标准曲线,计算样品中无机磷浓度,进而计算出样品中植酸酶酶活力。
1.6 GABA的测定
1.6.1 GABA标准曲线的绘制
准确称取GABA标准品,分别配制成0,0.1,0.2,0.3,0.4和0.5 mg/mL的标准品溶液。取1.0 mL不同质量浓度标准品溶液置于冰浴中,加入0.2 mL 1.0 mol/L碳酸钠溶液,1.0 mL 0.01 mol/L四硼酸钠缓冲液,终止反应。加入1.0 mL质量分数6%的苯酚溶液,5.0 mL质量分数7.5%的次氯酸钠溶液,充分振荡混匀后放置于沸水浴中反应10 min,为防止试管破碎,先用流水冷却后,放置于冰水浴中冷却20 min。等待试管中的反应体系出现蓝绿色后加入2.0 mL 60%乙醇,充分振荡混匀后在波长640 nm处测定吸光度。绘制相应的GABA标准曲线。
1.6.2 样品中GABA的测定
参考Berthelot比色法[12],并做出一些改进,从而对GABA质量浓度进行测定,将样品离心,取其上清液,按照表2反应顺序进行反应,在波长640 nm处测定吸光度。将所测定的吸光度代入到所制得的方程中,同时结合所绘制的标准曲线,计算样品中GABA质量浓度。空白管中不含GABA,操作同样品管。

表2 GABA含量测定反应流程
2 结果与分析
2.1 无机磷标准曲线的绘制
以无机磷浓度作为横坐标,吸光度作为纵坐标,绘制相应的无机磷标准曲线(见图1),得到方程y=0.04x-0.0233,其相关系数R2=0.9974。

图1 无机磷标准曲线
2.2 GABA标准曲线的绘制
绘制GABA的标准曲线(见图2),其中横坐标为GABA质量浓度,纵坐标为吸光度(A),得到方程y=1.6916x+0.0339,其相关系数R2=0.9959。

图2 GABA标准曲线
2.3 植酸酶单因素试验结果与分析
2.3.1 培养温度对植酸酶的影响
从25 ℃开始依次选取4个不同培养温度,在糙米培养基中接种3%酵母菌种,在120 r/min条件下发酵6 h,每个条件做3次平行,分别测定其植酸酶酶活力。
分析图3可得:植酸酶酶活力在25~35 ℃范围内逐渐增加,植酸酶酶活力的峰值点是温度达到35 ℃时,此时的吸光度为0.216,植酸酶酶活力为19.98 U/mL。温度高于35 ℃,植酸酶酶活力逐渐下降,适宜的温度是增加营养物质转化合成的必要条件,太高或者太低的温度均会使酶活受到影响。所以正交试验选取培养温度30,35和40 ℃这3个水平。
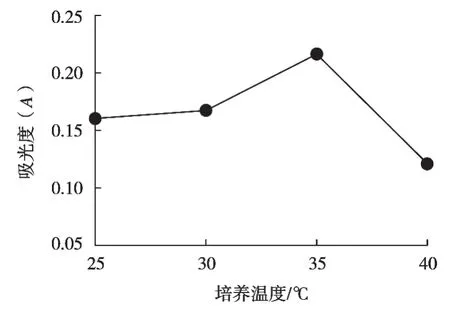
图3 培养温度对植酸酶的影响
李海燕等[13]通过黑曲霉植酸酶发酵工艺优化研究发现,黑曲霉发酵产植酸酶的最适发酵温度为30 ℃,此时植酸酶酶活最高为19.02 U。若培养温度与菌体的适宜温度相差较大,都会对菌体的生长代谢产生影响。出现此种情况,主要是因为菌种不同造成的。
杨燕凌等[14]通过对Aspergullus nigerFZ41产植酸酶菌株的筛选及其产酶条件的研究发现,从20 ℃开始,依次递增5 ℃的5个发酵条件中,植酸酶酶活在30℃时达到峰值,在20 ℃时达到最低,在25 ℃和35 ℃时都有所下降,因此得出最佳发酵温度为30 ℃。出现此种情况,推测原因可能是所使用菌种有所差异。
2.3.2 培养时间对植酸酶的影响
从6 h开始依次选取5个不同培养时间,在糙米培养基中接种3%酵母菌种,在30 ℃、120 r/min条件下分别发酵不同的时间,每个条件做3次平行,分别测定其植酸酶酶活力。
分析图4可得:培养时间在6~8 h范围内,植酸酶酶活力随着培养时间增加而增加。植酸酶酶活力在培养时间8 h时达到峰值,此时的吸光度为0.393,植酸酶酶活力为34.73 U/mL。培养时间大于8 h,随着培养时间增加而下降,分析其原因有可能是培养时间越长,培养条件越不适合于菌体生长。另外产物的合成主要在酵母菌生长的稳定期,培养时间越长,酵母菌可能进入衰亡期。因此正交试验中培养时间选取6,8和10 h这三水平。

图4 培养时间对植酸酶的影响
何锡杲[15]研究不同发酵条件对植酸酶基因工程菌E-22产植酸酶的影响,结果发现接种时间12~48 h时,所得植酸酶酶活力虽然有起伏但相差不大,接种时间36 h左右植酸酶酶活力最高。出现这种情况的原因推测是其所用菌种与试验不同,不同菌种的最适生长条件不同,所以造成试验结果不同。
田运佳[7]通过对植酸酶生产过程中主要影响因素的研究发现:培养时间16~24 h时,植酸酶酶活力呈现先上升后下降趋势,培养时间20 h时发酵液植酸酶酶活力达到峰值。
2.3.3 接种量对植酸酶的影响
在糙米培养基中接种5个不同接种量,将未接种菌种的培养基作为空白对照组。在30 ℃、120 r/min条件下发酵6 h,每个条件做3次平行,分别测定其植酸酶酶活力。
分析图5可得:接种量0~4%范围内,植酸酶酶活力随着接种量增加而增加。植酸酶酶活力达到峰值时的酵母菌接种量为4%,此时的吸光度为0.247,植酸酶酶活力为22.50 U/mL。随着接种量继续增加,植酸酶酶活力下降,分析其原因可能是随着接种量增加,酵母菌的菌体密度增大,导致培养基浓度达不到适用于菌体生长的最佳浓度,转化效率降低,从而导致发酵产物的产量降低。因此在正交试验中接种量选取3%,4%和5%这三水平。

图5 接种量对植酸酶的影响
赵海霞等[16]通过植酸酶基因工程酵母PP-NP~m-8培养条件研究发现,接种量3%~5%时,酵母不仅生长较好且接种量3%时培养液中酶含量最高,故接种量3%最佳。与试验结果不同,可能是使用菌种与其不同。
刘双赫等[17]通过对醋糟固态发酵产植酸酶工艺的研究发现:植酸酶酶活力随接种量增加而增加,接种量4%时,酶活达到最大值,为2.4 U/mL,接种量大于4%后,酶活随着接种量增加而降低,因此最佳接种量为4%。
2.4 GABA单因素试验结果与分析
2.4.1 培养温度对GABA的影响
从25 ℃开始依次选取4个不同的温度条件,在糙米培养基中接种3%酵母菌种,在120 r/min条件下发酵6 h,每个条件做3次平行,分别测定其GABA质量浓度。
分析图6可得:培养温度25~30 ℃时,GABA质量浓度随着温度升高而增加。GABA产量最高时所对应的培养温度为30 ℃,此时的吸光度为0.611,GABA含量为0.341 mg/mL。之后随着温度升高,GABA含量开始逐渐下降,太高或者太低的温度都会使GABA含量受到影响。所以正交试验选取培养温度25,30和35 ℃这3个水平。

图6 培养温度对GABA的影响
雷恒[18]在高产GABA的红曲菌种选育及发酵工艺优化研究中发现,在固态发酵条件下,GABA含量最高时,培养温度为30 ℃。之后随着温度升高,GABA产量降低,温度越高GABA产量下降越明显。可能是高温对微生物体内生物活性物质产生影响的缘故。
朱晓立等[19]在乳酸乳球菌发酵生产GABA的条件优化的研究中发现,乳酸乳杆菌在26,28,30,32,34和36 ℃培养温度中,最佳培养温度为30 ℃,GABA产量可达8.31 g/L。这表示GDA酶的适宜温度为30℃,若培养温度与GAD酶的适宜温度相差较大,会导致GAD酶活力下降。
2.4.2 培养时间对GABA的影响
在糙米培养基中接种3%酵母菌种,在30 ℃、120 r/min条件下发酵6,8,10,12和14 h,每个条件做3次平行,分别测定其GABA质量浓度。
分析图7可得:在一定范围内GABA质量浓度随培养时间增加而增加。培养时间8 h时,GABA质量浓度达到最大值,此时的吸光度为0.494,植酸酶酶活力为0.272 mg/mL。随着培养时间继续增加,植酸酶酶活力下降,分析其原因可能是培养时间越长,培养条件越不适合于菌体生长。另外产物的合成主要在酵母菌生长的稳定期,培养时间越长,酵母菌可能进入衰亡期。因此正交试验中培养时间选取6,8和10 h这三水平。

图7 培养时间对GABA的影响
上官文菲等[20]在响应面法优化发酵乳杆菌产GABA的培养条件研究中发现,乳杆菌菌种SD2112在48,60,72,84和96 h的发酵时间中,最佳发酵时间为72 h,发酵时间>72 h后,GABA产量趋于平缓,可能是由于发酵后期菌体进入稳定生长期,需将培养基中的底物缓慢转化。与试验结果不同,可能是因为菌种不同的影响。
2.4.3 接种量对GABA的影响
在糙米培养基中接种5个不同酵母菌种,将未接种菌种的培养基作为空白对照组。在30 ℃、120 r/min条件下发酵6 h,每个条件做3次平行,分别测定其GABA含量。
分析图8可得:在接种量0~2%范围内,GABA质量浓度随着接种量增加而增加。GABA质量浓度达到最大值时,对应的接种量为2%,此时的吸光度为0.574,植酸酶酶活力为0.319 mg/mL。随着接种量继续增加,吸光度下降,分析其原因可能是随着接种量增大,酵母菌大量繁殖,随着发酵进行,代谢合成受阻,发酵产物生成量逐渐减少。因此在正交试验中接种量选取1%,2%和3%这三水平。
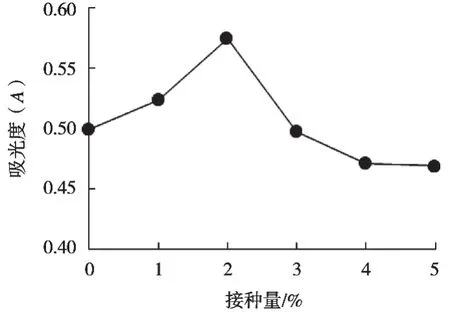
图8 接种量对GABA的影响
2.5 正交试验结果与分析
2.5.1 植酸酶正交试验结果与分析
在单因素试验的基础上,进行L9(33)正交试验,其因素与水平如表3所示。

表3 因素水平表
由正交试验结果分析,RA>RC>RB,由此可得对植酸酶影响大小依次是:培养温度>接种量>培养时间。最优方案为A2B3C1,即在糙米培养基中接种3%酵母菌菌种,在35 ℃下培养10 h,此时植酸酶的吸光度为0.424,酶活力为37.28 U/mL。
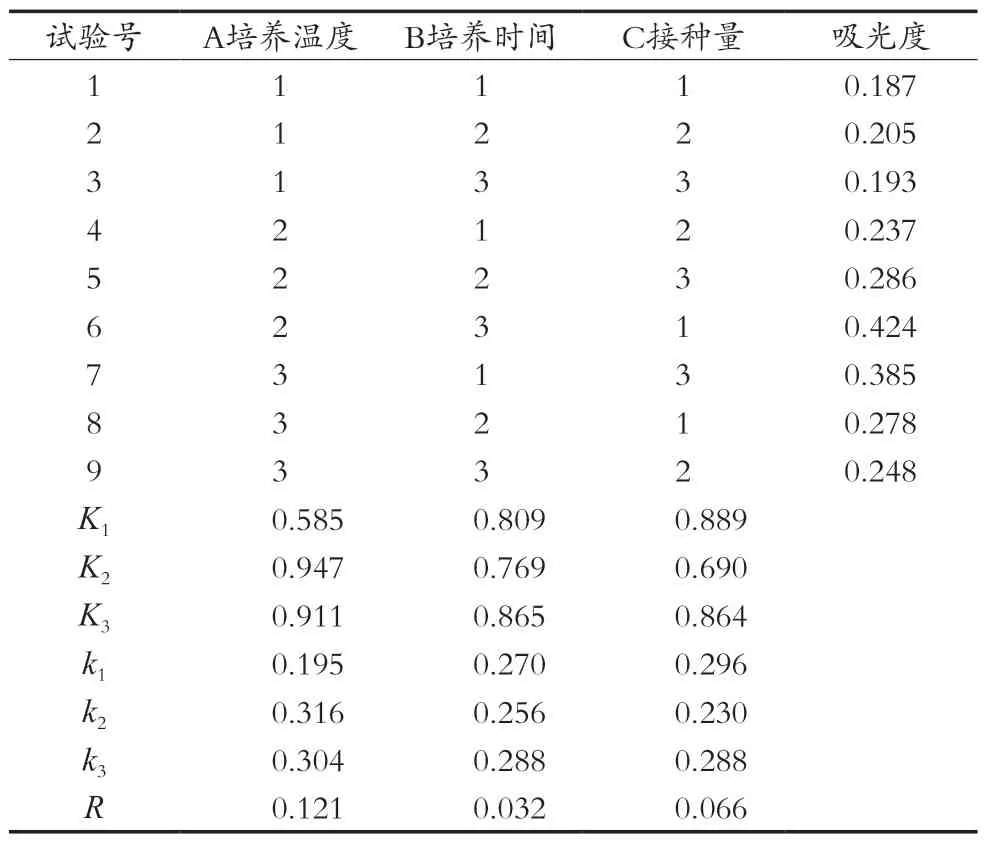
表4 L9(33)正交试验结果
2.5.2 GABA正交试验结果与分析
在单因素试验基础上,进行L9(33)正交试验,其因素水平表如表5所示。

表5 因素水平表
由正交试验结果分析,RC>RA>RB,由此可得对GABA影响大小依次是:接种量>培养温度>培养时间。最优方案为A2B2C2,即在糙米培养基中接种2%酵母菌菌种,在30 ℃下培养8 h,GABA质量浓度最高,为0.315 mg/mL,此时的吸光度为0.567。
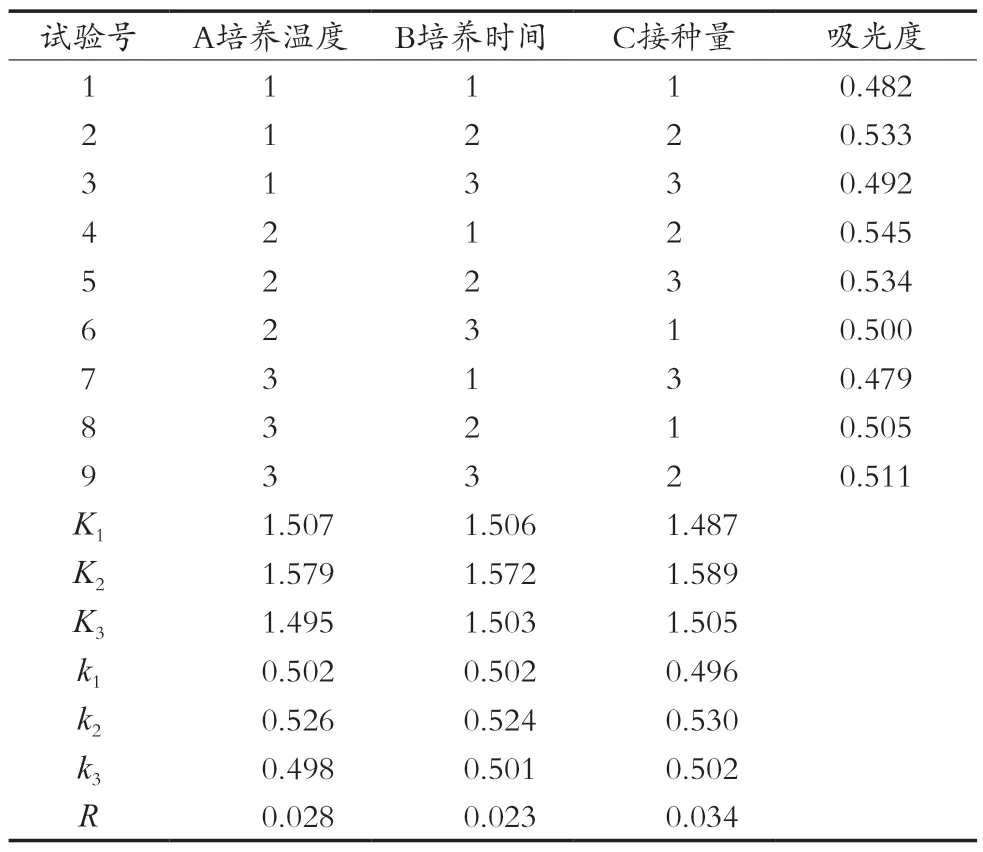
表6 L9(33)正交试验结果
3 结论
通过浸泡和厌氧处理的方法,促使糙米发芽,以提高糙米中植酸酶酶活力和GABA质量浓度,利用酵母菌发酵制备糙米酵素。在试验过程中,重点研究不同培养温度、培养时间和接种量对发酵中植酸酶酶活力和GABA质量浓度的影响。
由正交试验可得:培养温度35 ℃、培养时间10 h、接种量3%时,植酸酶活力最高,可达37.28 U/mL。培养温度30 ℃、培养时间8 h、接种量2%时,GABA质量浓度最高,可达0.315 mg/mL。
