小脑锌指蛋白5与肝细胞癌临床病理特征及预后的关系
2021-11-04杨丽刘永桥刘彬
杨丽,刘永桥,刘彬
(应城市人民医院 1.病理科,2.肝胆外科,湖北 应城 432400)
肝细胞癌(以下简称肝癌)是消化系统最常见的恶性肿瘤之一,是全球第6大最常见的癌症、第4大因癌致死的原因,严重威胁人的生命健康[1]。肝癌的发病机制目前尚未完全明确,阐明其机制并寻找潜在的分子生物学标志物将有助于改善患者的生存预后。小脑锌指蛋白(zinc finger protein of the cerebellum,ZIC)家族包括ZIC1、ZIC2、ZIC3、ZIC4、ZIC5 5个成员,各自编码锌指转录因子,组成5个Cys2His锌指结构域。ZIC家族在神经、骨骼系统的发育中起到重要作用[2]。越来越多研究显示,ZIC在多种疾病包括肿瘤[2- 3]发生中发挥重要作用,其中ZIC5与肿瘤的关系最为密切。有研究显示,ZIC5在前列腺癌、结直肠癌、肺癌和胶质瘤中高表达,并且参与其发生和发展[4- 6]。既往鲜有报道ZIC5在肝癌中的表达及其意义。本研究采用蛋白免疫印迹和免疫组化法检测肝癌组织中ZIC5的表达,分析其与肝癌临床病理特征及预后的关系。
1 材料与方法
1.1 标本
选取我院2010年1月至2013年1月手术切除的94例肝癌组织及其配对的癌旁组织标本。患者纳入标准:(1) 术前未接受过放化疗;(2) 术后组织病理学检查确诊为肝癌;(3) 病历资料完整。患者排除标准:(1) 随访资料不全;(2) 合并其他肿瘤。术后门诊及电话方式对患者进行随访,随访截至2019年1月。手术切除的组织一部分用福尔马林固定并石蜡包埋;另一部分冻存于-70 ℃冰箱。本研究经过我院伦理委员会批准。
1.2 蛋白免疫印迹法检测组织中ZIC5表达
随机选取6例肝癌组织及其配对的癌旁组织进行检测,取组织100 mg,充分研碎后加入组织裂解液(广州捷倍斯生物科技有限公司)裂解20 min,随后离心15 min,收集上清液。用BCA试剂盒(上海碧云天生物技术有限公司)检测蛋白浓度。经10%SDS- PAGE凝胶电泳后将蛋白转移至PVDF膜上,用脱脂奶粉封闭1 h,孵育一抗(ZIC5单克隆抗体,1∶500)(美国Sigma公司),4 ℃过夜后弃去一抗,TBST洗膜3次。随后室温孵育二抗,2 h后弃去二抗(艾美捷科技有限公司),TBST洗膜3次。以GAPDH作为内参,用ECL发光仪对蛋白进行成像,用Image J软件分析灰度值。
1.3 免疫组化染色法检测组织中ZIC5的表达水平
检测所有癌组织和癌旁组织中ZIC5的表达。石蜡切片均由我院病理科制备,厚度为4 μm。检测时常规脱蜡至水。将切片放置于柠檬酸盐缓冲液(上海微蒙生物技术有限公司)中微波煮沸5 min,冷却至室温。滴加3%过氧化氢(上海微蒙生物技术有限公司)除去内源性过氧化物酶,室温孵育10 min。随后用山羊血清封闭10 min,滴加ZIC5单克隆抗体(美国Sigma公司),4 ℃孵育过夜。滴加生物素标记的二抗(美国Sigma公司)。最后用DAB显色、苏木紫复染。经脱水、透明、封片处理后在显微镜下观察。
根据细胞的染色强度及阳性细胞比例判断ZIC5表达情况:(1) 阴性染色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;(2) 阳性细胞数为0~10%计1分,11%~50%计2分,51%~80%计3分,81%~100%计4分。将两者计分相乘:0~3分为蛋白低表达(低表达组);4~12分为蛋白高表达(高表达组)[7]。
1.4 统计学处理
应用SPSS 20.0统计软件进行分析。计量资料以均数±标准差表示,两组间比较用配对t检验;计数资料用率表示,组间比较用卡方检验;生存分析采用Kaplan- Meier法;多因素分析采用COX比例风险回归模型。P<0.05为差异具有统计学意义。
2 结 果
2.1 蛋白免疫印迹法检测组织中ZIC5表达水平
肝癌组织ZIC5相对表达量为0.86±0.13,明显高于癌旁组织的0.25±0.08(t=9.789,P<0.001),见图1。

a 与肝癌组织相比,P<0.05
2.2 免疫组化染色法检测组织中ZIC5的表达水平
ZIC5在癌旁组织中几乎不表达,而在肝癌组织中高表达。ZIC5主要定位于细胞质,在细胞核中也有少量表达(图2)。肝癌组织中ZIC5高表达59例(62.77%),低表达35例(37.23%)。
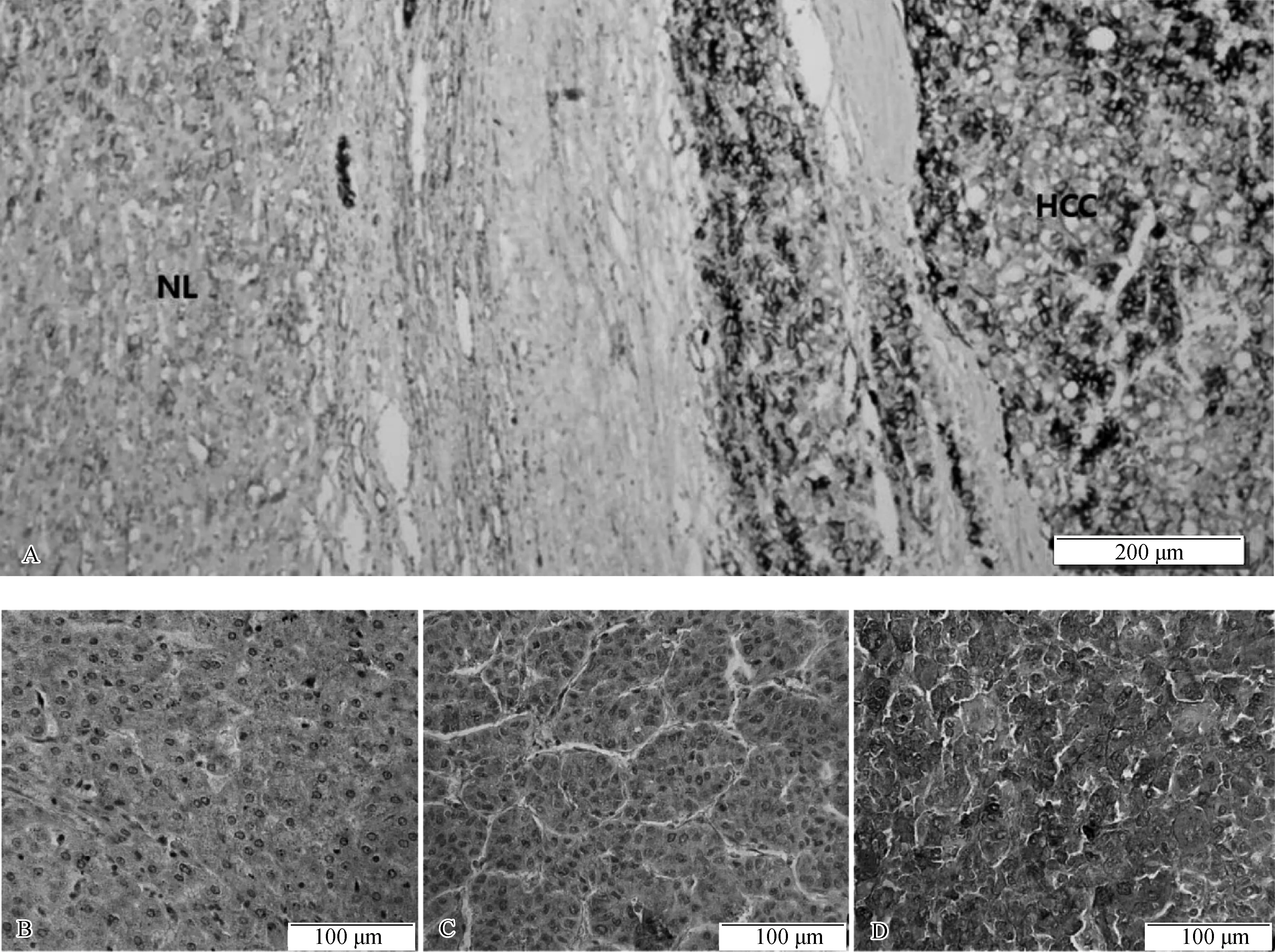
图2 免疫组化染色法检测组织中ZIC5的表达水平 A.ZIC5在肝癌组织和癌旁组织中的表达情况(×100); B.ZIC5在癌旁组织中几乎不表达(×200); C.ZIC5在肝癌组织中低表达(×200); D.ZIC5在肝癌组织中高表达(×200)。NL为癌旁正常组织,HCC为肝癌组织
2.3 ZIC5与临床病理特征的关系
ZIC5表达水平与肝癌分化程度、临床分期、远处转移及肝硬化有关(均P<0.05),与性别、年龄、肿瘤大小、甲胎蛋白水平及HBsAg状态无关(均P>0.05),见表1。

表1 ZIC5表达与临床病理特征的关系 例
2.4 ZIC5表达与肝癌患者生存预后的关系
Log- Rank检验结果显示,高表达组总生存率和无瘤生存率均低于低表达组(均P<0.001),见图3。

图3 ZIC5表达与肝癌患者生存预后的关系
2.5 肝癌患者生存预后的影响因素分析
COX多因素模型分析结果显示,分化程度、临床分期、远处转移和ZIC5高表达是肝癌患者总生存期和无瘤生存期的独立影响因素(均P<0.05),见表2和表3。
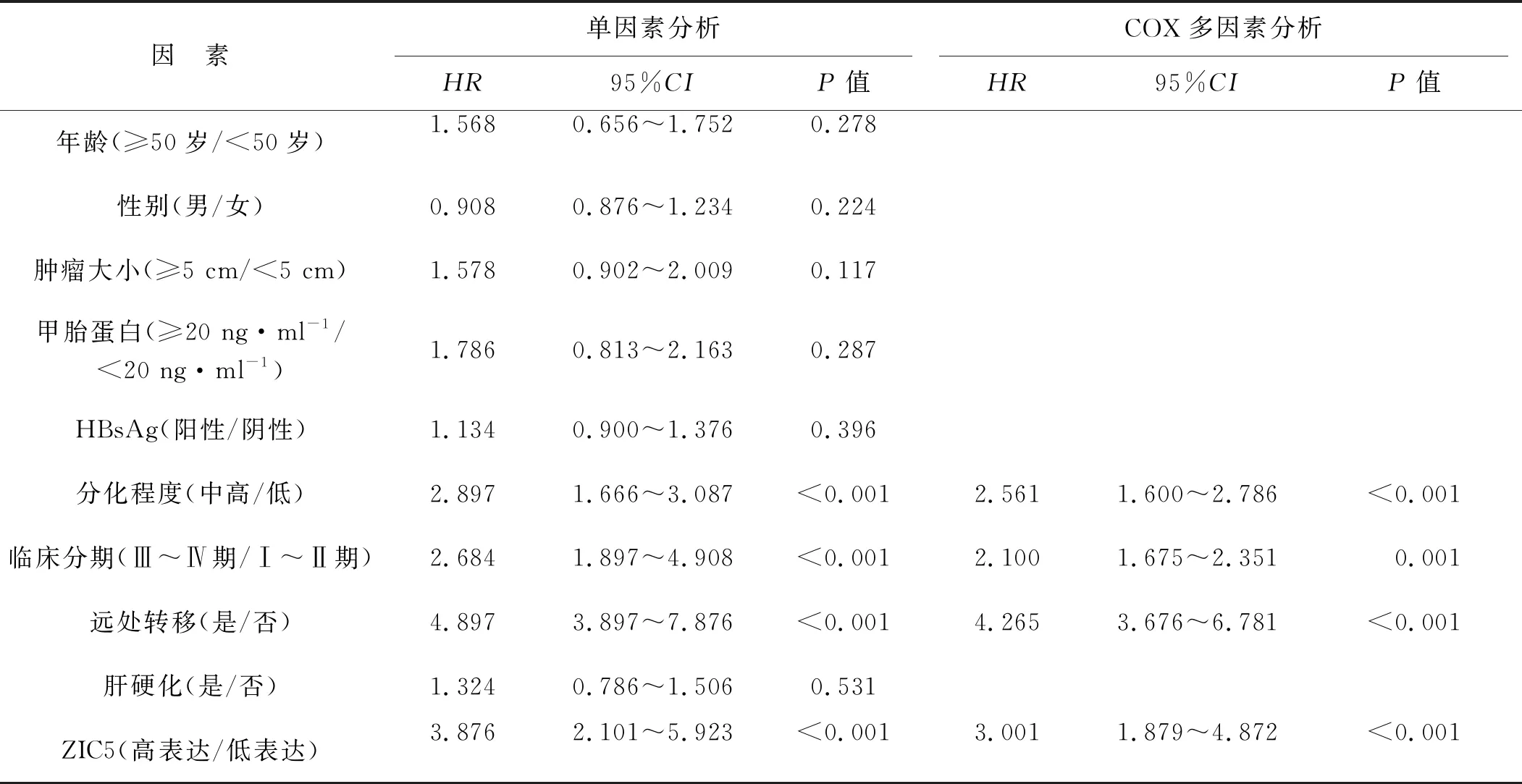
表2 肝癌患者总生存期的单因素和COX多因素分析

表3 肝癌患者无瘤生存期的单因素和COX多因素分析
3 讨 论
肝癌是临床上常见的肿瘤,虽然近年来肝癌的诊治技术有了飞速发展,但是患者的5年生存率仍未见明显提高,尤其是晚期肝癌患者[8]。寻找肝癌新型分子生物学标志并开发潜在的治疗靶点有重要意义。为此,我们检测了ZIC5在肝癌组织中的表达变化,并评估了其在临床病理和预后预测中的作用。
ZIC5的分子质量大约68.4 kD,主要在神经系统和骨骼系统中发挥作用[2]。但是近年来大量研究显示,ZIC5与肿瘤的发生、发展有关[2]。有研究[4- 6]发现,ZIC5在前列腺癌、结直肠癌、肺癌和胶质瘤中高表达。但既往也有相反的研究结果,如Ma等[2]检测了ZIC家族的5个成员,发现胃癌仅与ZIC1相关,而与ZIC5无关。Han等[9]发现,在浸润性乳腺癌组织与正常组织中只有ZIC1表达具有差异,而ZIC5表达却没有差异,说明ZIC5的表达可能与组织特异性有关。本研究蛋白免疫印迹和免疫组化染色结果显示,肝癌组织中ZIC5表达水平明显高于癌旁组织,与Liu等[10]报道一致,提示ZIC5可能与肝癌的发生有关。此外本研究也发现,ZIC5高表达与肿瘤转移、分化程度以及肝硬化有关。从分子机制分析:(1) ZIC5通过PDGFD基因介导FAK和STAT3的激活,进而促进肿瘤细胞增殖和侵袭[11];(2) ZIC5通过Wnt- β- catentin信号通路促进肿瘤细胞的增殖、侵袭和迁徙,进而影响患者的预后[10];(3) ZIC5作为非编码RNA的下游靶基因发挥作用[5,12]。
此外我们的研究结果还显示,组织ZIC5高表达是影响肝癌预后的独立危险因素,高表达组总生存率和无瘤生存率均低于低表达组。ZIC5在既往研究中就被证明与多种类型肿瘤如结肠癌[13]、肺癌[6]等患者的生存预后有关。本研究用COX多因素分析和生存曲线证实了ZIC5与肝癌患者预后的关系,ZIC5表达水平越高,肝癌患者总生存时间和无瘤生存时间越短,表明ZIC5可能具有成为肝癌预后标志物的潜力。
本研究存在一些局限性:(1) 未分析ZIC5与肝癌患者放化疗敏感性的关系;(2) 样本量相对较少;(3) 未检测肝癌患者外周血ZIC5的表达,ZIC5对肝癌早期诊断的价值仍需未来进一步探讨;(4) 未开展细胞或动物学研究探索ZIC5在肝癌中的具体作用机制。
综上所述,肝癌组织中ZIC5表达水平明显高于癌旁组织,ZIC5与肝癌分化程度、临床分期、远处转移和肝硬化有关,ZIC5高表达可能预示患者总生存期和无瘤生存期较短。未来需要进一步探讨ZIC5在肝癌中的作用机制。
