神经损伤诱导蛋白2在胶质瘤中的表达及其意义
2021-11-04姜洪刚薄金红岑立勉
姜洪刚,薄金红,岑立勉
(广西壮族自治区桂东人民医院 神经外科,广西 梧州 543001)
胶质瘤是常见的颅内肿瘤,复发率和死亡率较高[1]。虽然近年来外科技术和放化疗技术取得了长足进步,但是患者生存预后仍未见明显改善[1- 2]。深入分析胶质瘤的发病机制并寻找潜在的分子生物学指标具有重要意义。神经损伤诱导蛋白2 (Ninjurin2) 是一种细胞黏附分子,可表达于神经元和神经胶质细胞[3]。有研究发现Ninjurin2可介导氧化应激诱导的神经元损伤[4];Ninjurin2过表达促进结直肠癌细胞的增殖[5]。Ninjurin2在胶质瘤中的表达及其意义既往少有报道。本研究旨在探讨Ninjurin2对胶质瘤细胞增殖及侵袭的影响,及其与患者生存预后的关系。
1 材料与方法
1.1 组织样本
选取我院2011年7月至2015年7月手术切除的88例胶质瘤组织。患者术前均未接受过放疗、化疗或免疫治疗,其中男52例,女36例,年龄21~70岁,平均(47.56±10.02)岁;WHO分级Ⅰ级12例,Ⅱ级24例,Ⅲ级24例,Ⅳ级28例。术中留取瘤组织,由我院病理科制备石蜡切片(厚度为4 μm)后储存。另选取2017年6月至2018年12月我院因颅脑损伤而行颅内减压术切取的正常脑组织30例为对照,其中男15例,女15例,年龄20~59岁,平均(47.01±10.12)岁。本研究经我院伦理委员会批准。
1.2 免疫组化染色法检测组织中Ninjurin2的表达水平
70 ℃下烤片30 min,然后进行常规脱蜡处理;抗原修复后用羊血清(上海恒远生物科技有限公司)封闭30 min,加入抗Ninjurin2抗体(1∶500,英国Abcam 公司),4 ℃孵育过夜;加入山羊抗小鼠IgG,37 ℃孵育30 min;随后进行DAB显色处理,苏木紫复染。经脱水、透明、封片处理后在显微镜下观察。根据细胞的染色强度及阳性细胞比例判断Ninjurin2表达情况。染色强度评分:阴性、染色为浅黄色、棕黄色、棕褐色分别记0、1、2、3分;阳性细胞比例评分:0~10%、11%~50%、51%~80%、81%~100%分别记1、2、3和4分。将两种评分相乘,0~3分为低表达,4~12分为高表达[6]。
1.3 细胞培养及转染
人胶质瘤细胞系U251、U87和U373和正常胶质细胞系SVG均购自上海慧颖生物科技有限公司。将细胞接种于含10%胎牛血清的DMEM培养基(海晶抗生物工程有限公司)中,培养条件为37 ℃、5%CO2。取对数期生长细胞进行后续实验。取U251细胞,用Lipofectamine®2000试剂(美国Sigma公司)分别转染Ninjurin2 siRNA序列(Ninjurin2- siRNA组)、阴性对照序列(NC- siRNA组)。质粒由上海吉凯基因科技有限公司提供。NC- siRNA序列:5′- GGAGACTACCAGAAGGCTTAT- 3′;Ninjurin2- siRNA序列:5′- GGAGCCTGGAGGAGCC CACGCAG- 3′。转染严格按照试剂说明书操作。
1.4 蛋白免疫印迹法检测细胞中Ninjurin2蛋白表达水平
用RAPI裂解液提取细胞中的总蛋白,10%SDS- PAGE(上海信裕生物技术有限公司)分离蛋白,用半干转移法将蛋白转至PVDF膜上。随后用5%脱脂奶粉封闭2 h,加入Ninjurin2(1∶500)一抗(英国Abcam 公司),4 ℃过夜孵育,第2天除去一抗,用TBST缓冲液洗涤3次后加入二抗(羊抗兔,1∶500),封闭1 h。ECL法显色,用FP- UVCI- 2100型凝胶成像仪(美国Major Science公司)拍照,用Image J软件分析灰度值。
1.5 细胞计数试剂盒- 8(CCK- 8)法检测U251细胞的增殖能力
用CCK- 8(上海李记生物科技有限公司)法检测细U251胞增殖能力。取质粒转染48 h后处于对数生长期的细胞,接种于96孔板中,密度为1×104个·孔-1。培养细胞至贴壁后,于24、48、72和96 h时加入CCK- 8溶液(10 μl·孔-1)。用MR- 96A迈瑞酶标仪检测光密度(OD)值。实验重复4次。
1.6 肿瘤小室实验检测U251细胞的侵袭能力
在小室迁移板(上海李记生物科技有限公司)上室铺基质胶,将处于对数生长期的U251细胞接种于小室24孔板,以2×105个·ml-1密度将U251细胞加入上室,下室中加入细胞培养基。培养至细胞贴壁后更换上室培养液,继续培养24 h。用棉签小心擦拭去小室滤膜上的瘤细胞,接着用甲醛固定15 min,行HE染色后光镜下统计侵袭细胞数。实验重复4次。
1.7 统计学处理
2 结 果
2.1 Ninjurin2在胶质瘤组织和细胞中的表达
Ninjurin2蛋白主要表达于细胞质和细胞膜,细胞核中也有少量表达。在胶质瘤组织中,Ninjurin2主要染色为浅黄色、棕黄色或棕褐色,而正常脑组织中主要为未着色或者浅黄色(图1)。胶质瘤组织中Ninjurin2蛋白高表达率为65.91%(58/88),高于正常脑组织的20.00%(6/30)(χ2=18.998,P<0.001)。U251、U87和U373细胞中Ninjurin2蛋白相对表达量分别为(2.11±0.34)、(1.53±0.25)和(1.09±0.27),均高于SVG细胞的(0.34±0.08)(均P<0.05),见图2。

图1 Ninjurin2在胶质瘤和正常脑组织中的表达(SP×200) A. 胶质瘤组织; B. 正常脑组织

a 与SVG细胞相比,P<0.05
2.2 胶质瘤患者预后分析
单因素分析结果显示,术前卡氏评分、WHO分级、化疗和Ninjurin2是胶质瘤患者总生存期的影响因素(均P<0.05)。以是否生存为因变量、上述因素为自变量进行COX多因素分析,结果显示,术前卡氏评分(OR=2.312)、WHO分级(OR=2.008)、化疗(OR=1.600)和Ninjurin2(OR=2.816)是胶质瘤患者总生存期的独立影响因素(均P<0.05),见表1。Kaplan- Meier曲线生存分析结果显示,Ninjurin2高表达组中位生存时间为11个月,明显低于低表达组的19个月(P=0.004),见图3。

图3 88例胶质瘤患者的生存曲线
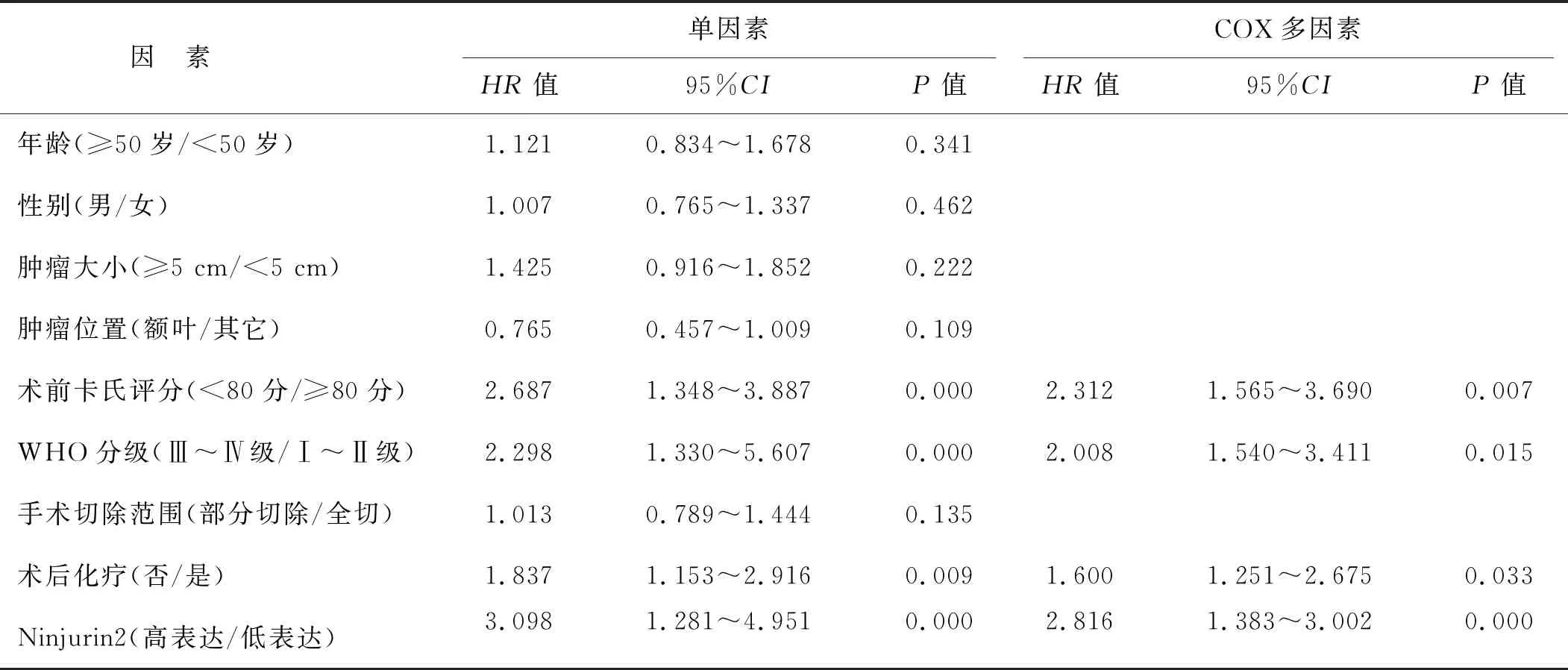
表1 影响胶质瘤患者生存预后的单因素和多因素分析
2.3 沉默Ninjurin2对U251细胞增殖和侵袭的影响
与NC- siRNA组比较,Ninjurin2- siRNA组细胞增殖和侵袭能力明显下降(均P<0.05),见图4、5。

a 与NC- siRNA组比较,P<0.05
3 讨 论
胶质瘤是最常见的原发性颅内肿瘤,发病可能涉及遗传、环境和感染等,患者预后较差,术后极易复发[7],因此有必要深入探讨胶质瘤的发病机制。细胞之间、细胞与细胞外基质之间的黏附机制近年来受到广泛关注,黏附分子可参与生长发育、免疫炎症损伤和血液凝固等病理生理过程,它是肿瘤浸润和转移的分子生物学基础[8]。Ninjurin2是一种在神经元和神经胶质细胞中表达的黏附蛋白[3]。有研究显示,神经受损后Ninjurin2表达水平明显升高,能够促进神经突起生长[3],但是其具体的生物学功能目前尚未明确。Ninjurin2与神经炎症损伤有关,它可以与Toll样受体4相互作用,介导下游转录因子κB和c- Jun通路的激活[9]。激活的受体酪氨酸激酶家族EGFR、VEGFR、FGFR和PDGFR可以激活下游PI3K- Akt- mTOR和 Erk- MAPK通路,参与肿瘤的进展,而Ninjurin2可以与多种受体酪氨酸激酶相互作用[9],推测Ninjurin2可能参与了肿瘤进展。
Ninjurin2在胶质瘤中扮演何种角色,既往未见报道。本研究采用免疫组化染色法检测了88例胶质瘤组织和30例正常脑组织中Ninjurin2的表达,并采用蛋白免疫印迹法检测了胶质瘤细胞系和正常胶质细胞系中Ninjurin2的表达,结果显示,与对照组相比,胶质瘤组织和细胞中Ninjurin2表达水平较高。既往研究证实,Ninjurin2通过调节钙离子通道活性影响胶质瘤组织的增殖[10],对比本研究结果提示其可能参与疾病的发生。为了明确Ninjurin2在胶质瘤中的作用,本研究建立了Ninjurin2基因沉默的U251细胞株,细胞增殖实验及肿瘤小室结果显示,与NC组(阴性对照组)相比, Ninjurin2沉默的U251细胞不同时间段的增殖和侵袭能力明显下降。肿瘤的增殖及转移是肿瘤疾病侵袭性增强的主要特点,上述研究证实,Ninjurin2可能参与了胶质瘤的恶化。Li等[5]发现,Ninjurin2在结直肠癌细胞中高表达,CRSIPR/Cas9敲除Ninjurin2后,细胞的增殖能力和Akt/Erk通路明显受到抑制。本研究结果与之类似。上述结果提示Ninjurin2高表达可能影响胶质瘤患者的预后。本研究通过临床数据研究发现术前卡氏评分(OR=2.312)、WHO分级(OR=2.008)和化疗(OR=1.600)是胶质瘤患者总生存期的独立影响因素,与既往报道[11- 13]一致。但Ninjurin2与肿瘤预后的关系既往还未见报道。本研究通过 COX多因素和Kaplan- Meier曲线生存分析结果证实Ninjurin2是胶质瘤患者不良生存预后的因素,与Ninjurin2低表达的胶质瘤患者相比,Ninjurin2高表达组的胶质瘤患者生存周期明显缩短,进一步证实Ninjurin2可参与胶质瘤进展。

a 与NC- siRNA组比较,P<0.05
综上,Ninjurin2在胶质瘤组织和细胞中高表达,沉默Ninjurin2可以抑制胶质瘤细胞的增殖和侵袭,Ninjurin2高表达与胶质瘤患者的不良生存预后有关。
