阿维A联合阿达木单抗调控MAPK/NF-κB通路对银屑病小鼠模型的疗效及Th17/Th22、DC水平的影响研究
2021-11-03杨洪李慧马红艳
杨洪 李慧 马红艳

[摘要]目的:探討阿维A联合阿达木单抗调控丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)/核转录因子κB(NF-κB)通路对银屑病小鼠模型的疗效及辅助性T细胞17(T helper cell 17,Th17)/Th22、树突状细胞(Dendriticcells,DC)水平的影响研究。方法:将BALB/c雌性小鼠作为研究对象,背部涂抹咪喹莫特乳膏构建银屑病小鼠模型,并随机分为模型组、干预组即阿维A组、阿达木单抗组以及阿维A联合阿达木单抗组,模型组注射生理盐水,干预三组分别给予阿维A灌胃、阿达木单抗静脉注射以及阿维A灌胃联合阿达木单抗静脉注射,干预治疗7d后动态观察各组小鼠皮损变化情况并进行皮损面积和严重程度指数(Psoriasis area and severity index,PASI)评分,比较各组小鼠外周血炎症因子表达水平以及Th17/Th22细胞以及DC水平,采用Western-blot法测定各组小鼠皮损组织中NF-κB蛋白水平。结果:与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠鳞屑程度和鳞屑厚度明显减轻,红斑面积缩小,皮损症状明显缓解,其中阿达木单抗联合阿维A组皮损改善程度最显著,PASI评分上升趋势最缓慢。干预后7d,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠血清IL-17、IL-21、IL-23、IFN-γ、TNF-α等炎症因子水平、外周血Th17/Th22细胞及DC水平相比模型组明显下降,差异有统计学意义(P<0.05);且联合用药组各炎症因子表达水平明显低于阿达木单抗组和阿维A组,差异有统计学意义(P<0.05)。阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组皮损组织NF-κB蛋白相对表达水平明显下降,差异有统计学意义(P<0.05);且联合用药组NF-κB蛋白水平相对表达水平明显低于阿达木单抗组、阿维A组,差异有统计学意义(P<0.05)。结论:阿维A联合阿达木单抗可能通过调控MAPK/NF-κB通路影响银屑病小鼠Th17/Th22、DC水平,从而抑制炎症反应和改善银屑病症状。
[关键词]银屑病;阿维A;阿达木单抗;MAPK/NF-κB通路;Th17/Th22;树突状细胞
[中图分类号]R758.63 [文献标志码]A [文章编号]1008-6455(2021)09-0007-05
Effect of Acitretin Combined with Adalimumab on the Efficacy of MAPK/NF-κB Pathway in Psoriasis Mouse Model and the Effect of Th17/Th22 and DC Levels
YANG Hong,LI Hui,MA Hong-yan
(Department of Dermatology,Children's Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830000,Xinjiang,China)
Abstract: Objective To investigate the effect of acitretin combined with adalimumab on the regulation of MAPK/NF-κB pathway in psoriasis mouse model and the effects of Th17/Th22 and dendritic cells (DC). Methods BALB/c female mice were used as subjects, and a psoriasis mouse model was constructed by applying imiquimod cream on the back and randomly divided into the model group, the acitretin group, the adalimumab group and the adalimumab combined with acitretin group. The model group was injected with normal saline, and the three groups were given intravenous administration of acitretin, intravenous adalimumab, and intravenous injection of acitretin combined with adalimumab. After 7 days of intervention treatment, the changes of skin lesions in each group were observed dynamically and the Psoriasis area and severity index (PASI) score was obtained. The expression levels of peripheral blood inflammatory factors and Th17/ Th22 cells and DC levels in each group were compared, and the NF-κB protein levels in the skin lesions of each group were determined by Western-blot method. Results Compared with the model group, the degree of scaly and scaly thickness of the adalimumab group, the acitretin group and the adalimumab combined with acitretin group were significantly reduced, the area of erythema was reduced, and the symptoms of skin lesions were significantly relieved. Among them, the adalimumab combined with acitretin group had the most significant improvement in skin lesions, and the PASI score increased the slowest. On the 7th day after the intervention, the serum levels ofvIL-17, IL-21, IL-23, TNF-α and IFN-γ were significantly decreased in the adalimumab group, the acitretin group, and the adalimumab combined with acitretin group compared with the model group, the differences were statistically significant (P<0.05). And the expression levels of inflammatory factors in the combination group were significantly lower than those in the adalimumab group and the acitretin group (P<0.05). In addition, the relative expression levels of NF-κB protein in the adalimumab group, the acitretin group and the adalimumab combined with acitretin group were significantly decreased (P<0.05). And the level of NF-κB protein in the combination group was significantly lower (P<0.05). And the combination group was significantly lower than the adalimumab group and the acitretin group (P<0.05). Conclusion Acitretin combined with adalimumab may inhibit the levels of Th17/Th22 and DC in psoriasis mice by regulating MAPK/NF-κB pathway, thereby inhibiting inflammatory response and improving symptoms of psoriasis.
Key words: psoriasis; acitretin; adalimumab; MAPK/NF-κB pathway; Th17/Th22; dendritic cells
银屑病(Psoriasis)是一种由多重因素诱导的免疫异常性和慢性炎症皮肤病,患处皮肤常呈现为红色丘疹且表面覆盖有数层银白色的鳞屑[1]。银屑病发病累及范围大且病情反复迁延不愈,目前临床上尚无良好的根治方案,只能通过药物对疾病进程进行控制和减轻患者痛苦[2]。因此进一步深入研究银屑病发病机制对于银屑病治疗具有重要价值。银屑病发病机制比较复杂,以往临床上常认为银屑病发生机制与辅助性T细胞17(T helper cell17,Th17)/Th22细胞免疫失衡存在紧密联系,现有研究发现Th17细胞也是参与银屑病发生发展的重要T细胞之一,白细胞介素17(Interleukin-17,IL-17)作为Th17细胞的重要分泌因子,可以通过刺激促炎性细胞因子和趋化因子表达导致机体发生炎症和组织损伤[3]。树突状细胞(Dendritic cells,DCs)属于抗原呈递细胞,具有激活免疫反应细胞和活化初始T细胞作用,可以启动免疫应答和诱导免疫耐受,与银屑病等慢性皮肤炎症发生发展存在密切联系[4]。核转录因子κB(NF-κB)MAPK/NF-κB信号通路是参与细胞增殖、分化、黏附和凋亡等过程的一条重要信号通路,还可通过调节DC成熟和活化过程影响银屑病发生发展[5]。MAPK/NF-κB信号通路同时可以诱导细胞促炎因子表达、聚集、激活过程,是一种典型炎症反应调节细胞信号转导通路,该信号通路可以通过影响炎症因子表达参与银屑病发生机制。阿维A是目前临床上常用于治疗银屑病的一种有效药物,但阿维A对人体的免疫系统作用机制仍需要进一步研究[6]。阿达木单抗属于全人源抗TNF-α单克隆抗体,很多国家已批准用于中重度银屑病的治疗[7]。本文通过观察阿维A联合阿达木單抗对银屑病小鼠模型的疗效并研究其作用机制及对Th17/Th22、DC水平的影响,同时检测MAPK/NF-κB信号通路相关蛋白表达水平,旨在为银屑病发病机制和临床用药治疗提供参考。
1 材料和方法
1.1 实验动物及试剂:选择72只体重18~20g的成年BALB/c雌性小鼠(动物来源:广东省医学实验动物中心);其中阿维A购自重庆华邦制药有限公司,阿达木单抗注射液为Vetter Pharma-Fertigung GmbH & Co. KG生产,购自健生贸易有限公司,批准文号JXSS0900001。
1.2 模型建立与药物干预方法:以80mg/kg剂量在所有小鼠腹腔注射戊巴比妥钠,麻醉完全后将小鼠背部毛刮除干净,暴露出2cm×3cm左右皮肤面积后,每天在小鼠背部皮肤上涂抹浓度为5%咪喹莫特乳膏40mg,连续涂抹两周。造模期间每天对小鼠背部皮肤拍照并进行皮损评分,造模后1周对背部患处皮肤进行病理学检测,并使用显微镜观察表皮厚度以及炎症浸润程度。确定小鼠银屑病模型建立成功后,将小鼠随机分为模型组、对照组(阿维A组和阿达木单抗组)和研究组,每组各18只,单笼进行饲养。其中对照组分别给予阿维A和阿达木单抗治疗,研究组给予阿维A联合阿达木单抗治疗,其中阿维A为灌胃给药,5mg/(kg·d),0.4毫升/(次·天) ;阿达木单抗为静脉注射给药,将1mg溶于0.5ml葡萄糖溶液中注射给药,模型组静脉注射等量生理盐水,治疗周期为两周。
1.3 各组小鼠疗效评估:根据小鼠银屑病皮损面积和疾病严重程度(Psoriasis area and severity index,PASI)评分对各组小鼠药物干预疗效进行评估,采用肉眼观察并采用相机记录方式,计算银屑病小鼠鳞屑、皮损红斑及浸润增厚积分。PASI评分标准:无为0分(创面皮肤未见红斑和鳞屑,且皮损与正常皮肤水平面齐平);轻度为1分(创面皮肤表面覆有细碎鳞屑,皮肤颜色呈淡红色且皮损平面稍高于正常皮肤水平面);中度为2分(皮肤大部分面积存在皮损,表面覆有片状鳞屑且呈中度隆起且斑块边缘呈圆状或者斜坡状);重度为3分(皮肤几乎全部面积存在皮损,表面覆有厚层鳞屑且重度隆起,皮损颜色呈深红色);极重度为4分(皮肤全部皮损)[8]。对四组小鼠皮损鳞屑、浸润和红斑严重程度进行评分,并将三个维度评分相加得总评分,取各组小鼠各评分均值绘制评分随时间的变化趋势图。
1.4 各组小鼠Th17/Th22细胞及DC水平测定:干预两周后从各组小鼠眼球取血,采用流式细胞仪(厂家:赛默飞世尔,型号:Attune NxT)检测Th17、Th22等辅助性T细胞以及DC数量比例。
1.5 各组小鼠血清炎症因子水平测定:干预7d后从各组小鼠眼球取血,2 500r/min离心15min得到分离后血清,采用酶联免疫吸附测定(ELISA)试剂盒(北京索莱宝科技有限公司)测定各组小鼠样品中IL-17、IL-21、IL-23、IFN-γ、TNF-α水平含量。
1.6 Western-blot法测定皮损组织NF-κB蛋白水平测定:对小鼠进行脱颈处死,按照九格法剪取各组小鼠皮损处组织并经超声裂解,采用BCA法对蛋白进行定量,使用10% SDS聚丙烯酰胺凝胶电泳对蛋白样品进行分离后,将蛋白转移到PVDF膜上,使用封闭液将样品于室温下封闭1h,将膜转入封闭液稀释的一抗(pNF-κB以及NF-κB稀释1 000倍),以β-actin为内标。然后于4℃条件下孵育过夜后使用洗液进行洗涤,化学发光法显色,X射线底片曝光。
1.7 统计学分析:采用SPSS 19.0统计分析软件对本研究不同组别以及处理前后的各项指标间差异进行评价。多组间采用方差分析,组间两两比较采用SNK-q检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组小鼠疗效比较:与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠用药干预后鳞屑程度和鳞屑厚度明显减轻,红斑面积缩小,皮损症状明显缓解;与阿达木单抗组和阿维A组相比,阿达木单抗联合阿维A组皮损改善程度更显著,皮肤更加光滑,浸润程度更轻,见图1。四组小鼠的鳞屑、浸润及红斑严重程度评分以及三者总积分见图2。与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三个维度评分及总分上升趋势更加缓慢,其中阿达木单抗联合阿维A组评分上升趋势最慢。
2.2 各组血清炎症因子表达水平比较:干预后7d,与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠血清IL-17、IL-21、IL-23、IFN-γ、TNF-α等炎症因子水平明显下降,差异有统计学意义(P<0.05);且联合用藥组各炎症因子表达水平明显低于阿达木单抗组、阿维A组,差异有统计学意义(P<0.05)。见表1。
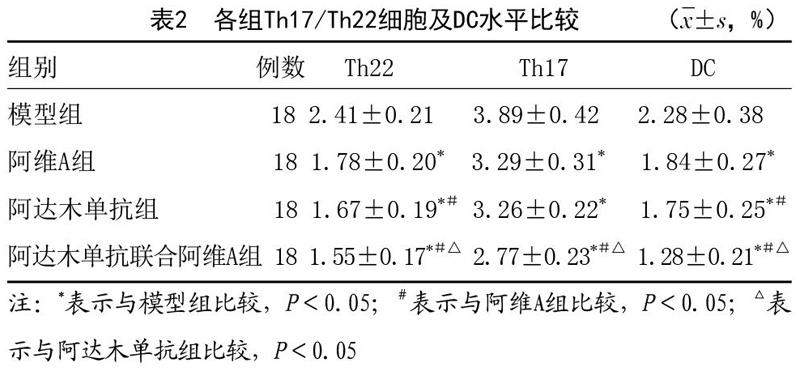
2.3 各组Th17/Th22细胞及DC水平比较:干预后7d,与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠Th17/Th22细胞及DC水平明显下降,差异有统计学意义(P<0.05);且联合用药组表达水平明显低于阿达木单抗组、阿维A组,差异有统计学意义(P<0.05)。见表2。
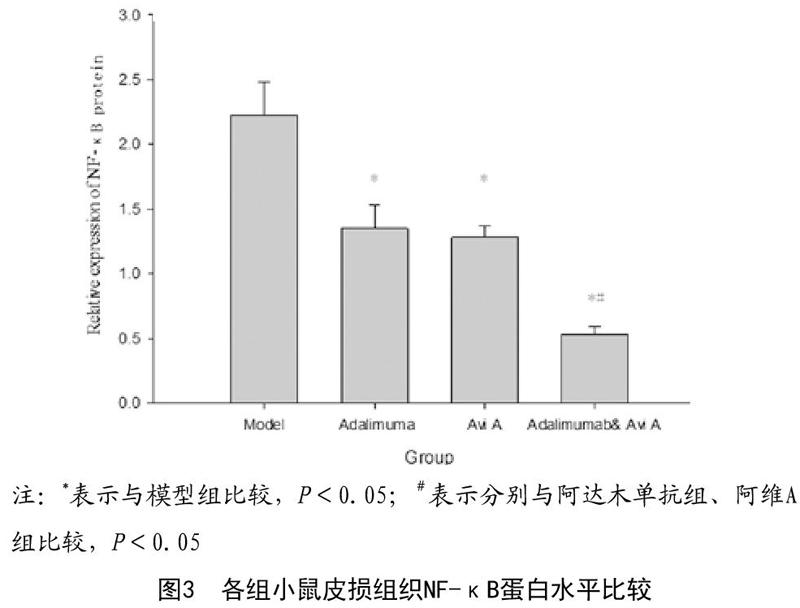
2.4 各组皮损组织NF-κB蛋白水平比较:干预后7d,与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组皮损组织NF-κB蛋白相对表达水平明显下降,差异有统计学意义(P<0.05);且联合用药组NF-κB蛋白水平相对表达水平明显低于阿达木单抗组、阿维A组,差异有统计学意义(P<0.05)。见图3~4。
3 讨论
近来有研究显示树突状细胞(DCs)的异常活化与银屑病发生发展存在紧密关系,DCs可以通过分泌多种免疫因子启动和调节固有免疫和获得性免疫,与银屑病的炎性浸润存在重要相关性。抗原成分会促进DC活化并产生IL-23、IL-1β和TNF-α、IL-6等前炎症因子,这些细胞因子会进一步诱导分泌IL-17和IL-22等炎性因子,从而促进CD4+ T细胞(Th17、Th22以及Th1)介导产生的获得性免疫反应[9]。核转录因子Kappa B(Nuclear transcription factor Kappa B,NF-κB)是与多种自身免疫病发病机制关系紧密的信号通路之一。机体内IL-17、IL-12以及TNF-α炎症因子水平升高以及其他相关刺激可以激活NF-κB信号通路,被活化后的NF-κB通路可使靶基因发生转录以及促使T细胞分化,对炎性因子产生正反馈调节,从而放大炎性信号并介导免疫应答发生[10]。激活的MAPK/NF-κB信号通路密切参与基因转录、细胞凋亡过程,可引起DNA链断裂和细胞解体。同时MAPK/NF-κB信号通路能够促进TNF-α、IL-6等免疫细胞表达水平,可通过调节炎症反应过程和皮肤免疫系统干预银屑病炎症反应,故该信号通路对于银屑病发生机制和发生发展至关重要[5]。阿达木单抗是以TNF-α为作用靶点一种全人源化单克隆抗体,通过与TNF-α发生特异性结合来阻断TNF-α与相关受体TNF受体之间的相互作用来发挥抗炎功效,对于类风湿关节炎、银屑病以及炎症性肠病等免疫介导的炎性反应过程具有显著干预作用[7]。维甲酸是一种维生素A衍生物,具有调控细胞形态、细胞增殖、凋亡等广泛生物活性,近来研究证实其具有显著的免疫调节功能,临床广泛用于治疗痤疮、银屑病以及皮肤角化[6],但目前两种药物联合用于银屑病治疗临床效果尚需进一步研究。
本文研究结果发现与模型组相比,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠用药干预后鳞屑程度和鳞屑厚度明显减轻,红斑面积缩小,皮损症状明显缓解;与阿达木单抗组和阿维A组相比,阿达木单抗联合阿维A组皮损改善程度更显著,皮肤更加光滑,浸润程度更轻。三个干预组小鼠PASI三个维度评分及总分上升趋势相比模型组更加缓慢,其中阿达木单抗联合阿维A组评分上升趋势最慢。说明阿达木单抗和阿维A可以显著降低银屑病小鼠皮损程度,而阿达木单抗联合阿维A治疗效果更佳。另外本研究结果显示干预后7d,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组小鼠血清炎症因子水平相比模型组明显下降,且联合用药组炎症因子及Th17/Th22细胞及DC水平改善更显著。说明阿达木单抗联合阿维A可以显著调节小鼠体内免疫细胞和炎症因子水平,发挥明显抗炎作用,且两者之间存在协同作用。Yamaoka T等[11]研究发现银屑病小鼠体内存在免疫失衡,经阿达木单抗处理后小鼠皮损组织和血清中Th17类细胞因子(IL-17)、Th1类细胞因子(IFN-γ)和Treg类细胞因子(IL-10)表达水平均发生明显下降,与本文研究结果相一致,说明阿达木单抗可能是通过影响Th1、Th17、Th22以及Treg等免疫细胞水平,从而干预炎症细胞因子分泌量影响免疫反应,进一步改善银屑病小鼠发生皮损严重程度。Eriksson E[12]研究证实DCs异常活化是银屑病发病的重要因素,DCs活化后分泌的炎性因子如IL-12和IL-23会进一步激活T淋巴细胞,最终引发银屑病。已有研究表明阿维A可以通过抑制MAPK/NF-κB通路阻断DC成熟过程,从而可以阻断DC对抗原的递呈作用,发挥抑制T细胞依赖性免疫应答的功能[13]。故推测NF-κB通路在银屑病炎症反应过程和免疫调节过程中发挥重要作用。张彩晴等[14]研究结果表明P物质可以激活人角质形成细胞(HaCaT)MAPK/NF-κB信号通路,导致细胞呈多角形形态变化,而阿维A可以降低阳性细胞表达率以及MAPK/NF-κB表达水平,说明阿维A可以通过抑制MAPK/NF-κB信号通路并下调NF-κB表达。另外Fuentes-Duculan J等[15]研究发现TNF-α可以显著促进外周血DC分化和成熟过程,从而引发炎症反应。本文研究结果显示干预后7d,阿达木单抗组、阿维A组和阿达木单抗联合阿维A组三组皮损组织NF-κB蛋白相对表达水平相比模型组明显下降,且联合用药组NF-κB蛋白水平相对表达水平明显低于阿达木单抗组、阿维A组。主要是由于阿达木单抗作为TNF-α抑制剂,可以降低体内TNF-α等炎症因子表达,抑制DC分化成熟,从而抑制炎症反应,减轻小鼠银屑病症状[16]。而阿维A通过抑制MAPK/NF-κB通路阻断DC成熟过程,降低机体免疫应答。故阿达木单抗和阿维A联合应用可以发挥协同作用,通过抑制MAPK/NF-κB信号途径降低IL-12、IL-18等炎症因子的表达,共同减轻炎性反应对银屑病皮损的刺激[17]。
综上所述,阿维A联合阿达木单抗可能通过调控MAPK/NF-κB通路影响银屑病小鼠Th17/Th22、DC水平,从而抑制炎症反应和改善银屑病症状。
[参考文献]
[1]Takeshita J,Grewal S,Langan SM,et al.Psoriasis and comorbid diseases: Epidemiology[J].J Am Acad Dermatol,2017,76(3):377-390.
[2]Blair HA.Brodalumab: a review in moderate to severe plaque psoriasis[J].Drugs,2018,78(4):495-504.
[3]Yousefzadeh H,Azad FJ,Rastin M,et al.Expression of Th1 and Th2 cytokine and associated transcription factors in peripheral blood mononuclear cells and correlation with disease severity[J].Rep Biochem Mol Biol,2017,6(1):102-111.
[4]Kim TG,Kim SH,Lee MG.The origin of skin dendritic cell network and its role in psoriasis[J].Int J Mol Sci,2017,19(1):42-49.
[5]王静,江从军,陈秋.银屑病患者血清IL-17、IL-22、IL-36与IL-36Ra水平的变化及其临床意义[J].中国美容医学,2019,28(8):77-79.
[6]中华医学会皮肤性病学分会.阿维A治疗银屑病专家共识(2017版)[J].中华皮肤科杂志,2017,50(6):397-399.
[7]张瑞丽,朱小红,华海康,等.阿达木单抗治疗重度银屑病14例临床疗效及安全性观察[J].中华皮肤科杂志,2018,51(8):604-606.
[8]贾玲芝,贾娇.甲砜霉素联合阿维A胶囊对寻常性银屑病患者外周血VEGF,OPN,IL-17, IL-18表达的影响研究[J].中国美容医学,2019,28(5):69-71.
[9]Martini E,Wiken M,Cheuk S,et al.Dynamic changes in resident and infiltrating epidermal dendritic cells in active and resolved psoriasis[J].J Invest Dermatol,2017,137(4):865-873.
[10]Vara D,Watt JM,Fortunato TM,et al.Direct activation of NADPH oxidase 2 by 2-deoxyribose-1-phosphate triggers nuclear factor Kappa B-dependent angiogenesis[J].Antioxid Redox Signal,2018,28(2):110-130.
[11]Yamaoka T,Hayashi M,Tani M,et al.Value of ultrasonography findings for nail psoriasis before and after adalimumab administration[J].Clin Exp Dermatol,2017,42(2):201-209.
[12]Eriksson E,Milenova I,Wenthe J,et al.Abstract 3662: Activation of CD40 while inhibiting IL6/STAT3 using oncolytic viruses induces mature DCs with high cytokine production but blocks PDL1 expression[J].Cancer Res,2017,77(13 Supplement):3662.
[13]Dufrasne FE,Lucchetti M,Martin A,et al.Modulation of the NF-κB signaling pathway by the HIV-2 envelope glycoprotein and its incomplete BST-2 antagonism[J].Virology,2018,513(25):11-16.
[14]张彩晴,王倩云,郑龙,等.阿维A对P物质诱导的HaCaT细胞NF-κB表达的影响[J].中国麻风皮肤病杂志,2014,30(11):643-646.
[15]Fuentes-Duculan J,Bonifacio KM,Hawkes JE,et al.Autoantigens ADAMTSL5 and LL37 are significantly upregulated in active Psoriasis and localized with keratinocytes, dendritic cells and other leukocytes[J].Exp Dermatol,2017,26(11):1075-1082.
[16]陳晨,孟艳.血管紧张素Ⅱ对树突状细胞功能的影响[J].首都医科大学学报,2017,38(5):709-714.
[17]Carrascosa JM,Montecinos MT,Ballescá F,et al.Correlation between trough serum levels of adalimumab and absolute PASI score in a series of patients with psoriasis[J].J Dermatolog Treat,2018,29(2):140-144.
[收稿日期]2020-07-07
本文引用格式:杨洪,李慧,马红艳.阿维A联合阿达木单抗调控MAPK/NF-κB通路对银屑病小鼠模型的疗效及Th17/Th22、DC水平的影响研究[J].中国美容医学,2021,30(9):7-11.
