毛叶藜芦中甾体生物碱鉴定及其促进溶酶体生成活性的研究
2021-11-03朱朋艳李璐晶李国栋袁文娟王宣军
乔 妙,朱朋艳,李 静,李璐晶,李国栋,丁 骁,袁文娟*,王宣军*
1云南农业大学 普洱茶学教育部重点实验室;2云南农业大学理学院,昆明 650201;3云南中医药大学,昆明 650504;4中科院昆明植物研究所,昆明 650201
溶酶的生物合成功能障碍与神经退行性疾病密切相关[1-4],溶酶体作为细胞内负责降解的主要细胞器,有助于清除细胞内受损老化的细胞器和错误折叠的蛋白质,对于维持神经系统的稳态非常重要,与神经退行性疾病紧密相关[5,6]。藜芦是百合科藜芦属植物,多年生草本植物。藜芦属植物全世界约有40多种,我国记载有13个种1个变种,云南有4个种[7]。葛洪所著《肘后备急方》(1955年版)中记载藜芦能治疗“中风不省人事,牙关紧咬者”;中药大辞典亦称中药藜芦用于“中风失语、头痛、黄疸、疥疮、疟疾、痢疾的治疗及杀虫、催吐等”。藜芦功效提示与神经性退行性疾病有关。目前为止,藜芦中甾体生物碱被认为是藜芦属植物的活性物质基础,至今已分离得到200余种,按其骨架可以分为solanidine、veratramine、jervine、cevanine 4种骨架类型[8](见图1),多具有C-27型甾体骨架,其中solanidine、veratramine属于胆甾烷型生物碱,A、B、C环均为六元环,D环为五元环,根据氮原子形成的不同区分,E/F为C-16位与N形成吲哚嗪环为solanidine型生物碱,veratramine型生物碱多不具有E环,F环为哌啶环;jervine和cevanine属于异胆甾烷生物碱,其特征为具c-nor-homo[14(13→12)-abeo]环体系。A、B、D环为六元环,C环均为五元环,cevanine型生物碱为C-17与F环的N原子环合而成一个新的六元环E,jervine与cevine生物碱骨架差别在于C-17与氮原子之间有无价键相连。目前已有的研究表明jervine型生物碱具有较强的镇痛活性[9];veratramine型生物碱的活性较为广泛,是5-HT受体拮抗剂[10],参与AP-1的靶DNA序列的调控[11],阻断钠通道的能力[12],veratramine型生物碱还具有很强的体内外血小板聚集抑制活性[13],抑制动脉血栓形成,其中抗肿瘤研究较多[14,15];cyclopamine为首个hedgehog(Hh)信号通路抑制剂[16],抑制该通路异常激活导致的肿瘤生长。综上,此类生物碱与神经性退行性疾病研究至今未见报道。
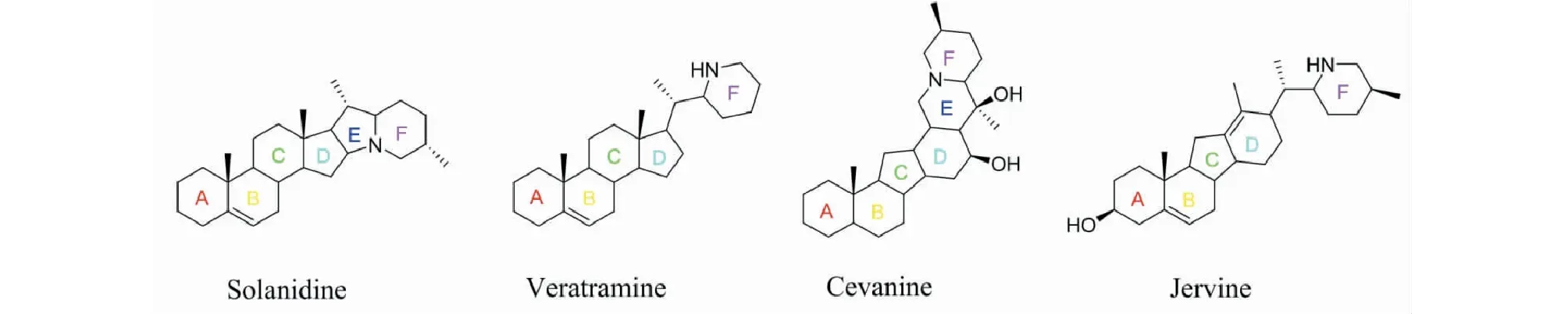
图1 藜芦属生物碱中四种骨架类型Fig.1 Four skeletons of the steroidal alkaloids from genus Veratrum
藜芦的功效启示将目光集中到“中风失语”,与神经退行性疾病相关,以此为契机,选择藜芦药用植物来源—毛叶藜芦为对象开展研究。我们对毛叶藜芦根及根茎的甲醇提取物的甾体生物碱类物质进行研究,以期从毛叶藜芦根及根茎中分离得到促进溶酶体生成的化学成分,进而阐明毛叶藜芦中影响溶酶体功能的活性物质基础,并为神经退行性疾病提供先导化合物。
1 材料与方法
1.1 材料
1.1.1 供试材料
本研究所用的原材料于2018年8月采自云南香格里拉,由云南中医药大学李国栋副教授鉴定为毛叶藜芦的根及根茎。标本存于云南农业大学普洱茶教育部重点实验室(20180011)。
1.1.2 实验仪器
DLSB-5/25型循环水式真空泵(巩义市予华仪器有限责任公司);EYELA旋转蒸发仪(上海爱朗仪器有限公司);AVANCE III 500 MHz核磁共振波谱仪;AVANCE III 600 MHz核磁共振波谱仪;Agilent 1290/6538 Q-TOF液质联用色谱仪和Agilent 1200高效液相色谱仪;Agilent ZORBAX SB-C18色谱柱(250×9.4 mm,5 μm)。
硅胶(80~100、200~300目,青岛海洋化工厂);Sephadex LH-20(40~70 μm,Amersham Pharmacia Biotech AB,乌普萨拉,瑞典);MCI-gel CHP20P(75~100 μm,Mitsubishi Chemical Co.,Ltd.);Rp-C18(40~60 μm,Merck);薄层层析用预制硅胶GF-254(青岛海浪硅胶干燥剂厂)。薄层层析展开剂为石油醚—乙酸乙酯系统以及氯仿—甲醇系统。显色剂为稀碘化铋钾溶液。试剂为分析纯或工业纯(重蒸),本次试验过程中所使用的化学试剂均由天津大茂化学试剂厂提供。
1.2 方法
1.2.1 提取分离
毛叶藜芦的干燥根及根茎(20 kg),粉碎,用甲醇回流提取4次,每次4 L,过滤,浓缩得浸膏3 kg。浸膏经少量水分散后,稀盐酸调节pH值至2~3,用乙酸乙酯适量萃取3次,收集乙酸乙酯液,浓缩得毛叶藜芦酸性部分;水液继续用氨水调节pH值9~10,用乙酸乙酯适量萃取4次,合并乙酸乙酯溶液,浓缩得总生物碱部分(约500 g);生物碱部分用硅胶(80~100目)拌样,用石油醚-乙酸乙酯(1∶0→0∶1,V/V)进行梯度洗脱,收集洗脱液,TLC检测(稀碘化铋钾显色),合并,得到5个部分Fr.A~E;Fr.C(50 g)馏分经MCI色谱柱(甲醇—水,40∶60→90∶10)梯度洗脱,TLC检测(稀碘化铋钾显色),得到4个馏分Fr.C1~C4和化合物1(2 g)。Fr.C1(2.8 g)经Sephadex LH-20凝胶柱(i.d.2.0 cm×180 cm,40~70 μm),甲醇洗脱得化合物2(500 mg)和Fr.C1III(200 mg),Fr.C1III进一步用半制备液相色谱仪经乙腈-0.01%三乙胺(80∶20)为流动相洗脱分离得化合物7(10 mg);Fr.C3(5.4 g)经硅胶柱(200~300目),用石油醚—乙酸乙酯(25∶1)洗脱得化合物5(20 mg)和Fr.C3II(2 g);Fr.C3II经Sephadex LH-20凝胶柱(i.d.2.0 cm×180 cm,40~70 μm),继续用半制备液相色谱仪分离得化合物3(20.1 mg)、4(3.2 mg);Fr.D(60g)馏分经反相RP-C18柱(甲醇—水,50∶50→80∶20)梯度洗脱,TLC检测(稀碘化铋钾显色),得到3个馏分Fr.D1~D3,Fr.D2(10.2 g)经硅胶柱(200~300目),用二氯甲烷—乙酸乙酯(4∶1)洗脱得化合物8(25.8 mg)和Fr.D2III,Fr.D2III(820 mg)经Sephadex LH-20凝胶柱(i.d.2.0 cm×180 cm,40~70 μm),半制备液相色谱仪分离得化合物6(10 mg)。
1.2.2 结构鉴定
对分离得到的化合物,利用理化性质、1D NMR(1H、13C NMR)、ESI-MS和文献数据比等手段确定其化学结构。
1.2.3 促进溶酶体生成活性筛选[17]
将HeLa细胞铺于12孔板,待每孔细胞生长到80%左右时,在细胞状态良好的情况下,将溶解于DMSO中的甾体生物碱加入到培养液中至终浓度为20 μM。放置培养箱中孵育3 h后加入Lysotracker Red DND 99,使Lysotracker Red DND 99终浓度为0.3 μM,继续孵育30 min。孵育后,去除含有Lysotracker Red DND 99的培养液,添加新的培养液,可直接置于激光共聚焦显微镜下观测并筛选荧光强度减弱或增强的处理组。DMSO处理组作为阴性对照,HEP-14处理组为阳性对照。
2 结果与分析
2.1 化合物的结构鉴定
化合物1白色无定形粉末;ESI-MS:m/z410 [M+H]+;分子式为C27H39NO2;1H NMR(500 MHz,CD3OD)δ:7.07(1H,d,J=7.8 Hz,H-16),6.94(1H,d,J=7.8 Hz,H-15),5.49(1H,d,J=7.8 Hz,H-6),2.30(3H,s,H-18),1.35(3H,d,J=7.2 Hz,H-21),1.15(3H,s,H-19),0.82(3H,d,J=6.6 Hz,H-27);13C NMR(125 MHz,CD3OD)δ:145.1(C-14),144.1(C-5),144.1(C-17),141.2(C-12),133.7(C-13),126.4(C-16),122.8(C-6),120.9(C-15),72.6(C-3),71.9(C-23),67.9(C-22),58.8(C-9),54.6(C-26),45.0(C-24),42.7(C-8),42.5(C-4),39.3(C-1),38.1(C-10),32.6(C-25),32.0(C-2),31.6(C-11),31.4(C-7),21.2(C-21),19.6(C-27),19.2(C-19),16.0(C-18)。以上数据与文献[18]报道基本一致,故确定该化合物为veratramine。
化合物2白色无定形粉末;ESI-MS:m/z398 [M+H]+;分子式为C27H43NO;1H NMR(500 MHz,CDCl3)δ:5.35(1H,br s,H-6),1.01(3H,s,H-19),0.92(3H,d,J=6.7 Hz,H-21),0.84(3H,s,H-18),0.84(3H,d,J=8.2 Hz,H-27);13C NMR(125 MHz,CDCl3)δ:140.8(C-5),121.7(C-6),74.7(C-22),71.8(C-3),69.1(C-16),63.1(C-17),60.3(C-26),57.6(C-14),50.2(C-9),42.3(C-4),40.3(C-13),40.0(C-12),37.3(C-1),36.7(C-20),36.6(C-10),33.4(C-15),32.1(C-7),31.7(C-24),31.7(C-8),31.3(C-2),31.1(C-25),29.2(C-23),20.9(C-11),19.5(C-18),19.4(C-27),18.7(C-21),16.9(C-19)。以上数据与文献[19]报道基本一致,故确定该化合物为solasodine。
化合物3白色无定形粉末;ESI-MS:m/z414 [M+H]+;分子式为C27H43NO2;1H NMR(500 MHz,CDCl3)δ:5.36(1H,br s,H-6),1.01(3H,s,H-19),0.95(3H,d,J=6.3 Hz,H-21),0.89 (3H,s,H-18),0.84(3H,d,J=6.7 Hz,H-27);13C NMR(125 MHz,CDCl3)δ:140.6(C-5),121.7(C-6),74.6(C-22),72.7(C-12),71.7(C-3),68.3(C-16),60.1(C-26),54.0(C-17),49.1(C-9),44.4(C-13),43.9(C-14),42.3(C-4),40.0(C-12),37.2(C-1),36.6(C-20),36.3(C-10),33.3(C-11),31.8(C-7),31.7(C-24),31.6(C-8),31.0(C-2),31.0(C-25),29.2(C-23),28.4(C-15),19.5(C-18),19.3(C-27),18.1(C-21),17.7(C-19)。以上数据与文献[20]报道基本一致,故确定该化合物为epirubijervine。
化合物4白色无定形粉末;ESI-MS:m/z426 [M+H]+;分子式为C27H39NO3;1H NMR(500 MHz,CDCl3)δ:5.31(1H,br s,H-6),3.69(1H,m,H-3),3.40(1H,m,H-23),2.12(3H,s,H-19),1.09(3H,d,J=7.5 Hz,H-27),1.01(3H,d,J=6.7 Hz,H-21),0.93(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:207.0(C-11),143.2(C-13),142.1(C-11),138.3(C-12),120.8(C-6),86.4(C-17),72.5(C-23),71.1(C-3),63.6(C-22),62.5(C-9),55.1(C-26),44.5(C-14),41.0(C-4),38.2(C-20),37.9(C-8),37.1(C-10),37.0(C-24),36.7(C-1),30.6(C-16),30.5(C-7),30.3(C-2),24.1(C-15),18.3(C-27),17.9(C-18),12.1(C-19),11.0(C-21)。以上数据与文献[21]报道基本一致,故确定该化合物为jervine。
化合物5白色无定形粉末;ESI-MS:m/z636 [M+H]+;分子式为C34H54NO3;1H NMR(500 MHz,CDCl3,)δ:5.35(1H,d,J=3.3 Hz,H-15),4.91(1H,d,J=4.2 Hz,H-3),4.60(1H,s,H-7),2.07(1H,s,H-2′′),2.04(1H,s,H-2′),1.18(3H,s,H-21),1.13(3H,d,J=7.0 Hz,H-5′),1.07(3H,d,J=7.1 Hz,H-27),0.96 (3H,s,H-19),0.89(3H,d,J=7.5 Hz,H-4′);13C NMR(125 MHz,CDCl3)δ:175.7(C-1′),170.5(C-1′′),105.4(C-4),92.9(C-9),81.2(C-14),74.6(C-3),73.0(C-20),69.7(C-15),69.6(C-22),69.3(C-22),66.7(C-7),61.4(C-26),61.3(C-18),47.9(C-8),47.4(C-17),46.0(C-5),45.9(C-10),45.5(C-12),41.2(C-2′),33.8(C-13),33.1(C-11),32.3(C-1),28.9(C-24),28.5(C-6),27.3(C-25),26.8(C-2),26.4(C-3′),21.5(C-21),19.8(C-1′′),19.1(C-19),18.4(C-23),17.1(C-27),16.8(C-5′),11.6(C-4′)。以上数据与文献[22]报道基本一致,故确定该化合物为3-acetyl-15-methylbutyroylgermine。
化合物6白色无定形粉末;ESI-MS:m/z414 [M+H]+;分子式为C27H43NO2;1H NMR(500 MHz,CDCl3)δ:5.33(1H,brs,H-6),1.04(3H,s,H-19),1.01(3H,d,J=6.7 Hz,H-21),0.84(3H,d,J=6.4 Hz,H-27);13C NMR(125 MHz,CDCl3)δ:140.9(C-5),121.7(C-6),73.6(C-22),71.8(C-3),69.1(C-16),63.0(C-19),60.3(C-17),57.9(C-26),57.4(C-14),50.2(C-9),45.6(C-13),42.3(C-4),40.0(C-12),37.3(C-1),36.7(C-10),36.1(C-20),33.4(C-2),32.1(C-7),31.8(C-24),31.6(C-25),30.9(C-8),30.6(C-23),29.6(C-15),21.0(C-11),19.5(C-19),19.5(C-27),19.4(C-21)。以上数据与文献[21]报道基本一致,故确定该化合物为isorubijervine。
化合物7白色无定形粉末;ESI-MS:m/z414 [M+H]+;分子式为C27H43NO2;1H NMR(500 MHz,CDCl3)δ:5.37(1H,m,H-15),3.41(1H,m,H-3),3.20(3H,m,OCH3),2.99(1H,d,J=6.3 Hz,H-22),1.77(3H,s,H-19),0.97(3H,s,H-18),0.87(3H,d,J=6.7 Hz,H-27),0.85(3H,d,J=7.7 Hz,H-21);13C NMR(125 MHz,CDCl3,)δ:144.1(C-13),127.4(C-12),122.6(C-6),106.4(C-23),90.2(C-17),72.5(C-3),65.3(C-22),53.9(C-9),49.8(C-14),48.7(C-20),47.6(OCH3),43.9(C-8),43.2(C-7),42.6(C-4),40.0(C-24),39.4(C-1),37.9(C-10),32.0(C-2),30.4(C-25),30.4(C-25),29.0(C-11),29.0(C-16),25.3(C-15),19.3(C-27),18.8(C-18),15.5(C-19),12.2(C-21)。以上数据与文献[23]报道基本一致,故确定该化合物为23-methoxy-cyclopamine。
化合物 8白色无定形粉末;ESI-MS:m/z:412 [M+H]+;分子式为C27H41NO2;1H NMR(600 MHz,CDCl3)δ:5.39(1H,brs,H-6),1.28(3H,s,H-19),1.17(3H,s,H-18),1.01(3H,d,J=6.6 Hz,H-21),0.87(3H,d,J=6.6 Hz,H-27);13C NMR(150 MHz,CDCl3)δ:142.2(C-5),122.2(C-6),75.9(C-22),72.1(C-3),69.3(C-16),61.4(C-26),58.6(C-17),56.1(C-13),54.9(C-9),54.1(C-14),42.8(C-4),38.5(C-20),38.4(C-12),38.1(C-1),34.1(C-10),32.6(C-11),32.2(C-7),32.1(C-24),32.0(C-8),31.0(C-2), 31.0(C-25),29.8(C-23),28.7(C-15),19.8(C-18),19.3(C-27),16.9(C-21),16.7(C-19)。以上数据与文献[24]报道基本一致,故确定该化合物为rubijervone-12。
2.2 促进溶酶体生成活性测定结果
利用中科院昆明植物研究所郝小江课题组构建的促进溶酶体生成活性的细胞筛选平台,对已分离得到的藜芦属生物碱类化合物进行了筛选,化合物1、2、3、6和7均能促进溶酶体生成,其中化合物6效果最佳(如图2);化合物6处理3 h,呈现出更多的Lysotracker 标记的溶酶体,大幅度的增加细胞中溶酶体的数量。HEP-14为PKC激动剂,为阳性对照。
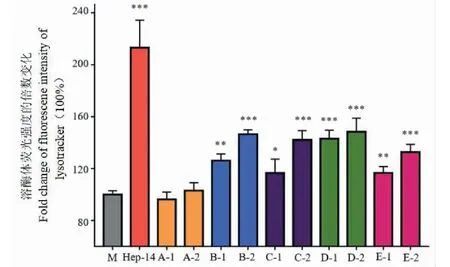
图2 化合物1、2、3、6和7显著促进溶酶体生成Fig.2 Compounds 1,2,3,6 and 7 significantly promoted lysosomal biosynthesis 注:M:空白;Hep-14:阳性对照;A:化合物2;B:化合物7;C:化合物3;D:化合物6;E:化合物1;1:20 μM;2:40 μM。Note: M: Blank;Hep-14: Positive control;A: Compound 2;B: Compound 7; C: Compound 3;D: Compound 6;E: Compound 1;1: 20 μM; 2: 40 μM.
3 讨论
意大利学者Ballabio课题组研究发现溶酶体的生成在转录水平上主要是由MiTF/TFE家族的转录因子TFEB和TFE3所调控的,在多种组织中均有表达[25]。在细胞正常的状态下,TFEB是磷酸化的,与14-3-3蛋白结合而弥散于细胞质中。但是在外界刺激下,例如饥饿或者溶酶体功能受损时,或细胞受到胁迫后,TFEB去磷酸化从而进入细胞核,调控下游基因的表达,广泛参与各种生理病理活动[26]。TFEB的磷酸化也受到体内外各种蛋白分子的调节。通过TFEB/CLEAR网络作为调控中心,促进溶酶体的生成和相关的溶酶体降解功能(大分子降解,自噬-溶酶体通路,有丝分裂和噬脂等),在改善神经退行性疾病中有着至关重要的作用。目前,文献报道调控TFEB入核的小分子化合物,有巨大戟烷型二萜HEP14和HEP15、重楼皂苷XVII、姜黄素衍生物[27,28];未见甾体生物碱促进溶酶体生成的报道。故寻找新结构类型促进溶酶体生物发生的先导化合物,并探讨其作用机制,为新治疗神经退行性药物开发提供新的思路。
本研究从中医药理论指导思想出发,目光聚焦于藜芦治疗“中风失语”,推测与神经退行性疾病相关,以此为契机开展毛叶藜芦化学成分的研究,深入挖掘藜芦的活性物质基础,探讨是否能够促进溶酶体的生成,为神经性退行疾病的治疗提供先导化合物。本次实验从毛叶藜芦中分离得到了8个甾体生物碱类成分,化合物1、2、3、6和7均能促进溶酶体生成,其中化合物6效果最佳,我们发现化合物6能够促进转录因子TFEB入核,后续将对筛选得到的化合物进行溶酶体功能的验证以及作用机制的研究。
