栀子花提取物的制备工艺优化及其抗氧化活性研究
2021-11-03毛春芹苏联麟皮文霞陆兔林
徐 祯,毛春芹,2,顾 薇,2,毛 靖,苏联麟,李 林,皮文霞*,陆兔林,2*
1南京中医药大学;2江苏省中医外用药开发与应用工程研究中心,南京 210023
栀子花是茜草科植物栀子GardeniajasminoidesEllis和重瓣栀子GardeniajasminoidesEllis var.fortuniana(Lindl.)Hara的干燥花,收录于《中华本草》[1]《中药大辞典》[2]等书籍,其味苦、性寒,入药具有清肺止咳、凉血止血的作用。栀子花食用、药用、妆用历史悠久,《滇南本草》[3]言其可“止肺热咳嗽,止鼻衄血,消痰”;《千金翼方》[4]《本草纲目》[5]均称其可“悦颜色”。现代研究表明栀子花含有精油、三萜类、黄酮类、酚酸类、生物碱类等多种成分[6-8]。栀子花气味芳香,从中提取的精油具有舒缓身心、抗焦虑[9]等作用,但因含量少、难以提取而极其珍贵;研究表明栀子花及其精油能够清除多种自由基[6,10],具有良好的抗氧化美容效果。黄酮类物质是具有较强抗氧化功效的植物活性成分。栀子花与常用中药材栀子来源自同一植物,种植广泛、资源丰富,其提取物目前已收录于《化妆品已使用原料目录》2021年版中,但由于研究较少,国内对栀子花的利用率不高,也造成了栀子花资源的大量浪费。
植物精油的传统提取方法为水蒸气蒸馏法,这种方法设备简单,但提取率低,容易导致提取的精油香味不纯正[11]。超临界CO2萃取法[12,13]是一种以CO2流体为溶剂、从混合物中分离出组分的提取方法,这种方法与水蒸气蒸馏法相比提取效率高,能够更加有效保存精油的天然香味,且CO2可回收、无毒,不会产生浪费和污染。有文献报道[12],采用这种提取方法得到的栀子花精油没有受到水蒸气的高温影响,一些易挥发的芳香成分保留了下来,具有鲜栀子花的特征香气。除此之外,也有研究[14,15]对栀子花中黄酮类成分的提取工艺进行了考察。由于精油和黄酮都是植物中生物活性较强的大类成分,且应用范围广泛,将这两种成分进行综合提取在多种中药和含有精油的植物中已有应用,如紫花地丁[16]、枇杷花[17]、玫瑰[18]、薰衣草[19]等。目前对栀子花精油(Gardeniajasminoidesflower essential oil,GJFEO)或栀子花总黄酮类提取物(Gardeniajasminoidesflower flavonoids extract,GJFFE)的提取均为以栀子花为原料进行单一提取,对栀子花展开综合性深加工研究、可以提高栀子花的利用率,为中药非药用部位资源的开发利用提供参考。
经文献报道,GJFEO在体外化学实验中对DPPH、ABTS及OH自由基都有较好的清除作用[6,10],植物黄酮也是天然抗氧化活性成分研究中的一大热点[20]。目前栀子花细胞水平和动物水平的抗氧化活性研究较少,对栀子花进行更深入的药理活性研究可以为相关抗氧化化妆品及日用产品的开发提供技术支持和理论依据。本研究将对栀子花中精油和总黄酮成分的综合提取工艺进行优化,并对栀子花的抗氧化活性进行研究,以期解决以上问题,并为中药非药用部位的综合利用提供参考。
1 材料与方法
1.1 样品与试剂
栀子花购买自浙江温州,批号20200520,干燥方式为阴干。经南京中医药大学药学院陈建伟教授鉴定为茜草科植物栀子GardeniajasminoidesEllis的干燥花。
芦丁(上海源叶生物科技有限公司,纯度98%,批号YM0313SA14);没食子酸对照品(国药集团化学试剂有限公司,纯度99%,批号20200408);福林酚试剂(国药集团化学试剂有限公司);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(国药集团化学试剂有限公司);噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)(美国Sigma-Aldrich公司);二甲基亚砜(dimethyl sulfoxide,DMSO)(上海九亿化学试剂有限公司);DMEM培养基(赛默飞世尔生物化学制品有限公司);胎牛血清(美国Invigentech公司);青链霉素混合液(北京索莱宝科技有限公司);无菌PBS(博士德生物科技有限公司);胰蛋白酶-EDTA消化液(北京索莱宝科技有限公司);其余试剂均为分析纯。
1.2 仪器与设备
FW80型高速万能粉碎机(天津布泰斯特仪器有限公司);FA1104型电子分析天平(上海精密科学仪器有限公司);DY221-50-06型超临界CO2萃取装置(海安宏麦机械有限公司);HH-S4型恒温水浴锅(巩义市予华仪器有限责任公司);TU-1901型双光束紫外分光光度计(北京普析通用仪器有限责任公司);KQ-500E型医用超声清洗器(昆山超声仪器有限公司);SW-CJ-1F型洁净工作台(苏州苏洁净化设备有限公司);3131型二氧化碳培养箱(赛默飞世尔科技有限公司);细胞培养板(美国 Corning公司);CKX31型显微镜(南京奥力科学仪器有限公司);Infinite M200PRO型酶标仪(瑞士TECAN公司)。
1.3 细胞株
人永生化角质形成(HaCaT)细胞(上海富衡生物科技有限公司)。
1.4 方法
1.4.1 栀子花精油的提取工艺研究
1.4.1.1 单因素试验
本研究首先采用超临界CO2流体萃取法对栀子花进行提取,该方法不仅提取率高、经济环保,且方便栀子花残渣的进一步提取利用。参数设置参考相关文献[12],以精油得率为指标,分别对萃取温度(30、35、40、45 ℃)、萃取压力(15、20、25、30、35 MPa)、分离压力(8、10、12、14 MPa)进行单因素考察。将干栀子花粉碎后过50目筛,取100 g栀子花粉末装入超临界流体萃取装置,设置萃取温度、萃取压力、分离压力,分离温度为35 ℃,萃取1 h后打开分离釜阀门收集GJFEO。
1.4.1.2 正交试验
在单因素实验结果的基础上,对超临界CO2萃取法萃取GJFEO的工艺进一步优化,因素水平考察指标如表1所示。
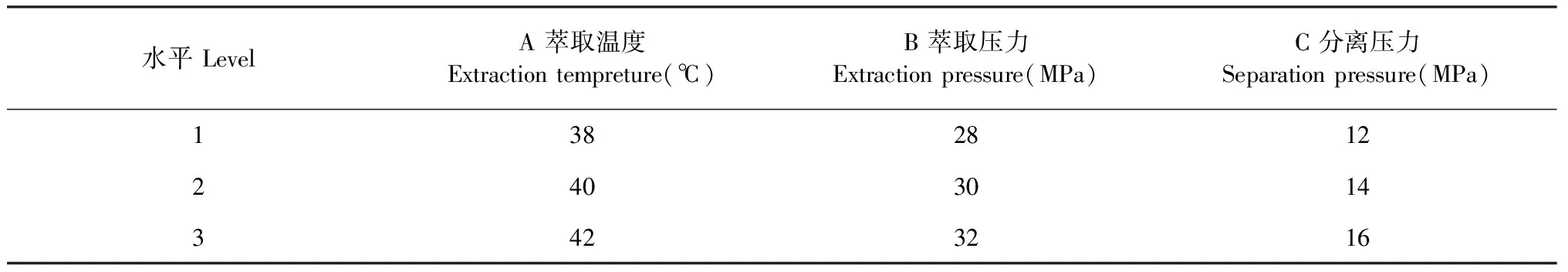
表1 GJFEO提取工艺正交试验因素水平表Table 1 Factors and levels analysis of orthogonal test of GJFEO extraction process
1.4.2 栀子花总黄酮提取物的提取工艺研究
1.4.2.1 总黄酮标准曲线的绘制
总黄酮的显色及测定参考文献方法[14]。精密吸取质量浓度为100.1 μg/mL的芦丁对照品溶液2.0、2.5、3.0,3.5、4.0、4.5、5.0 mL,分别加入到10 mL容量瓶中,加70%乙醇2 mL,混匀,加入5%亚硝酸钠0.3 mL,混匀静置5 min,再加入10%硝酸铝0.3 mL,混匀静置6 min,加入4%氢氧化钠4 mL,混匀静置15 min,用70%乙醇定容至刻度,摇匀;用同样的方法制备空白对照。在507 nm波长处测定吸光度,以吸光度为纵坐标(Y),浓度为横坐标(X),进行线性回归。
1.4.2.2 单因素试验
收集萃取精油后的栀子花粉末残渣提取其中的总黄酮类物质可提高栀子花的利用率。本研究参考相关文献[15],以乙醇为溶剂对栀子花残渣进行超声提取,以总黄酮提取率为指标,对乙醇浓度(50%、60%、70%、80%)、液料比(10∶1、15∶1、20∶1、25∶1)、提取时间(20、30、40、50 min)、提取次数(1、2、3次)进行单因素考察,确定GJFFE的最佳提取工艺。GJFFE的提取步骤如下。
称取提取完精油的栀子花粉末残渣10 g,加入不同浓度乙醇超声(功率500 W,频率40 kHz)提取,合并提取液,过滤后得到滤液,浓缩至50 mL得到栀子花总黄酮提取液,提取液蒸干可得到浸膏,即为GJFFE。GJFFE用50%乙醇溶解后定容至50 mL,参照“1.4.2.1”中总黄酮的显色方法进行显色和测定,总黄酮的提取率计算公式见式(1):
(1)
1.4.3 栀子花复合提取物的制备
将同一份栀子花样品中所得到的GJFEO和GJFFE称重,得到两种提取物的质量比。按照此质量比配制得到栀子花复合提取物(Gardeniajasminoidesflower compound extract,GJFCE)。
1.4.4 栀子花提取物对HaCaT细胞的毒性
取GJFEO、GJFFE、GJFCE,用含1% DMSO的DMEM培养基配制稀释成不同浓度的药液。
取对数生长期的HaCaT细胞,稀释至7×104个/mL后,每孔100 μL接种于96孔板内,在37 ℃、5% CO2培养箱中孵育24 h;弃旧培养液,以不同浓度的GJFEO(50.00~1 000.00 μg/mL)、GJFFE(50.00~1 000.00 μg/mL)、GJFCE(10.42~833.33 μg/mL)给药,同时设置空白组、阳性组(SDS浓度为0.01 mg/mL)、调零组,每组设定5个复孔,孵育24 h;弃旧培养液,每孔加入100 μL培养液,避光条件下,每孔再加入20 μL MTT溶液(0.05 mg/mL),孵育4 h;弃去培养液,每孔加入150 μL DMSO,振荡10 min,用酶标仪在570 nm处检测各孔的吸光度A,按式(2)计算各组细胞相对存活率,用Graphpad Prism 7软件处理数据并计算IC50。

(2)
1.4.5 三种提取物对H2O2诱导的HaCaT细胞氧化损伤的保护作用
按照以下步骤先分别比较GJFEO、GJFFE和GJFCE不同浓度下的抗氧化活性,再选出各自效果最佳的浓度进行比较。
取对数生长期的HaCaT细胞,稀释至7×104个/mL后,每孔100 μL接种于96孔板内,孵育24 h;弃去旧培养液,以不同浓度的GJFEO(12.50~100.00 μg/mL)、GJFFE(20.00~320.00 μg/mL)、GJFCE(2.09~133.44 μg/mL)给药,同时设置空白组、阳性组(Vc浓度为0.008 mg/mL)、模型组、调零组,每组设定5个复孔,孵育24 h;除空白组和调零组外,每孔加50 μL H2O2(终浓度0.8 mmol/L),孵育4 h;弃去旧培养液,每孔加入100 μL培养液,避光条件下,每孔再加入20 μL MTT溶液,孵育4 h;弃去培养液,每孔加入150 μL DMSO,振荡10 min,用酶标仪在570 nm处检测各孔的吸光度A,按式(2)计算各组细胞相对存活率。
2 结果与分析
2.1 GJFEO的提取工艺研究
2.1.1 萃取温度对GJFEO得率的影响
设置萃取压力为20 MPa,分离压力为10 MPa,在30~45 ℃范围内考察萃取温度对栀子花精油得率的影响。由图1A可知,精油得率随着萃取温度变化而变化,当萃取温度在30~40 ℃之间时,精油得率较高,萃取温度为40 ℃,最高可达0.81%;此时萃取温度再升高,精油得率反而下降。原因可能为恒定压力下,CO2密度随温度的升高而降低,而温度对溶质的溶解度同样具有一定影响。这种影响程度除实验外目前还不可预测[21]。因此根据本研究结果,确定40 ℃为最佳萃取温度。
2.1.2 萃取压力对GJFEO得率的影响
设置萃取温度为45 ℃,分离压力为10 MPa,在15~35 MPa范围内考察萃取压力对栀子花精油得率的影响。由图1B可知,精油得率随萃取压力的增大有升高趋势,当萃取压力为30 MPa时最高,达到了1.14%,此时继续增大萃取压力,精油得率则会开始下降,原因可能是超临界状态下,压力和温度对萃取效果产生的交互影响较大。大多数情况下,随压力的增大,脂溶性物质的提取率会相应升高,但速率会减慢;且溶出的物质种类会增加。在超临界流体萃取法中,萃取的效果往往取决于萃取压力和温度的共同作用,其中萃取压力产生的影响更大[21]。根据本实验结果,选择30 MPa为最佳萃取压力。
2.1.3 分离压力对GJFEO得率的影响
当流体状的CO2携带精油进入分离釜时,压力降低使得CO2与精油分离。设置萃取温度为45 ℃,萃取压力为20 MPa,在8~14 MPa范围内考察分离压力对GJFEO得率的影响。由图1C可知,GJFEO的得率随着分离压力的升高而升高。当分离压力为14 MPa时,精油得率最高,为1.06%,因此选择14 MPa为最佳分离压力。

图1 GJFEO提取工艺的单因素考察Fig.1 Single factors investigation of GJFEO extraction process
2.1.4 正交试验结果
根据单因素考察的结果设置正交试验的因素水平,对GJFEO的提取工艺进行进一步的优化。正交试验结果和方差分析如表2、3所示,由此可知,在本研究中,萃取温度对栀子花精油得率的影响最大,其次是萃取压力,分离压力的影响最小。因此超临界流体萃取法提取GJFEO的最佳工艺根据实验结果选择萃取温度为38 ℃,萃取压力为32 MPa,分离压力则选择能耗较少的12 MPa。

表2 GJFEO提取工艺的正交试验结果Table 2 Orthogonal test results of GJFEO extraction process
2.2 GJFFE的提取工艺研究
2.2.1 总黄酮标准曲线的绘制
在507 nm波长处测定不同浓度芦丁对照品溶液显色后的吸光度,以吸光度为纵坐标(Y),浓度为横坐标(X),进行线性回归,回归方程为Y= 13.487X- 0.109 4,r= 0.999 6,表明总黄酮在20.02 ~ 50.05 μg/mL范围内线性关系良好。

表3 GJFEO提取工艺正交试验方差分析Table 3 The analysis of variance of orthogonal test of GJFEO extraction process
2.2.2 乙醇浓度对GJFFE提取的影响
将提取完精油的栀子花分别用50%、60%、70%、80%的乙醇,按液料比20∶1进行提取,每次30 min,共提取2次,测定并计算总黄酮的提取率。结果如图2A所示,栀子花残渣中总黄酮的提取率随着乙醇浓度的升高而降低,说明较低浓度的乙醇有利于黄酮类成分的溶出。根据本实验结果,选择50%为最佳乙醇浓度。
2.2.3 液料比对GJFFE提取的影响
将提取完精油的栀子花用60%乙醇,分别按液料比10∶1、15∶1、20∶1、25∶1进行提取,每次30 min,共提取2次,测定并计算总黄酮的提取率。结果如图2B所示,栀子花残渣中总黄酮的提取率随着液料比的增大而缓慢升高,说明在10∶1~25∶1的液料比范围内,液料比对栀子花残渣中总黄酮成分提取的影响不大。根据本实验结果,选择25∶1为最佳液料比。
2.2.4 提取时间对GJFFE提取的影响
将提取完精油的栀子花用60%乙醇,按液料比20∶1进行提取,提取时间分别为每次20、30、40、50 min,共提取2次,测定并计算总黄酮的提取率。结果如图2C所示,栀子花残渣中总黄酮的提取率随着每次提取时间的增长而升高,当提取时间为50 min时提取效果最好,此时总黄酮提取率2.05%。因此选择50 min为每次的提取时间。
2.2.5 提取次数对GJFFE提取的影响
将提取完精油的栀子花分别用60%乙醇,按液料比20∶1进行提取,每次30 min,各提取1、2、3次,测定并计算总黄酮的提取率。结果如图2D所示,栀子花残渣中总黄酮的提取率随着提取次数的增大而升高,提取2次的提取率比提取1次显著升高,但当提取次数为3次时,升高幅度不大,为提高效率节约能源,选择提取次数为2次。

图2 GJFFE提取工艺的单因素考察Fig.2 Single factors investigation of GJFFE extraction process
2.3 栀子花复合提取物的制备
在同一份栀子花样品中提取得到的GJFEO质量为1.07 g、GJFFE质量为23.79 g,质量比约为1∶24。将GJFEO和GJFFE按照此比例进行复配可以最大程度地利用两种提取物。因此从提高栀子花原料利用度的角度出发,将GJFEO和GJFFE按质量比1∶24复配制得GJFCE。
2.4 栀子花提取物对HaCaT细胞的毒性
角质形成细胞是人类表皮组织中最主要的细胞群,占95%。HaCaT细胞是研究外用药物制剂及化妆品对皮肤安全性及有效性时的首选细胞。SDS是一种阴离子表面活性剂,运用于化妆品、日化用品中,对人体有微毒,常被用于测定皮肤刺激性的实验。以SDS为阳性药,采用MTT法分别测定给药后的细胞相对存活率,以IC50的大小来反映栀子花精油、栀子花黄酮提取物和复合提取物的对HaCaT细胞的毒性,结果见图3。由结果可知,栀子花精油和黄酮提取物对皮肤细胞的毒性较小,但二者按比例复配后毒性显著增大。
2.5 栀子花提取物对H2O2诱导的HaCaT细胞氧化损伤的保护作用
氧化损伤是公认的造成皮肤衰老的主要原因之一。H2O2是一种活性氧,具有强氧化性,使用H2O2作为诱导剂可以模拟出较为真实的皮肤氧化损伤情况。抗坏血酸(Vc)是常用的抗氧化剂,0.008 mg/mL即可发挥作用,且作用较显著。首先考察不同浓度下的GJFEO、GJFFE的抗氧化活性,分别筛选出效果最好的浓度后和GJFCE进行比较,结果如图4A、4B所示。可知当浓度在12.50~50.00 μg/mL之间时,GJFEO组和模型组相比具有显著的抗氧化作用(P<0.01),且效果优于Vc组;当浓度在20.00~160.00 μg/mL之间时,GJFFE组和模型组相比具有抗氧化作用,当浓度为20 μg/mL时,具有显著的抗氧化活性(P<0.001)且效果优于Vc组。细胞的相对存活率随着GJFEO和GJFFE的浓度升高而降低,原因是这两种提取物均具有一定的细胞毒性,浓度升高,细胞毒性也增大。由图4C可知,当浓度在2.09~16.68 μg/mL范围内,GJFCE组和模型组相比具有显著的抗氧化活性(P<0.05),且优于Vc组。GJFCE组发挥抗氧化活性的浓度明显低于GJFEO组和GJFFE组,当浓度为4.17 μg/mL时,GJFCE组抗氧化活性最佳。
根据实验结果筛选,GJFEO、GJFFE和GJFCE抗氧化效果最好的浓度分别为25、20、4.17 μg/mL。将这三种效果最好浓度的提取物进行比较,结果如图4D显示,4.17 μg/mL的GJFCE的抗氧化效果优于单一使用的GJFEO或GJFFE(P<0.001),且此时GJFCE中的GJFEO、GJFFE的占比浓度仅为0.17、4.00 μg/mL,远低于此组实验中两种单一提取物的浓度,因此表明将GJFEO和GJFFE按比例复配后可明显提高抗氧化活性。
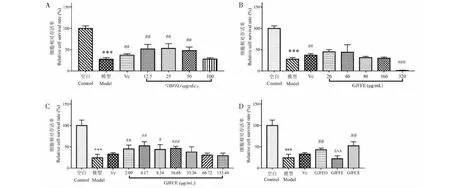
图4 栀子花不同提取物抗H2O2诱导的HaCaT细胞氧化损伤保护作用比较Fig.4 The protective effect of different extracts from Gardenia jasminoides flower against oxidative damage induced by H2O2 in HaCaT cells注:与空白组比较, ***P<0.001;与模型组相比,与模型组比较,#P<0.05,##P<0.01,###P<0.001;与GJFCE组相比,△△△P<0.001。 Note:Compared with the blank group, ***P<0.001;Compared with the model group, #P<0.05,##P<0.01,###P<0.001;Compared with the GJFCE group,△△△P<0.001.
实验结果表明,GJFEO、GJFFE复配后细胞毒性增大,抗氧化作用明显增强,二者可能是产生了协同增效作用。Zhu等[16]对紫花地丁的相关研究同样发现其挥发油和黄酮类成分在清除DPPH自由基上能产生协同作用,但机制尚不明确。植物精油发挥抗氧化作用的机制主要为降低自由基水平和调控影响细胞凋亡的蛋白基因两个方面[22],如薰衣草精油[23]、花椒精油[24]可抑制或清除体内多种自由基、提高超氧化物歧化酶(SOD)活性、调节抑制细胞凋亡的多种蛋白基因等。植物黄酮抑制机体脂质过氧化的机制和精油相似[25],如杨梅黄酮[26]可以提高SOD活性,提高IKBA mRNA表达量、抑制MMP-1 mRNA水平的升高;葛根素[27]对UVA损伤的HaCaT细胞的保护作用可能与激活Keap1/Nrf2信号通路上调抗氧化酶活性和下调IL-1β、Fas有关;补骨脂异黄酮[28]同样可能通过下调相关蛋白表达、提高抗氧化酶活性来保护皮肤细胞。综上所述,植物精油和黄酮都是通过提高抗氧化酶的活性、调控抑制细胞凋亡的蛋白基因等方式来发挥抗氧化作用,二者作用途径高度相似,可能是其复合时发挥协同增效作用的机制之一。GJFCE的抗氧化活性增强的同时其细胞毒性也相应升高,但其产生明显抗氧化活性的浓度在其IC50范围内,表明GJFCE在发挥抗氧化作用时对细胞的损伤仍然较小。
3 结论
本研究采用单因素和正交试验优化了GJFEO的最佳提取工艺为萃取温度38 ℃、萃取压力32 MPa、分离压力12 MPa;采用单因素试验优化了GJFFE的最佳提取工艺为乙醇浓度50%、液料比25∶1、提取时间50 min、共提取2次。两种工艺均条件简单、操作方便,一方面避免了精油传统提取过程中加热的操作,克服了蒸馏法精油香味不纯正、提取率低的缺陷;另一方面对提取完精油的残渣进行再次提取,能够获得其中的总黄酮成分,提高了栀子花原料的利用率。
本研究的实验结果表明,GJFEO、GJFFE、GJFCE均对H2O2损伤的HaCaT细胞有一定的保护作用,且GJFEO与GJFFE复合后能够产生协同增效的作用,提示GJFCE可作为一种高抗氧化性的栀子花提取物进行开发或深入的机制研究。根据实验中GJFEO和GJFFE在栀子花中所占质量比为1∶24,本文中研究的GJFCE从提高原料利用率的角度考虑按照此比例进行复配,后期可对不同比例复配的GJFCE进行进一步的活性评价以优选最佳比例。目前由于开发技术的薄弱,栀子花资源存在大量浪费,本研究的结果可为栀子花相关抗氧化化妆品及日化用品的开发提供技术支持和理论依据,为中药非药用部位的综合利用提供借鉴及参考。
