油菜蜂花粉乙醇提取物对异丙肾上腺素致心肌细胞肥大的保护作用及机制研究
2021-11-03陈立府李志良谢仕慧史培颖
陈立府,孟 菲,2,李志良,2,谢仕慧,史培颖,3 *
1福建农林大学动物科学学院(蜂学学院);2福建农林大学食品科学学院;3天然生物毒素国家地方联合工程实验室,福州 350002
心力衰竭(heart failure,HF)是一种常见的心血管病综合征,是各种心脏疾病发展的终末阶段,其致残率和死亡率均较高。心脏肥大(cardiac hypertrophy,CH)是HF过程中的早期适应性反应,但是长时间的CH会加速心肌纤维化和心脏收缩功能障碍,进而加快HF的进程[1]。CH不仅会引发充血性心力衰竭,也是高血压、心脏瓣膜病、扩张型心肌病、心肌缺血、心肌梗死、心律失常和猝死的独立危险因素[2]。对CH的控制可以显著延缓心肌病的进程。延缓或避免CH的发生是一个主要的治疗目标。
异丙肾上腺素(isoproterenol,ISO)属于肾上腺素能受体激动剂。重复或连续注射ISO兴奋β1-肾上腺素能受体,可使心肌产生毒性损伤,增加心肌的收缩力和耗氧量致使心律失常、后负荷增高和心肌缺血坏死等,导致心肌重塑,从而诱发代偿性CH[3]。因此,ISO常被用来建立CH模型。研究表明ISO诱导的CH会伴有心肌细胞面积增加、蛋白质合成过多以及CH的标记基因如心钠素(ANP)、脑钠肽(BNP)和β-肌球蛋白重链(β-MHC)等的再激活[4,5]。
蜂花粉是众多蜂产品中的典型代表之一,所含成分丰富。据Thakur等的统计显示,蜂花粉主要成分包括碳水化合物(54.22%)、蛋白质(21.30%)、脂质(5.31%)、纤维(8.75%)、灰分(2.91%)等[6],还含有酚酸类化合物、黄酮类化合物、多胺、核苷、氨基酸、脂肪酸、维生素等[6-8]。蜂花粉具有抗氧化[9]、抗心肌梗死[7]、保护肝肾[10]等多种药理活性,具有潜在的应用价值。课题组前期研究了五味子蜂花粉乙醇提取物及其主要成分对H2O2损伤H9c2心肌细胞的保护作用及其机制[11],证实蜂花粉的抗氧化能力对心肌细胞损伤具有保护作用。油菜蜂花粉是蜂产品市场的热销品之一,Zhang等[9]通过比较不同蜂花粉中总酚和总黄酮含量及抗氧化能力的差异,发现油菜蜂花粉的总酚和总黄酮含量较高,抗氧化能力也较强。本文以常见蜂花粉—油菜蜂花粉乙醇提取物(rape bee pollen ethanol extract,RBPEE)为研究对象,鉴定其主要化学成分,并研究其对ISO诱导心肌细胞肥大的干预作用及可能的分子机制,为蜂花粉资源的深度开发利用奠定基础。
1 实验材料与方法
1.1 主要试剂与材料
1.1.1 蜂花粉
油菜(BrassicanapusL.)蜂花粉于2018年12月购自鲜蜂堂青海养蜂基地,按照国标GB/T 30359-2013进行蜂花粉纯度鉴定,纯度大于95%,符合实验要求,于4 ℃保存。
1.1.2 心肌细胞系
H9c2(2-1)(Procell CL-0089)心肌细胞株购买自普诺赛生命科技有限公司(武汉,中国)。
1.1.3 主要实验试剂
纯净水(怡宝);色谱级甲醇、乙腈(德国Merck);甲酸、磷酸盐缓冲溶液PBS(国药集团化学试剂有限公司);胎牛血清FBS、DMEM高糖培养基(赛澳美细胞技术有限公司);青链霉素混合液、胰蛋白酶(美国HyClone公司);盐酸异丙肾上腺素(上海阿拉丁生化科技股份有限公司);尿苷、鸟苷(纯度≥98%)、卡托普利、细胞级DMSO(北京索莱宝科技有限公司);BCA蛋白定量测定试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒、超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);YF®488标记鬼笔环肽(YF®488-Phalloidin)(绿色)(苏州宇恒生物科技有限公司);TransZol UP试剂盒(北京全式金生物技术有限公司);逆转录和荧光定量PCR试剂盒(南京诺唯赞生物科技股份有限公司);PCR引物(福州尚亚生物技术有限公司)。
1.1.4 主要仪器设备
Agilent 1290 Infinity LC仪器、Agilent 6530 QTOF质谱仪(安捷伦科技有限公司);5% CO2培养箱(C150)(Binder);生物安全柜(Hfsafe-1500 A2电动型)(广州莫菲公司);倒置荧光显微镜(TS2-C-S-EC-ELWD 0.3)(Nikon);倒置显微镜(TS-100f)(Nikon);酶标仪(Infinite F50、Infinite Pro200)(Tecan);Real-Time System C1000 Touch Thermal Cycler PCR仪(BIORAD);梯度PCR仪(Applied Biosystems);超微量分光光度计(浙江金华益迪医疗设备厂);培英HZQ-F100全温双层振荡培养箱(济南好来宝医疗器材有限公司);FreeZone(Plus)4.5 L冷冻干燥机(赛默飞);3K15台式高速冷冻离心机(Sigma)。
1.2 实验方法
1.2.1 RBPEE的制备及主要成分鉴定
1.2.1.1 RBPEE的制备
根据课题组前期研究[11],用粉碎机将干燥后的蜂花粉粉碎,称取蜂花粉粉末,以料液比1∶15加入70%乙醇混匀,进行摇床振摇提取(240 rpm,37 ℃)结合超声提取(振摇24 h,超声20 min),重复操作2次。将提取液进行抽滤,滤液在4 ℃条件下,8 000 rpm离心10 min,取上清液于圆底烧瓶中进行旋转蒸发(46~50 ℃,0.07 MPa)至浸膏状,收集底物进行冷冻干燥,收集冻干粉备用。
1.2.1.2 RBPEE主要成分鉴定
精确称量10 mg蜂花粉冻干粉,将其溶解于1 mL的70%甲醇溶液中,涡旋2 min后超声5 min,再14 000 rpm离心10 min,取上清液至进样瓶中,用于UPLC-MS分析。
1.2.1.2.1 UPLC条件
UPLC分析在Agilent 1290 Infinity LC仪器上进行,该仪器由四元泵、自动进样器、柱温室和二极管阵列检测器组成。样品在Zorbax SB-C18色谱柱(3.5 μm,100 mm × 2.1 mm内径)上分离。流动相为超声除气后的0.1%甲酸水溶液(A)-甲醇(B),梯度洗脱条件如下:0~3 min:10%(B);3~10 min:10%~65%(B);10~10.5 min:65%~80%(B);10.5~15 min:80%(B)。UV检测波长设定为254 nm。柱温和流速分别设置为20 ℃和0.2 mL/min,进样体积1 μL[11]。
1.2.1.2.2 Q-TOF MS条件
UPLC系统连接到配备Dual ESI电喷雾离子源的Agilent 6530 QTOF质谱仪:毛细管电压在(-)ESI模式下为3.5 kV;雾化器压力为40 psig;干燥气体(氮气)流量为10.0 L/min,温度为325 ℃;OCT 1 RF Vpp为750 V。扫描范围为m/z100~1 500。
1.2.2 细胞培养样品制备
完全培养基:10%胎牛血清+1%青霉素、链霉素双抗+89% DMEM高糖培养基;不完全培养基:1%青霉素、链霉素双抗+99% DMEM高糖培养基;细胞冻存液:55% DMEM高糖培养基+40%胎牛血清+5% DMSO。
使用细胞级DMSO配制蜂花粉以及卡托普利(Captopril)储备液:RBPEE制成100 mg/mL的储备液;卡托普利储备液浓度为1 mmol/L。10 mmol/L的ISO储备液用完全培养液直接溶解制得。临用时,分别用完全培养液稀释上述储备液至所需浓度。
1.2.3 细胞分组及给药
H9c2细胞经种板孵育24 h后,按表1分组情况进行加样:除阴性对照组加完全培养液,阳性对照组加0.1 mmol/L卡托普利,其他组加入对应体积各浓度梯度RBPEE溶液进行培养24 h。培养24 h后加入不完全培养液进行饥饿12 h,最后经PBS清洗后,除阴性对照组加完全培养液,其余各组都加入50 μmol/L的ISO损伤细胞48 h。

表1 细胞分组给药情况Table 1 Cell group administration
1.2.4 心肌细胞骨架染色及表面积测定
将各组给药处理的H9c2心肌细胞根据YF®488标记鬼笔环肽染色说明书进行固定染色。细胞经PBS清洗后用含有4%多聚甲醛溶液冰上固定15 min,PBS清洗后再利用0.5% Trion X-100溶液在室温下透化10 min,继续用PBS清洗,随后用200 μL PBS溶液稀释5 μL YF荧光标记的鬼笔环肽储液配成染液,室温避光孵育30 min进行染色。PBS清洗后在倒置荧光显微镜400倍的视野下进行观察并拍照。每组随机选取4~6个视图,用Oplenic软件对照片中心肌细胞的表面积进行测量,取其平均值。
1.2.5 细胞总蛋白含量、SOD和GSH的测定
细胞总蛋白含量、SOD和GSH测定方法根据测定试剂盒说明书微调后进行操作。即,细胞培养48 h后,胰酶消化细胞并终止,1 000 rpm离心5 min,弃上清,再加入1 mL生理盐水吹打混匀,1 000 rpm离心5 min弃上清,留细胞沉淀,再加入0.3 mL生理盐水,冰水浴下电动研磨,每次15~20 s,间隔30 s,总共研磨4次,不离心根据蛋白定量测定试剂盒、SOD测定试剂盒(WST-1法)和微量还原型GSH测定试剂盒(微板法)说明书加样表直接取样检测。
1.2.6 细胞MDA测定
细胞MDA含量测定方法根据测定试剂盒(微板法)说明书微调后进行操作。消化、清洗、离心后留沉淀加入0.5 mL试剂五提取液悬浮细胞,混匀2 min后冰水浴下电动研磨破碎细胞,每次15~20 s,间隔30 s,总共研磨4次,取0.1 mL破碎后的细胞悬液于1.5 mL离心管中(预先在管盖上刺一个小孔),然后根据说明书加样表进行操作计算。
1.2.7 实时荧光定量PCR
按给药分组情况处理细胞后按照TransZol UP试剂盒对各组细胞的RNA进行提取,并进行RNA浓度的测定。使用HiScript®Ⅱ Q RT SuperMix 试剂盒,根据说明书将所得样品的RNA进行反转录,合成cDNA。以cDNA为模板,按ChamQ Universal SYBR qPCR Master Mix试剂盒说明书配制反应体系,每个样品设3个复孔。从65 ℃到95 ℃,以0.5 ℃/5 s逐渐增温,同时检测荧光信号来获得熔解曲线。反应结束后,根据仪器生成的循环阈值Ct,取重复组别的平均Ct值做数据分析,计算各基因的相对表达量。根据引物设计原则,利用NCBI网页端设计PCR引物(见表2)。

表2 PCR扩增的引物序列Table 2 Primer sequences for PCR amplification
1.2.8 数据分析
所有数据均以平均值±标准误表示。使用GraphPad Prism 8.0软件单因素方差分析对各组样品进行显著性差异分析。当P< 0.05时,表示具有显著性差异;当P< 0.01时,表示差异具有极显著性。
2 结果
2.1 UPLC-ESI-QTOF MS分析RBPEE的主要成分
RBPEE在254 nm处的UV色谱图和负离子模式的总离子流色谱图见图1,初步鉴定了7种主要成分,包括1种糖类、2种核苷类、1种多胺和3种黄酮类化合物,鉴定结果见表3。

表3 RBPEE中的各峰分配情况Table 3 Peak assignments for the analysis of RBPEE

图1 RBPEE在254 nm的UV色谱图(A)和负离子模式的总离子流色谱图(B)Fig.1 UV chromatogram at 254 nm (A) and total ion chromatogram in negative ion mode of RBPEE (B)
峰1的[M-H]-离子的质荷比为195.051 45,分子式为C6H12O7,不饱和度为1,该化合物初步推测为葡萄糖酸[11]。峰2的[M-H]-离子的质荷比为243.062 16,分子式为C9H12N2O,不饱和度为5,通过与标准品对照,该化合物鉴定为尿苷[11];峰3的[M-H]-离子的质荷比为282.084 06,分子式为C10H13N5,不饱和度为7,通过与标准品对照,该化合物鉴定为鸟苷[11]。峰4的[M-H]-离子的质荷比为436.223 02,分子式为C25H31N3O4,不饱和度为12,该化合物初步鉴定为N′,N′′-双(对香豆酰)亚精胺[8]。峰5的[M-H]-离子的质荷比为625.142 37,分子式是C27H30O17,不饱和度为13,该化合物初步鉴定为槲皮素-3-O-(2′′-O-吡喃葡萄糖基)-吡喃葡萄糖苷[8]。峰6和峰7具有相同分子离子,其[M-H]-离子质荷比分别为609.145 92和609.143 18,分子式为C27H30O16,不饱和度都为13,根据先前报道[8],峰6初步鉴定为槲皮素-3-O-(2′′-O-吡喃葡萄糖基)-鼠李糖苷,峰7鉴定为山奈酚-3-O-(2′′-O-吡喃葡萄糖基)-吡喃葡萄糖苷。
2.2 RBPEE对细胞形态学变化、表面积和总蛋白含量的影响
ISO处理48 h后,通过显微(400×)观察,发现阴性对照组细胞形态及生存状态良好,未见异常变化,细胞呈单层簇状,多呈放射状的同心圆排列,收缩有力;模型组心肌细胞呈现显著的病理性形态学变化,细胞核暗淡,间质水肿,细胞肥大,胞间隙明显缩小,排列紊乱。与模型组相比,卡托普利组和RBPEE处理组细胞形态及生存状态明显好转,心肌细胞形态回缩,细胞间隙恢复(见图2)。各组细胞经鬼笔环肽染色后,模型组与阴性对照组相比,细胞明显肥大,细胞骨架的微丝密度增大,细胞形态中梭形占比减少、圆形占比增加,胞间隙明显缩小,分布不均匀且排列紊乱,更易聚集成团。与模型组比较,卡托普利组和RBPEE处理组的细胞体积明显缩小,形态恢复梭形,细胞骨架微丝密度显著降低,细胞间隙增加,排列恢复齐整。

图2 RBPEE对H9c2心肌细胞形态的影响(左:未染色,右:鬼笔环肽染色)Fig.2 Effect of RBPEE on morphology of H9c2 cardiomyocytes (left:no staining,right:phalloidin staining)注:A:阴性对照组;B:模型组;C:阳性对照组;D:低浓度组,E:中浓度组,F:高浓度组;“→”指示细胞失去梭形呈圆形;“○”标注细胞胞间隙明显缩小聚集成团。下同。Note:A:Negative control;B:Model;C:Positive control;D:Low concentration;E:Middle concentration;F:High concentration;“→” indicates a loss of spindle and a round shape;“○” note that the intercellular space is significantly reduced and aggregates.The same below.
细胞骨架染色后的细胞表面积结果如表4所示,模型组相较于阴性对照组的细胞表面积平均增大了40.28%,不同浓度的RBPEE处理后分别降低了24.93%(低浓度组)、26.58%(中浓度组)、29.24%(高浓度组),且都具有显著性差异(P< 0.01,相较于模型组)。

表4 RBPEE对H9c2细胞表面积的影响
RBPEE处理后的各组细胞经过48 h的ISO损伤后,各组细胞总蛋白含量结果如图3所示。模型组的总蛋白含量相较于阴性对照组显著增加(P< 0.01);与模型组相比,低、中、高浓度RBPEE预处理后,总蛋白含量均显著降低(P< 0.01)。

图3 RBPEE处理对心肌细胞总蛋白含量的影响(n = 6)Fig.3 Effect of RBPEE treatment on total protein content in cardiomyocytes (n = 6)注:与阴性对照组相比,** P < 0.01;与模型组相比,## P < 0.01。Note:Compared with negative control,** P < 0.01; Compared with model,## P < 0.01.
综上,RBPEE能够显著降低肥大心肌细胞的表面积和总蛋白含量,对ISO致心肌细胞肥大具有保护作用。
2.3 RBPEE对心肌细胞肥大标志物mRNA表达水平的影响
RBPEE处理后,心肌细胞肥大标志物ANP、BNP和β-MHC的mRNA表达水平如图4所示。在ISO处理的模型组中,ANP、BNP和β-MHC的基因表达水平相较于阴性对照组显著增加(P< 0.01)。与模型组相比,低、中、高浓度RBPEE组ANP和BNP基因表达水平显著降低(P< 0.01);中、高浓度RBPEE组β-MHC基因表达水平显著降低(P<0.01)。综上,RBPEE能够显著降低三种心肌细胞肥大标志物的mRNA表达水平,对ISO致心肌细胞肥大具有保护作用。

图4 RBPEE处理对心肌细胞肥大标志物基因表达的影响(n = 3)Fig.4 Effect of RBPEE treatment on the gene expression of hypertrophy markers in cardiomyocytes (n = 3)注:与阴性对照组相比,** P < 0.01;与模型组相比,## P < 0.01。Note:Compared with negative control,** P < 0.01;Compared with model, ## P < 0.01.
2.4 RBPEE对H9c2心肌细胞中SOD、GSH和MDA的影响
RBPEE处理后各组细胞中SOD活力和GSH、MDA的含量如表5所示。相较于阴性对照组,模型组中SOD活力和GSH含量都显著降低(P< 0.01),MDA含量则显著升高(P< 0.01)。三种浓度RBPEE处理后的SOD活性和GSH含量较模型组显著升高(P< 0.05,P< 0.01);MDA含量在RBPE处理后较模型组均显著降低(P< 0.01)。实验结果表明,给予RBPEE处理后可以降低ISO对H9c2心肌细胞造成的氧化损伤,提高细胞的抗氧化能力。

表5 RBPEE对H9c2细胞中SOD、GSH和MDA的影响Table 5 Effect of RBPEE on SOD,GSH and MDA in H9c2 cells = 6)
2.5 RBPEE对心肌细胞中炎症相关指标mRNA表达的影响
RBPEE处理对心肌细胞白细胞介素2(IL-2)、白细胞介素6(IL-6)和肿瘤坏死因子-α(TNF-α)的mRNA表达水平的影响如图5所示,相较于阴性对照组,模型组上述基因的表达水平均显著增加(P< 0.01);与模型组相比,低、中、高浓度RBPEE组IL-6和TNF-α的基因表达水平显著降低(P< 0.05,P< 0.01);中、高浓度RBPEE组IL-2的基因表达水平显著降低(P< 0.05,P< 0.01)。上述结果表明,给予RBPEE预处理后,可以显著降低ISO对H9c2心肌细胞造成的炎症反应,提高细胞的抗炎能力。
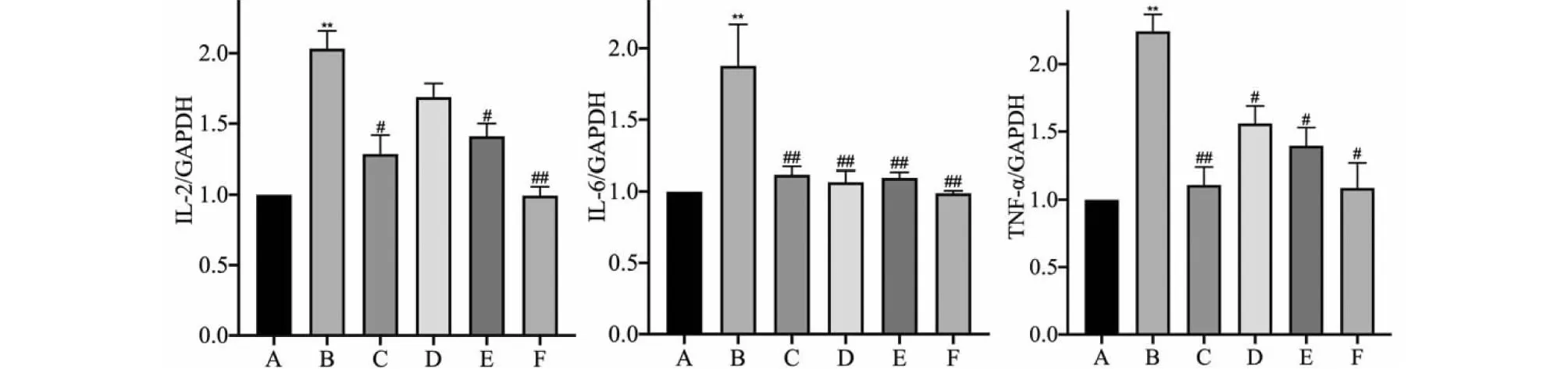
图5 RBPEE处理对心肌细胞炎症相关指标基因表达的影响(n = 3)Fig.5 Effect of RBPEE treatment on the gene expression of inflammation-related factors in cardiomyocytes (n = 3) 注:与阴性对照组相比,** P < 0.01;与模型组相比,# P < 0.05,## P < 0.01。Note:Compared with negative control,** P < 0.01;Compared with model, # P < 0.05,## P < 0.01.
2.6 RBPEE对心肌细胞中凋亡相关指标mRNA表达的影响
在RBPEE处理后,B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶-3(Caspase-3)、半胱氨酸蛋白酶-8(Caspase-8)和半胱氨酸蛋白酶-9(Caspase-9)的mRNA表达水平变化情况如图6所示,模型组中上述基因的表达水平相较于阴性对照组均有显著变化(P< 0.01):除抗凋亡基因Bcl-2的基因表达水平和Bcl-2/Bax的比值显著降低外,其余四个基因的表达水平都显著提高;在低、中、高浓度的RBPEE处理后,Bax的基因表达水平相较于模型组显著降低(P< 0.01),而Bcl-2的基因表达水平以及Bcl-2/Bax的比值相较于模型组显著提高(P< 0.05,P< 0.01);在低、高浓度的RBPEE处理后,Caspase-3的基因表达水平相较于模型组显著降低(P< 0.05);在高浓度的RBPEE处理后,Caspase-8和Caspase-9的基因表达水平相较于模型组显著降低(P< 0.01)。上述结果表明RBPEE可以通过调节细胞凋亡相关基因的表达而降低ISO诱导的H9c2心肌细胞肥大损伤。
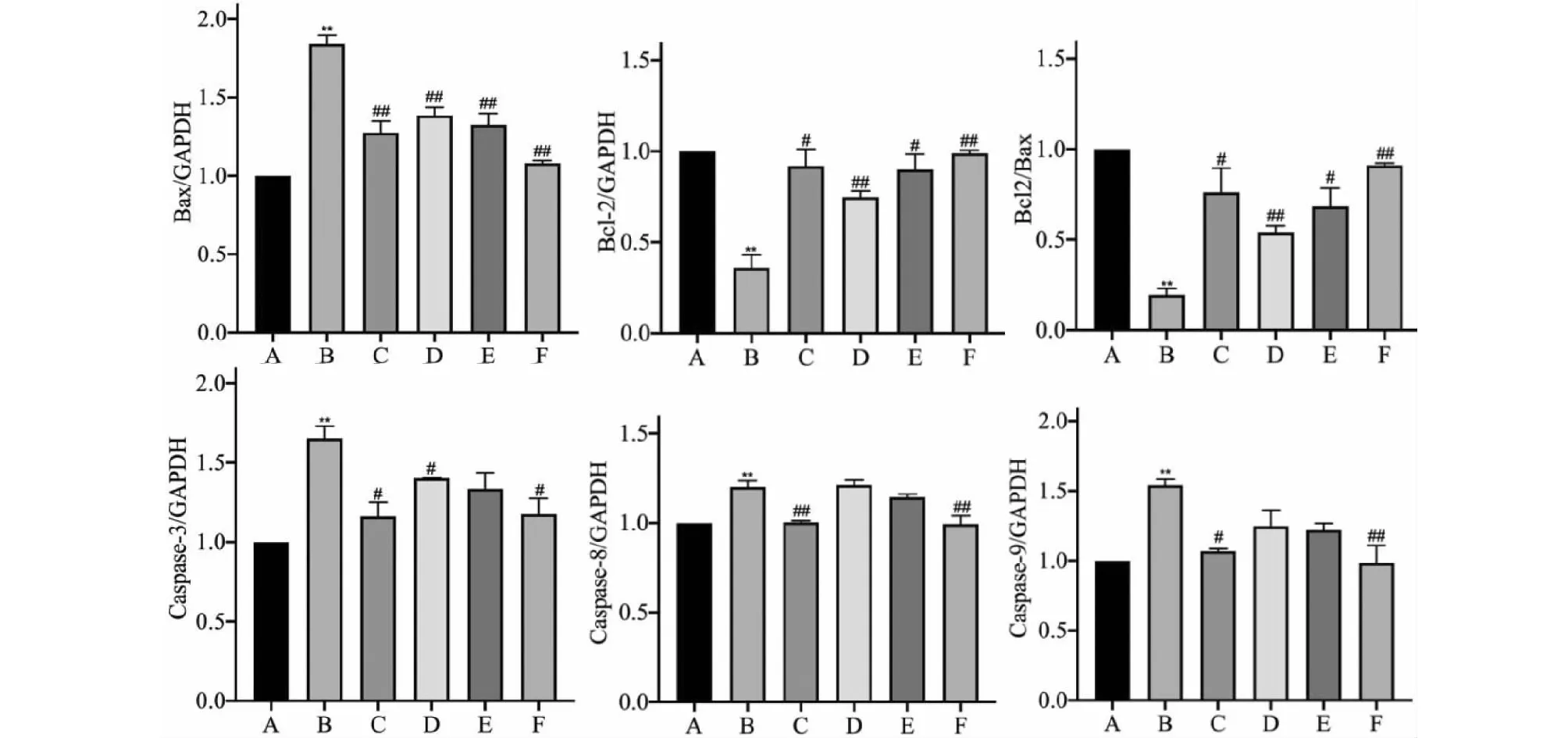
图6 RBPEE处理对心肌细胞凋亡相关指标基因表达的影响(n = 3)Fig.6 Effect of RBPEE treatment on the gene expression of apoptosis-related factors in cardiomyocytes (n = 3)注:与阴性对照组相比,** P < 0.01;与模型组相比,# P < 0.05,## P < 0.01。Note:Compared with negative control,** P < 0.01;Compared with model, # P < 0.05,## P < 0.01.
3 讨论与结论
CH的特征主要有心肌细胞体积增大、蛋白质合成增加、质量变大以及心室壁增厚。ANP、BNP和β-MHC作为CH的分子标记物,它们在CH进程中再表达,由心肌细胞自主产生和释放,积极参与补偿机制,调节心脏功能[5]。在本研究中,心肌细胞表面积明显增大,总蛋白含量显著增加以及三种心肌细胞肥厚性标志物的mRNA表达水平显著提高,表明ISO诱导心肌细胞肥大模型成功。使用RBPEE处理后,细胞表面积和总蛋白含量相较于模型组有显著缩减,三种心肌细胞肥大标志物mRNA的表达水平也有显著降低,表明RBPEE对ISO诱导的心肌细胞肥大具有较好的预防效果。
正常情况下,由于机体可以通过SOD等抗氧化酶类以及GSH、类胡萝卜素以及维生素C等非酶类抗氧化物等物质来及时清除组织氧化代谢产生的过量自由基,从而保证机体内自由基实现动态平衡,维持机体正常运作[10]。氧化应激的损伤途径主要是通过活性氧(ROS)与细胞内的脂质、蛋白质和核酸等生物大分子发生过氧化反应,引起细胞结构损伤与代谢障碍,进而引发各种疾病。当细胞膜受ROS攻击时,膜上磷脂分子中的不饱和脂肪酸氧化生成MDA等脂质过氧化物。因此机体细胞受氧化损伤的程度通过细胞内SOD活力、GSH含量以及MDA含量的变化来反映[11,12]。NF-κB途径被认为是促炎信号传导途径,经氧化应激反应激活的NF-κB可以从细胞质转运到细胞核,从而促进细胞促炎介质的转录,如IL-6和TNF-α等[13]。因此检测促炎症细胞因子的表达量可以判断心肌细胞受炎症反应的影响程度。我们利用ISO诱导的心肌细胞肥大会使细胞中的SOD活力和GSH含量显著降低,MDA含量显著升高,心肌细胞中IL-6、TNF-α和IL-2的mRNA表达水平显著提高,表明心肌细胞肥大伴随着氧化应激和炎症反应的发生。当RBPEE处理后,SOD活力和GSH含量显著增加、MDA含量显著降低、三种炎症反应因子的基因表达水平显著降低,表明RBPEE可以通过抑制氧化应激和炎症反应来预防ISO对心肌细胞的损伤作用。
细胞凋亡的主要途径有外源性途径(死亡受体途径)、内源性线粒体途径和内质网应激途径[14]。在死亡受体途径中,Caspase-8在被死亡诱导信号复合物(DISC)激活后,启动信号级联反应,导致末端效应器Caspase-3或Caspase-7等的自动活化,最终诱发细胞凋亡信号[14]。在线粒体途径中,当线粒体受到外界刺激后,Bcl-2家族中的凋亡促进因子Bax调控线粒体外膜通透性,促使线粒体外膜透化,导致线粒体膜腔隙内的细胞色素C与三磷酸脱氧腺苷(dATP)、凋亡蛋白酶激活因子(APAF1)形成凋亡多聚体复合物,释放至胞浆,招募半胱氨酸蛋白酶9前体(pro-Caspase-9),引起Caspase-9活化,启动信号级联反应,激活下游的Caspase-3,诱导细胞凋亡[14]。Bcl-2是Bcl-2家族中的抗凋亡成员,Bcl-2与Bax的比值是评价心肌细胞凋亡的一个有效指标[11]。在本实验中,通过测定各处理组中Bcl-2、Bax、Caspase-8、Caspase-9和Caspase-3的基因表达水平来判断心肌细胞凋亡情况。实验结果显示ISO诱导心肌细胞肥大损伤伴随着细胞凋亡进程。RBPEE预处理对Caspase-8、Caspase-9、Caspase-3和Bax的基因表达水平具有显著的抑制作用,Bcl-2的基因表达水平和Bcl-2/Bax的比值较模型组显著升高,表明RBPEE对ISO诱导的心肌细胞凋亡具有预防作用。
本实验采用UPLC-QTOF MS对RBPEE的化学成分进行定性分析,初步鉴定了RBPEE中7种主要成分,包括1个糖类(葡萄糖酸)、2个核苷类(尿苷和鸟苷)、1个多胺类(N′,N′′-双(对香豆酰)亚精胺)和3个黄酮二糖苷类化合物(槲皮素-3-O-(2′′-O-吡喃葡萄糖基)-吡喃葡萄糖苷、槲皮素-3-O-(2′′-O-吡喃葡萄糖基)-鼠李糖苷和山奈酚-3-O-(2′′-O-吡喃葡萄糖基)-吡喃葡萄糖苷)。研究表明尿苷和鸟苷都具有抗氧化、抗炎和抗凋亡作用[15-17];N1,N5-双(对香豆酰)亚精胺具有良好的抗氧化性,可以提高细胞中总抗氧化能力,提高细胞中抗氧化酶SOD、CAT和GPx的酶活性,降低脂质氧化水平[18];黄酮二糖苷类化合物的苷元如槲皮素、山奈酚具有抗氧化、抗炎、抗凋亡等药理作用[19,20]。因此,核苷类、多胺类和黄酮类化合物可能是RBPEE发挥抗氧化、抗炎和抗凋亡作用的有效成分。
综上,RBPEE对ISO诱导的心肌细胞肥大具有一定的预防作用,其作用机制可能与降低氧化应激水平、抑制炎症反应和抗凋亡作用密切相关。
