微卫星状态与结直肠癌临床病理特征、外周血T细胞及基因突变的关系
2021-11-03钟国方惠州市中心人民医院肿瘤内科广东惠州516000
钟国方,张 航,袁 霞 (惠州市中心人民医院肿瘤内科,广东惠州 516000)
结直肠癌是消化系统最常见的恶性肿瘤之一,其发病率及病死率近年来呈上升趋势,严重危害人类的健康[1]。研究表明,微卫星(MS)状态与结直肠癌的发展、预后、疗效、遗传等均有相关[2-4]。所有结直肠癌患者均被推荐完善微卫星状态检测[5]。肿瘤的发生、发展机制复杂,影响因素众多,基因突变在结直肠癌的发生、发展中起着重要作用,并一定程度上影响着患者的预后[6]。T 淋巴细胞亚群是人体内主要的细胞免疫系统,是影响结直肠癌患者预后的危险因素[7],但外周血T 淋巴细胞亚群与微卫星状态的关系尚不清楚。本文通过分析微卫星状态与结直肠癌的临床病理特征、外周血T 细胞及基因突变的关系,以期为结直肠癌患者的诊治提供参考。
1 资料和方法
1.1 一般资料
选取2017 年11 月至2020 年11 月在惠州市中心人民医院诊断为结直肠癌并完善卫星状态、外周血T淋巴细胞或基因检测患者180 例,经病理确诊为腺癌,TNM分期为Ⅱ~Ⅳ期,排除其他部位恶性肿瘤。
1.2 方法
微卫星状态采用多重荧光PCR 毛细管电泳法检测,该方法是微卫星状态检测的金标准,灵敏度高,特异性强。检测位点包括6 个单核苷酸重复标志物(NR21、NR24、NR27、BAT25、BAT26 和MONO27)。结果出现2 个或以上的不稳定为微卫星高度不稳定(MSI-H),存在1 个位点为微卫星低度不稳定(MSIL),而无不稳定位点则为微卫星稳定(MSS)[8]。基因突变采用高通量测序方法进行检测,标本类型为石蜡切片或全血,同时检测肿瘤相关突变热点区域的单碱基替换突变和插入缺失突变。采用多重PCR 技术靶向捕获,一次实验同时对92 个扩增子进行高通量测序,目标区域的平均覆盖度不低于1 000倍,检测灵敏度的下限为1%。外周血T 淋巴细胞亚群检测基于抗原抗体特异性反应原理,将人体外周血中表达有CD抗原的细胞固定于单克隆抗体包被玻片上,通过淋洗、染色等操作后,对特异性细胞进行自动计数仪自动计数。Semibio CD系列细胞检测玻片,将特异性抗体事先包被在芯片基板上,样本中表达有该特异性抗原细胞与芯片接触反应后,特异性细胞被分离固定,再通过自动计数仪对固定细胞分析。外周血T 淋巴细胞亚群检测选用化疗前的检测结果。结合患者的临床资料及相关检查结果,根据微卫星状态划分为MSI-H 和MSS/MSI-L 患者,分析不同微卫星状态与临床病理特征、外周血T 淋巴细胞水平及基因突变间的关系。
1.3 统计学处理
采用SPSS 25.0 统计软件进行分析,计数资料以频数或%表示,采用χ2检验。外周血T 淋巴细胞根据受试者工作特征曲线(ROC)判断界值。P<0.05 表示差异有统计学意义。
2 结果
2.1 基线特征
纳入180 例患者中男105 例,女75 例;年龄29~87岁,平均(57.15±11.60)岁;直肠癌64例(35.6%),结肠癌116 例(64.4%),其中左半结肠癌为75 例(64.7%),右半结肠癌为41 例(35.3%);分化类型(检测缺失7 例):高分化1 例(0.6%),中分化134 例(77.4%),低分化38 例(22.0%);TNM 分期:Ⅲ期占42.2%,Ⅱ期占36.7%,Ⅳ期占21.1%;153 例完成肿瘤化疗前外周血T 细胞检测,CD3+、CD4+、CD8+平均值均处于正常参考值范围;180 例完成微卫星状态检测,MSI-H 患者19 例(10.6%),MSS/MSI-L 患者161例(89.4%);159 例完成基因突变状态检测,KRAS 突变率最高,有76 例发生突变,其余分别为PIK3CA(15.0%)、TP53(8.3%)、NRAS(4.4%)、BRAF(3.3%)、ERBB2(2.2%)、EGFR(2.2%)、AKT1(1.7%)、MET(1.1%)。
2.2 结直肠癌患者临床病理特征与微卫星状态的关系
MSI-H 患者<60 岁的比例为89.5%,高于MSS/MSI-L 患者的56.5%(P<0.01)。在结直肠癌中,MSIH 患者肿瘤发病部位在结肠的比例较MSS/MSI-L 患者更高,分别为89.5%和61.5%,差异有统计学意义(P<0.05)。而在结肠癌中,MSI-H 患者更常见于右半结肠(64.7%,11/17),而MSS/MSI-L 患者更常见于左半结肠(69.7%,69/99),差异有统计学意义(P<0.01)。
180 例患者中,173 例有明确的分化类型,7 例无法鉴定分化类型。MSI-H 与MSS/MSI-L 患者均以中高分化居多,但MSI-H患者低分化型的比例明显高于MSS/MSI-L 患者(47.4%vs18.8%),差异有统计学意义(P<0.05)。见表1。

表1 结直肠癌患者临床病理特征与微卫星状态的关系(例)
2.3 结直肠癌患者外周血T 细胞计数与微卫星状态的关系
180 例患者中153 例行肿瘤化疗前外周血T 细胞检测(MSS/MSI-L137 例,MSI-H 16 例)。根据ROC曲线及AUC 算得CD3+、CD4+、CD8+及CD4+/CD8+的最佳界值分别为1 372、766、438 和1.17。MSI-H 患者CD3+≥1 372 个/μL、CD4+≥766 个/μL、CD8+≥438 个/μL的比例明显高于MSS/MSI-L 患者(P<0.05 或0.01),而两组的CD4+/CD8+差异无统计学意义(P>0.05)。见表2。

表2 结直肠癌患者外周血T细胞计数与微卫星状态的关系
2.4 结直肠癌患者的基因突变状态与微卫星状态的关系
180 例患者中159 例行基因突变状态检测(MSS/MSI-L 142 例,MSI-H 17 例)。MSI-H患者发生PIK3CA 突变的比例明显高于MSS/MSI-L 患者(P<0.05)。KRAS 突变76 例,突变率最高,但MSI-H 与MSS/MSI-L 患者比较差异无统计学意义(P>0.05)。见表3。
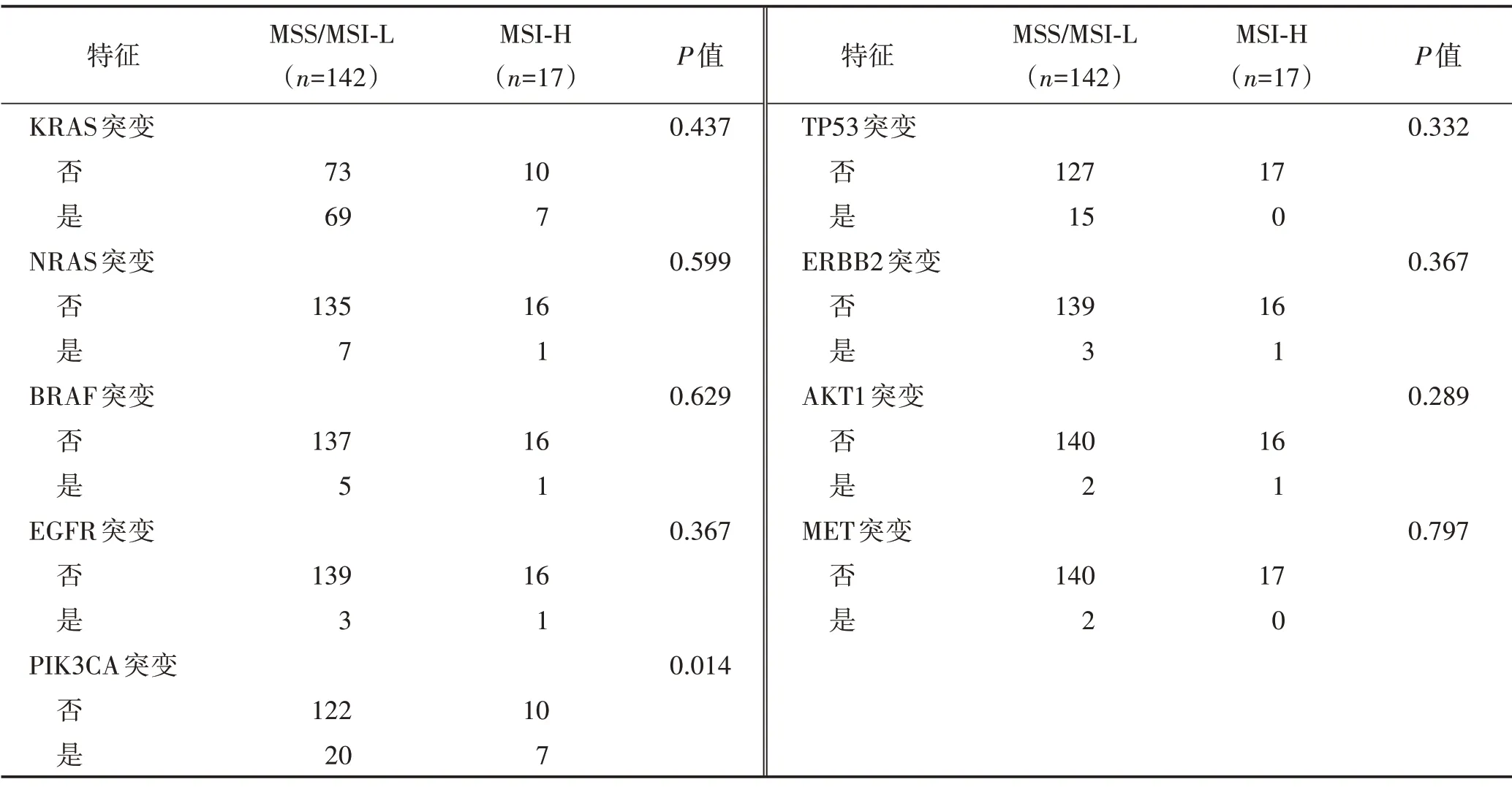
表3 结直肠癌患者的基因突变状态与微卫星状态的关系 (例)
3 讨论
据调查,结直肠癌在全球恶性肿瘤发病中位居第3 位,虽然中国人群的发病率低于西方国家,但近30年来亦呈现快速增长趋势。研究发现,微卫星状态与结直肠癌的发展、预后、疗效、遗传等相关,且具有较为特殊的临床病理特征[2-4]。在微卫星状态的检测中,MSI-H 比例为7%~15%[5,9]。结肠癌中的MSI 表型是良好的预后因素,在Ⅱ期患者中表现更为明显。这种存活优势似与MSI肿瘤浸润淋巴细胞有关,提示可能存在更有效的抗肿瘤免疫反应[10]。本研究中MSI-H比例为10.6%,与上述文献报道相似。在与临床病理特征的关系分析中发现,MSI-H 结直肠癌患者的年龄<60岁比例显著高于MSS/MSI-L患者,且其发病部位多集中在右半结肠,而MSS/MSI-L 患者则以左半结肠为主。造成此差异的原因可能是由于患者DNA 错配修复状态不足。右半结肠癌通常为黏液性,被肿瘤浸润性淋巴细胞密集浸润,并具有激活的MAPK 信号,可能由癌前病变发展而来。癌前病变是由与细胞特异性相关的通路驱动的,如对DNA 修复缺陷和致癌应激的耐受性通路[11]。而微卫星不稳定正是由DNA 错配修复系统缺陷引起的[12]。因此MSI-H 可能参与了右半结肠癌的发生过程。在分化程度方面,MSI-H 患者在低分化的比例较MSS/MSI-L 患者明显升高。在TNM 分期上,MSI-H 患者的分期更早,国内外研究证实了此结论[13-14],但在本研究中差异无统计学意义(P>0.05),可能与病例样本量不大有关。
细胞免疫与肿瘤的发生、发展密切相关,而T 淋巴细胞亚群是人体内细胞免疫最主要的执行者。CD3+T 细胞的数量代表了机体总的细胞免疫状态;CD4+T 细胞是辅助性T 细胞,参与细胞因子的分泌,辅助其他免疫细胞从而起到调节免疫平衡作用;CD8+T细胞是抑制性/细胞毒性T细胞,在抗癌免疫中起着核心作用;CD4+/CD8+比值的动态平衡对维持机体细胞免疫系统的稳定起到重要作用,当CD4+/CD8+比值降低,则患者的免疫功能降低,有利于肿瘤的增殖。本研究发现,MSI-H 患者的CD3+、CD4+、CD8+及CD4+/CD8+T 水平均高于MSS/MSI-L 患者,其中CD3+、CD4+、CD8+T细胞水平的差异有统计学意义(P<0.05 或0.01)。MSI-H 患者CD3+、CD4+、CD8+细胞相比MSS/MSI-L 患者明显升高,提示MSI-H 患者的免疫功能相对更活跃。有研究发现,与MSS 相比,MSIH 结直肠癌患者具有更高的肿瘤浸润免疫细胞组成,MSI-H 患者辅助性T细胞明显升高,CD8+T细胞和活化记忆CD4+T 细胞有升高的趋势[15],这与本研究外周血T 细胞亚群分布存在一定的相似性。Chirica等[14]发现,相对于MSS 患者,从MSI-H 患者肿瘤浸润淋巴细胞中分离出的CD4+T细胞的百分比显著降低,CD8+T细胞的百分比则显著升高。而CD8+T细胞的浸润部分是由MSI 引起的[16]。肿瘤浸润淋巴细胞与外周血T 细胞可能存在一定的差异性,仍需更多的研究,并可进一步探究其与微卫星状态的关系。近年来有研究通过免疫评分评估肿瘤微环境的免疫状态,但需要通过肿瘤浸润淋巴细胞进行评估。而外周血T细胞亚群检测更方便,并可反复进行多次检测。因此如何更好地应用外周血T 细胞水平反映肿瘤免疫微环境及指导临床的诊治是我们今后研究的方向。
不同微卫星状态的基因突变比例存在一定差异,本研究中,MSI-H 结直肠癌患者PIK3CA 突变率显著高于MSS/MSI-L 患者(P<0.05)。PIK3CA 是结直肠癌中最常见的突变基因之一,在外显子9和20的解旋酶和激酶结构域中分别约80%的突变热点。研究发现,MSI 与外显子9 突变呈负相关,与外显子20 突变呈正相关[17],但PIK3CA 突变与结直肠癌患者的生存无显著相关[18]。结肠癌中的MSI 表型是良好的预后因素,PIK3CA 基因在MSI 患者中突变比例升高能否影响患者的预后仍需进一步探讨。本研究中KRAS突变率最高,但MSI-H 与MSS/MSI-L 患者比较差异无统计学意义(P>0.05)。BRAF V600E 突变是MSIH 转移性结直肠癌患者的不良预后因素[4]。对于Ⅲ期且行术后辅助化疗的结肠癌患者,BRAF 或KRAS 突变与MSS 患者的预后相关,其复发与生存时间更短[19]。但在本研究中,BRAF V600E 突变MSI-H 与MSS/MSI-L 患者比较差异无统计学意义(P>0.05),与Lin等[20]研究不一致,或与本研究样本量较少有关。
综述所述,结直肠癌患者不同微卫星状态的临床病理特征、外周血T 淋巴细胞亚群、基因突变状态都存在一定的差异性。这些差异性对不同微卫星状态患者的预后可能存在一定的影响。MSI-H 患者治疗前的外周血T细胞水平相对MSS/MSI-L患者更高,对于治疗后T 细胞水平的变化情况仍需进一步追踪。同时,应用外周血T 细胞水平反映肿瘤免疫微环境及指导临床的诊治、疗效与预后判断仍需进一步研究。
