丙泊酚对小胶质细胞焦亡的影响及其潜在机制
2021-11-03戴中亮张洪研高文莉宋意锋邢燕梅暨南大学第二临床医学院南方科技大学第一附属医院深圳市人民医院麻醉科广东深圳518020
戴中亮,田 迪,张洪研,高文莉,林 苗,宋意锋,田 雅,邢燕梅(暨南大学第二临床医学院,南方科技大学第一附属医院,深圳市人民医院麻醉科,广东深圳 518020)
细胞焦亡是近年来发现并证实的一种新的程序性细胞死亡方式,内源性和外源性刺激信号通过不同途径作用于炎性小体而激活caspase-1,介导细胞渗透性肿胀破裂,形成细胞膜小孔,胞内物质(如乳酸脱氢酶等)流出,IL-1β、IL-18前体裂解并诱导其他炎性因子、黏附分子等的合成和释放,放大局部和全身炎症反应是细胞焦亡发生的主要机制[1-3]。丙泊酚(propofol,BBF)作为临床上应用最为广泛的麻醉药物之一,对机体的影响是复杂多样的。有研究已经证明BBF 可以介导巨噬细胞通过NOD 样受体家族核苷酸结合寡聚化结构域样受体3(NOD-like receptor family,pyrin domain containing 3,NLRP3)炎症小体激活发生胱天蛋白酶-1(caspase1)依赖的炎症性死亡,即焦亡[4]。
麻醉过程中的脑保护是近几年麻醉专业研究的热门问题。小胶质细胞作为神经系统的巨噬细胞,是人们研究脑保护和神经系统炎症的重点研究对象。线粒体产生的活性氧(ROS)[5-8]和线粒体自噬[9-11]和NLRP3 炎症小体的激活密切相关。因此本研究探讨BBF暴露对小胶质细胞ROS、线粒体自噬和焦亡的影响,旨在为BBF麻醉过程中的脑保护提供理论依据。
1 材料和方法
1.1 细胞系和药物
小鼠小胶质细胞BV2 购自中国科学院上海细胞生物学研究所细胞库,产品货号0356,以体积分数为10%的胎牛血清DMEM 培养基常规培养。BBF 购自Sigma生物技术有限公司,批次D126608。
1.2 实验仪器
荧光倒置显微镜(德国Leica),生物安全柜(苏州市金净净化设备科技有限公司),低温离心机(济南云腾医疗器械有限公司)。
1.3 实验方法
1.3.1 分组给药 实验分为对照组和BBF 组两大组,对照组在BBF 给药的同时更换空白培养基,BBF组用250 μmol/L的BBF暴露3 h,每组6个重复样本。
1.3.2 线粒体膜电位(MMP)的检测 MMP 检测试剂盒(JC-1)购自碧云天生物技术有限公司,产品编号为C2006。BV2细胞BBF暴露以后根据试剂盒提示,JC-1工作液37 ℃避光孵育20 min以后收集样本进行检测。阳性对照组即CCCP组,在JC-1工作液处理之前以10 μmol/L(DMEM 培养基稀释)CCCP 处理细胞40 min。在荧光倒置显微镜下摄片,用Image J 统计荧光强度。
1.3.3 线粒体活性氧(mito-ROS)的检测 MitoSOX购自Invitrogen 公司,货号M36008。BV2 细胞BBF暴露以后根据说明书提示,MitoSOX 染料用HBSS 缓冲液稀释至5 μmol/L,37 ℃避光孵育10 min 以后收集样本进行检测。在荧光倒置显微镜下摄片,用Image J统计荧光强度。
1.3.4 线粒体呼吸链复合物I酶活性的检测 Complex I Enzyme Activity Microplate Assay 试剂盒购自Abcam 公司,货号ab109720。BV2 细胞BBF 暴露以后根据试剂盒步骤提示处理样本,实验操作结束以后用Dipstick扫描仪检测信号强度。
1.3.5 免疫印迹试验 Western bloting 检 测LC3B(abcam,ab192890)、p62(abcam,ab109012)、COX4I1(abcam,ab33985)、cathepsin B(abcam,ab214428)、NLRP3(CST,#15101)、ASC(CST,#67824)、caspase1(abcam,ab179515)、GSDMD(abcam,ab 209845)、IL-1β(abcam,ab234437)和GAPDH(abcam,ab8245)的表达。BV2 细胞BBF 暴露以后,收集细胞蛋白备用。沉淀蛋白用BCA 试剂盒(酶标仪562 nm)进行定量。经SDS-PAGE 电泳分离,转膜,5% BSA 封闭,一抗(Cytochrome C 1∶5 000;其余一抗1∶1 000)4 ℃孵育过夜(12~14 h),HRP 标记的二抗(GAPDH 用山羊抗小鼠IgM 1∶5 000;其余蛋白用山羊抗兔IgG 1∶5 000)室温1 h孵育,化学凝胶成像仪检测成像,最后Image J统计信号强度。
1.4 统计学处理
应用SPSS 20.0 统计软件进行分析,采用单因素方差分析,如方差齐性选用LSD 分析,如方差不齐选用Dunnett’s T3分析。P<0.05为差异有统计学意义。
2 结果
2.1 BBF暴露介导BV2细胞线粒体损伤
MMP 检测结果显示,BBF 处理后的BV2 细胞MMP 明显下降,GFP 荧光强度明显增加(P<0.01),RFP 荧光强度明显降低(P<0.01),见图1。Mito-ROS结果显示,BBF 处理后的BV2 细胞Mito-ROS 生成显著增加(P<0.01),见图2。线粒体ComplexI酶活性检测结果显示,BBF 处理后的BV2 细胞ComplexI酶活性受到显著抑制(P<0.01),见图3。

图1 BBF暴露降低BV2细胞的MMP
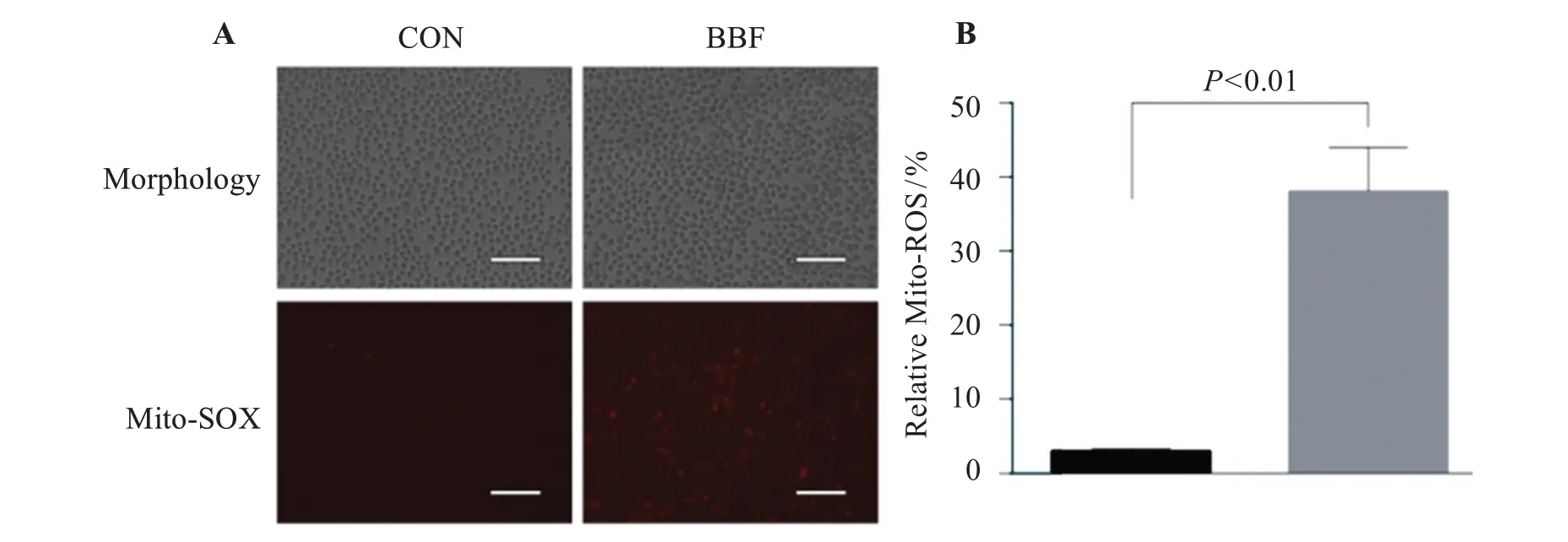
图2 BBF暴露促进BV2细胞Mito-ROS的生成

图3 BBF暴露降低BV2细胞的线粒体复合物I的酶活性(n=6)
2.2 BBF暴露抑制BV2细胞线粒体自噬
免疫印迹结果显示,BBF 处理以后BV2 细胞的蛋白p62(P<0.01)和COX4I1(P<0.05)的表达明显增加,LC3BⅡ/I的比值明显降低(P<0.05),Cathepsin B重链的表达明显增加(P<0.01),Cathepsin B轻链的表达明显减少(P<0.05),见图4。
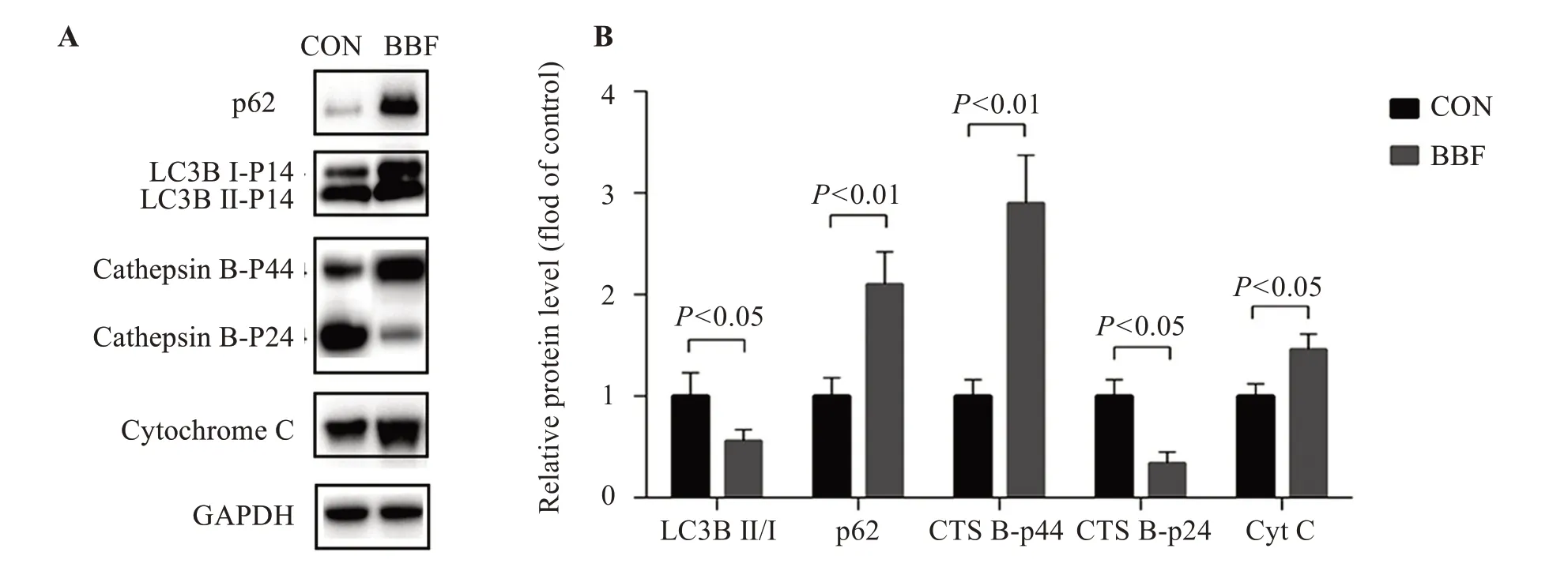
图4 BBF暴露抑制BV2细胞的线粒体自噬(n=6)
2.3 BBF暴露介导BV2细胞焦亡
免疫印迹结果显示,BBF 处理以后BV2 细胞的蛋白NLRP3(P<0.01)和ASC(P<0.05)的表达显著增加,caspase1 和GSDMD 剪切带的表达显著增加(P<0.01),白细胞介素-1β(interleukin-1,IL-1β)的剪切(P<0.05)和分泌(P<0.01)均显著增加。见图5。
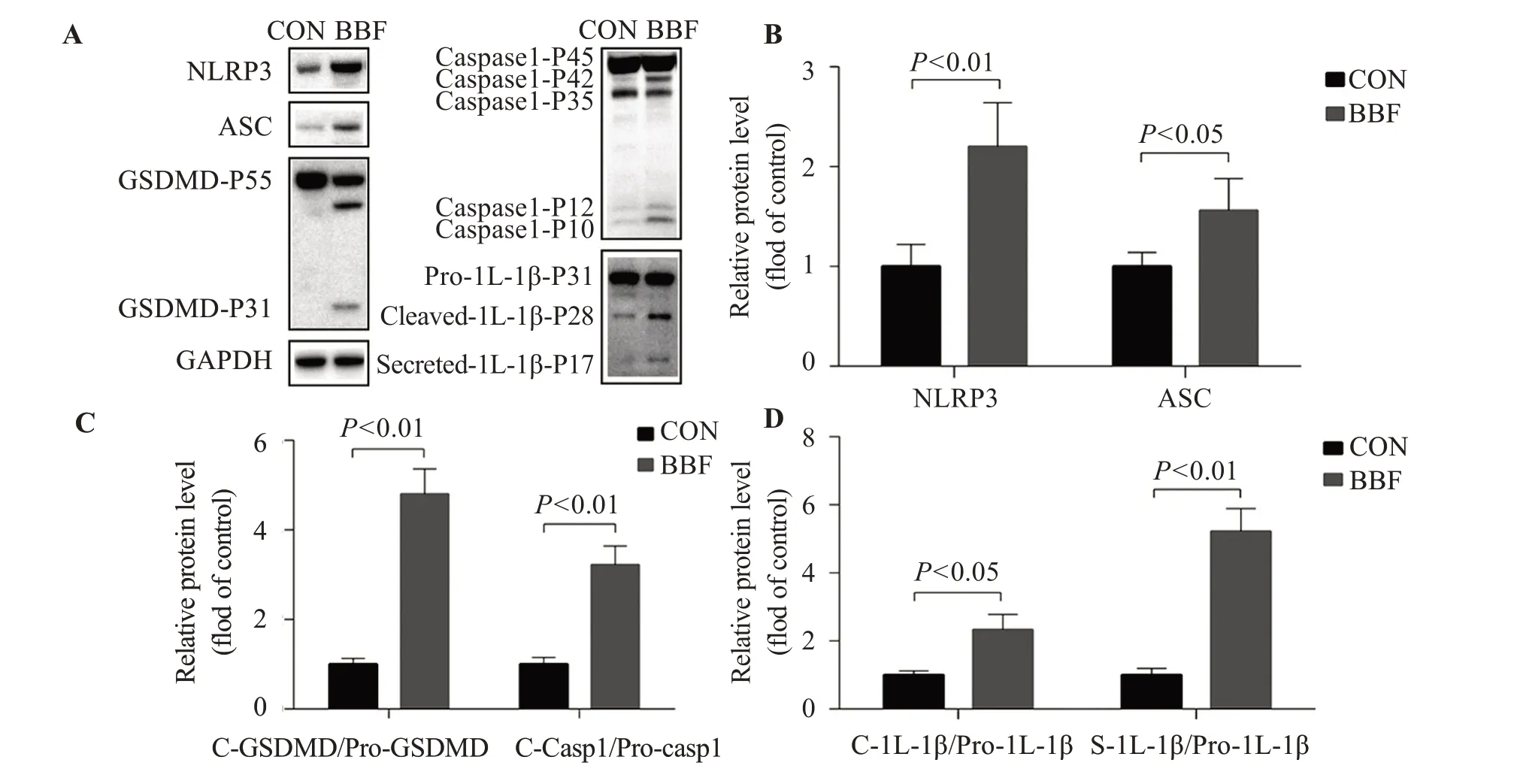
图5 BBF暴露介导BV2细胞通过NLRP3/ASC炎症小体激活发生caspase1依赖的焦亡(n=6)
3 讨论
线粒体在细胞的稳态中起着非常关键的作用,能够为细胞的正常活动提供能量,对细胞的寿命起着决定性的作用[12]。众所周知,自噬是消除受损或多余的线粒体的主要机制,称为线粒体自噬[13]。而自噬通量障碍被认为是线粒体功能损伤,或者线粒体质量差的主要贡献者之一。而自噬通量障碍的两个关键因素是自噬小体的形成和物质的转运[14-16]。因此本研究检测了线粒体损伤相关的指标(包括MMP、mito-ROS、ComplexI酶活性)、线粒体自噬相关的指标(包括自噬标志蛋白LC3B、SQSTM1/p62、COX4I1)以及自噬过程中与溶媒体功能相关的酶。
本研究结果显示,250 μmol/L的BBF处理可以导致BV2 细胞MMP 下降(P<0.01),ComplexI酶活性下降(P<0.01),mito-ROS 显著增加(P<0.01),线粒体功能受到损伤;同时,LC3B Ⅱ/I 的比值明显下降,COX4I1 和自噬底物蛋白p62 的表达明显增加,提示BBF 暴露导致线粒体自噬流阻滞。Cathepsin B 是自噬降解途径中研究最广泛的一种酶,与溶酶体降解功能息息相关[17-18]。BBF暴露后Cathepsin B-p44的显著增加和Cathepsin B-p24的显著减少,提示溶酶体的降解功能明显受到抑制。上面结果共同证明BBF 可以抑制线粒体自噬。
线粒体自噬可以减少线粒体氧化应激引起的细胞应激[19]。自噬作为真核生物细胞遭遇各种应激压力时发生的一种基本应答方式,参与细胞的多种生命活动,使细胞在各种应激条件下维持一种动态平衡状态。BBF暴露使得小胶质细胞的自噬受到抑制,损伤或多余的细胞器清除障碍,毒性物质蓄积,细胞的正常生理活动受到影响,必然会衍生出一系列的病理情况出现,例如炎症小体的异常激活。NLRP3炎症小体是生物体内防御病原微生物的固有免疫防御系统的重要组成部分[20]。NLRP3炎症小体通过激活caspase-1,从而促进IL-1β 和白细胞介素-18(interleukin-18,IL-18)等促炎细胞因子的成熟和分泌,继而介导炎症的发生[21]。自噬能够负向或正向调控NLRP3 炎症小体的激活;同时NLRP3 炎症小体也会逆向影响自噬的作用。ROS主要来源于线粒体[22],当线粒体内膜上的电子传递链被破坏时,ROS 会在细胞内积累,当达到一定水平时会产生毒性,是NLRP3 炎性小体激活过程中重要的一环,并且起着正向促进作用[23]。
有研究证明BBF可以促进巨噬细胞通过NLRP3/ASC 途径发生caspase1依赖的焦亡[24-26]。因此本研究对BBF 暴露后BV2 细胞的焦亡情况进行了检测,以期能够在小胶质细胞上得到进一步的验证。结果证明BBF 暴露后,BV2 细胞确实通过NLRP3/ASC 途径发生焦亡,caspase1和GSDMD的活性剪切增加(均P<0.01),IL-1β的剪切和分泌均增加(P<0.05)。
本研究结结果同时证明BBF 可以抑制线粒体自噬,损伤线粒体功能,促进ROS 生成,而自噬和ROS均是与NLRP3炎症小体激活密切相关的因素,而NLRP3 炎症小体激活又证明可以活性剪切caspase1,促进焦亡终端标志GSDMD和IL-1β的剪切。
通过本研究,我们初步得出以下结论:BBF 可以通过抑制线粒体自噬,导致受伤或者多余的线粒体清除障碍,BV2 细胞线粒体整体功能受损,ROS 生成增加,NLRP3/ASC 炎症小体激活,caspase1 活性剪切增加,其下游的GSDMD 和IL-1β 活性剪切增加,活性GSDMD 在细胞膜打孔,细胞膜结构受损,大量剪切的IL-1β分泌到细胞外,形成炎性环境,BV2细胞肿胀破裂发生炎症性死亡。同时细胞的这种死亡方式会逆向影响线粒体自噬,形成恶性循环。当然BBF 对自噬和焦亡的调节的具体过程还需要进一步确认,这是目前本研究存在的缺陷,有待在以后的研究中加以修正。
