利用高通量测序技术分析猪抗体库的组成特征
2021-11-02吉春苗王斌覃盼黄耀伟
吉春苗,王斌,覃盼,黄耀伟*
(1.浙江大学动物科学学院动物预防医学研究所,杭州 310058;2.岭南现代农业科学与技术广东省实验室肇庆分中心,广东肇庆 526238)
宿主适应性免疫系统通过激活B淋巴细胞产生不同种类的抗体,从而保护机体免受病原侵害。B细胞受体(B cell receptor,BCR)是B淋巴细胞表面识别抗原的一种膜表面免疫球蛋白(immunoglobulin,Ig),具有抗原结合特异性。BCR 由2 条重链(IgH)和2 条轻链(IgL)组成,每条链均包含1 个可变区(variable region,V区)和1个恒定区(constant region,C区)。其中,可变区由3个互补决定区(complementarity determining region, CDR)组成,CDR 的氨基酸组成和排列顺序呈现高度多样性,尤其是重链CDR3(heavy chain CDR3,HCDR3)区域[1]。机体抗体库具有丰富的多样性,产生原因主要包括以下几方面。1)BCR 编码基因具有多样性,例如:猪BCR重链V(variable)基因有15 种,D(diversity)基因有4种,J(joining)基因有5种[2]。2)B淋巴细胞成熟过程中V、D、J 基因发生重排。3)V、D、J 基因在重排过程中因末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase, TdT)的作用导致连接处发生不准确的连接、核苷酸的插入或缺失。4)抗体重链、轻链配对的多样性。5)体细胞高频突变(somatic hypermutation, SHM),即B 细胞受抗原刺激后,已重排好的可变区基因突变频率升高,以提高对抗原的亲和力[3]。
早期,传统的分子克隆技术配合Sanger测序让人们对猪抗体库多样性有了初步认识,研究发现免疫前猪抗体库V基因使用呈现选择性,4个IGHV基因使用率接近80%[2,4]。但是,由于传统测序方法通量较低,相对于庞大的抗体库来说所获得的信息极为有限。近年来,得益于高通量测序技术的发展,使得全面了解如此多样的抗体库成为可能。目前,高通量测序技术已被广泛应用于研究健康个体以及疫苗免疫或疾病状态机体抗体库的特征[5-8],为充分认识机体对疾病或疫苗的抗体反应提供了有效信息。
虽然抗体库高通量测序技术在人、鼠及其他物种中被广泛使用[9-11],但对正常猪以及病毒感染状态下猪抗体库的全貌却研究甚少。猪既是一种重要的经济动物,也是研究抗体库发育的理想模型。与人类不同的是,猪绒毛膜胎盘可以阻断母体免疫球蛋白以及其他蛋白向胎儿转移,使得在无母亲被动影响状态下研究新生仔猪抗体库的发育成为可能。且猪IgH 只包含1 个高度保守的V 基因片段家族(VH3)[12],这为研究抗体库提供了一个简单方便的体系。因此,建立适用于猪抗体库高通量测序的方法十分必要且重要。本研究拟建立猪抗体库高通量测序方法,并应用此方法分析健康猪在正常生理状态下抗体库的组成特征,以期为今后进一步深入研究猪抗体库的发育以及病理状态下猪抗体库的动态变化提供参考。
1 材料与方法
1.1 试验材料
3 周龄健康仔猪4 只,品种为长白猪,为同一只母猪同胎所生,由广东温氏集团研究院提供。猪淋巴细胞分离试剂盒购自深圳市达科为生物技术股份有限公司;RNA 小提试剂盒(RNeasy Mini Kit)、DNA凝胶回收试剂盒(QIAquick Gel Extraction Kit)均购自德国Qiagen 公司;cDNA 合成试剂盒(RevertAid H Minus First Strand cDNA Synthesis Kit)购自美国赛默飞世尔科技有限公司;DNA 聚合酶(Platinum@TaqDNA Polymerase High Fidelity)购自美国Invitrogen 公司;高通量测序建库试剂盒(TruSeq Sample Preparation Kit)购自美国Illumina公司。
1.2 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离
分别采集4 只3 周龄健康仔猪的静脉血液样本,通过猪淋巴细胞分离试剂盒分离外周血单个核细胞(PBMC),步骤大致如下:先将10 mL新鲜抗凝全血用等体积磷酸盐缓冲液(phosphate buffer saline,PBS)稀释,然后将稀释后的血样平铺到淋巴细胞分离液面上方,在室温条件下,以700×g离心20 min。离心后,管底是红细胞,中间层是分离液,最上层是血浆层,血浆层与分离液层之间有一层白膜,即单个核细胞层。小心吸取白膜层到新的离心管中,用PBS 清洗2 遍,在室温条件下,以250×g离心10 min。纯化的PBMC用于RNA抽提。
1.3 文库构建
文库构建包括RNA 提取、cDNA 合成和聚合酶链反应(polymerase chain reaction, PCR)扩增(图1A)。首先,每个样本取1×107PBMC并按照RNA提取试剂盒说明书提取总RNA,通过Qubit 荧光定量仪(美国赛默飞世尔科技有限公司)测定RNA浓度。随后,按照cDNA 合成试剂盒说明书分别取1 μg 高纯度的RNA反转录成cDNA。最后以合成的cDNA为模板,通过多重PCR 以针对猪IgH 可变区V 基因的上游引物和针对恒定区C基因的下游引物扩增猪IgH 文库(图1B),引物序列见表1。反应体系:2 μL反转录混合物,5 μL 10×高保真PCR缓冲液,2 μL 50 mmol/L MgSO4,1 μL 10 mmol/L dNTP混合物,上、下游引物(10 μmol/L)各1 μL,0.2 μL 5 IU/μL Platinum@TaqDNA高保真聚合酶,加双蒸水至50 μL。反应条件:94 ℃预变性2 min;94 ℃变性15 s,58 ℃退火30 s ,68 ℃延伸1 min,共扩增35 个循环;最终保持在4 ℃。扩增产物经DNA凝胶回收试剂盒纯化后,通过Qubit荧光定量仪测定浓度,最终按照高通量测序建库试剂盒说明书分别连接接头序列并富集,经Agilent 2100生物芯片分析系统鉴定建库合格后,由美国Illumina-Miseq 2×250双端测序平台测序。
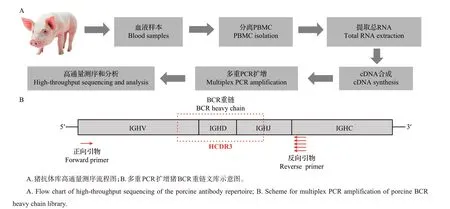
图1 猪抗体库高通量测序方法Fig.1 High-throughput sequencing method for the porcine antibody repertoire
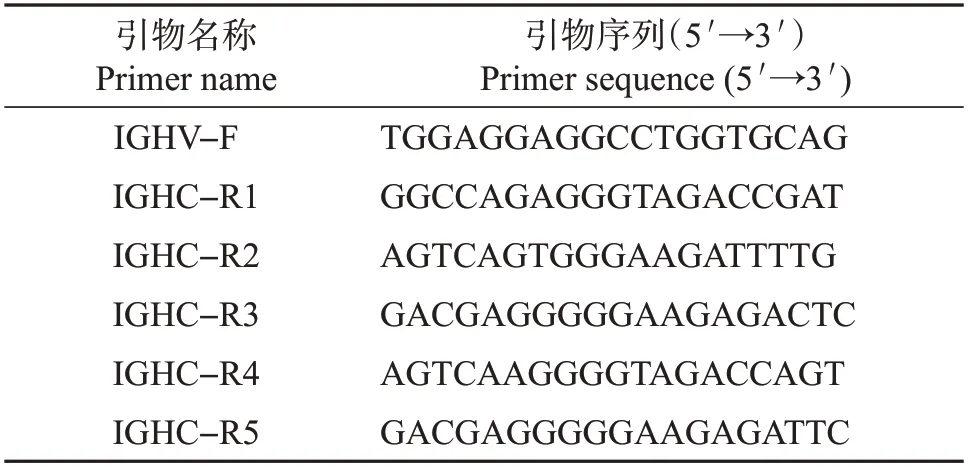
表1 多重PCR扩增引物Table 1 Primers used for multiplex PCR amplification
1.4 测序序列分析
测序原始数据通过FastQC(http://www.bioinfor matics.babraham.ac.uk/projects/fastqc/)进行质量检测,过滤低质量的数据(错误率大于1%),去除测序引物、接头序列后,通过FLASH软件对双端测序序列进行拼接,拼接后每条序列的平均长度为400 bp。通过IMGT/HighV-QUEST(http://www. imgt. org/HighVQUEST/)[13]和IgBLAST(https://www.ncbi.nlm.nih.gov/igblast/)[14]将所有过滤后的拼接序列和国际免疫遗传学数据库(IMGT)中猪的IGHV、IGHD、IGHJ参考基因进行比对。HCDR3序列同样根据IMGT的定义进行鉴定识别,基因使用频率用平均值±标准误表示。
2 结果与分析
2.1 猪抗体库高通量测序平台的建立
为扩增得到猪免疫球蛋白重链可变区的序列,本研究通过序列比对,设计了1条针对猪BCR重链可变区V基因的正向通用引物和5条针对恒定区C基因的反向引物(图1 和表1)。本研究以4 只健康的3周龄仔猪作为试验对象,分别采集其血液样本,以外周血单个核细胞抽提的总RNA 为模板合成cDNA,再以cDNA 为模板通过多重PCR 扩增得到每个样品的BCR 重链文库,最终通过Illumina-Miseq 2×250双端测序平台对BCR重链可变区进行测序,通过生物信息分析全面了解猪抗体库的组成(图1)。结果显示:对原始测序数据进行过滤、拼接和比对后,每个样本最终获得的有效序列数均大于120 000 条(表2),是原先低通量测序数量的1 000倍,只有被识别为猪BCR重链序列并能成功翻译成蛋白的高质量序列才用于进一步分析。
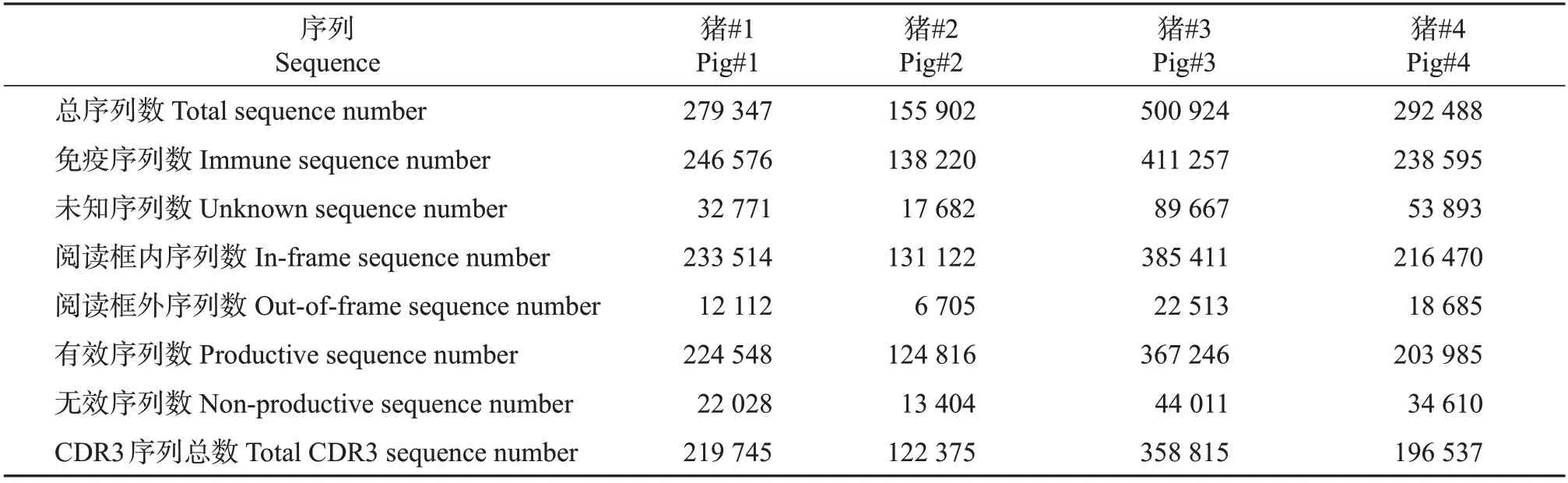
表2 测序序列比对结果汇总Table 2 Summary of sequencing reads alignment
2.2 猪抗体库V、D、J 基因的使用情况
参照国际免疫遗传学数据库(IMGT)的现有数据,猪有15 个IGHV、4 个IGHD 和5 个IGHJ 基因片段。将每条高质量测序序列与数据库参考序列比对,结果(图2)发现:在15个IGHV基因中,4只仔猪最常用的基因是IGHV1-4和IGHV1S2,其次是IGHV1-15和IGHV1-14。除此之外,IGHV1-6、IGHV1-8、IGHV1-10和IGHV1S5的使用频率也均大于5%。以上8 种IGHV 基因使用频率占总序列的80% 以上,而IGHV1-2、IGHV1-5、IGHV1S6、IGHV1S7和IGHV1S8的使用频率极低,均小于1%。在4 个IGHD 基因中,IGHD1和IGHD2是使用最为频繁的2种基因,两者使用频率之和在95%以上,而IGHD3和IGHD4的使用频率极低(图3)。在5 个IGHJ 基因中,仔猪仅使用IGHJ5(图4)。以上结果表明猪选择性偏好使用少数几种特定的IGHV、IGHD、IGHJ基因。
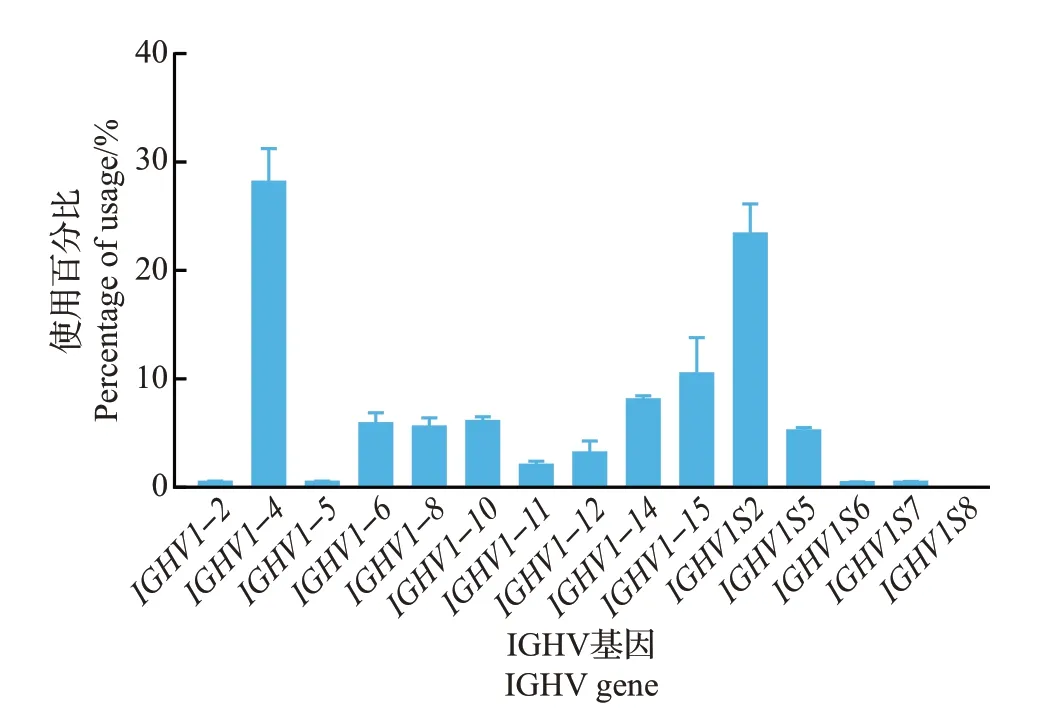
图2 猪抗体库IGHV基因使用情况Fig.2 Usage of IGHV gene in the porcine antibody repertoire
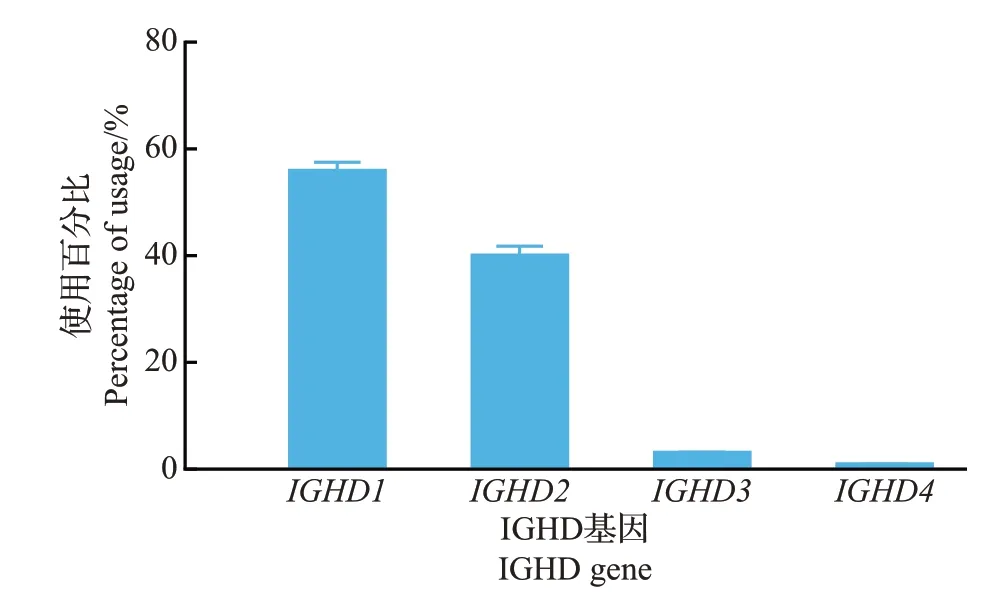
图3 猪抗体库IGHD基因使用情况Fig.3 Usage of IGHD gene in the porcine antibody repertoire
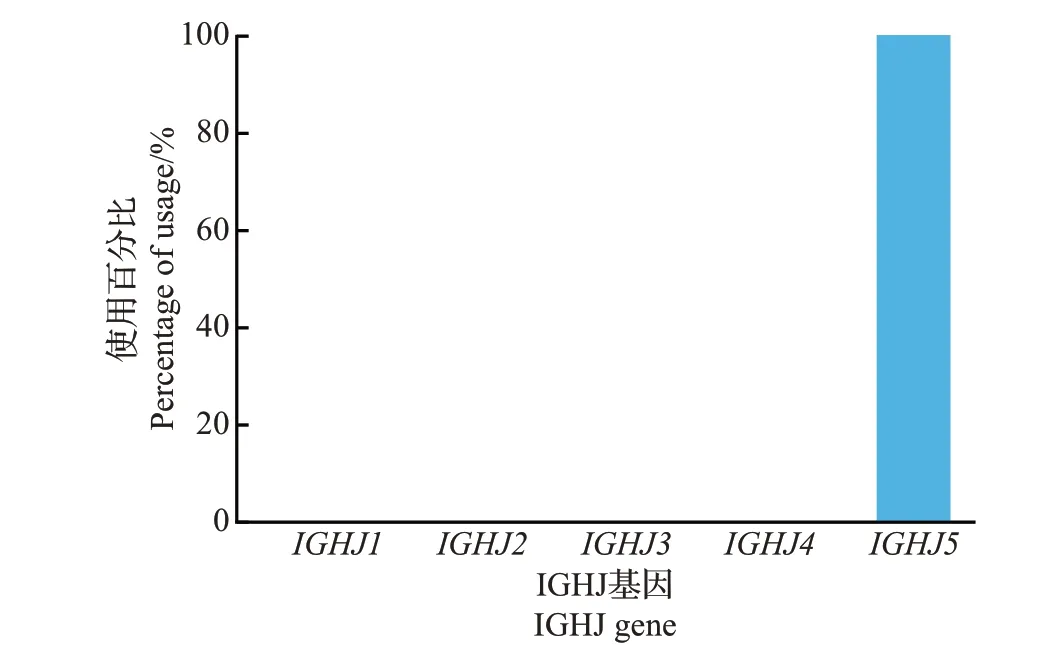
图4 猪抗体库IGHJ基因使用情况Fig.4 Usage of IGHJ gene in the porcine antibody repertoire
2.3 猪抗体库HCDR3 的长度分布
HCDR3 作为变异性最高的区域,决定了抗体结合抗原的亲和性和特异性。测序数据显示,4 只健康仔猪HCDR3 序列的总体数量存在差异(表2),并发现不同个体间HCDR3 氨基酸序列相似性较低,表明机体抗体库存在丰富的多样性。HCDR3 的长度分布也是反映抗体库多样性的指标之一,进一步对4 只仔猪不同长度(1~30 个氨基酸)的HCDR3 分布情况进行统计分析,结果(图5)显示,HCDR3 长度呈明显的正态分布,平均长度为15.86 个氨基酸,其中,HCDR3 在14~19 个氨基酸之间分布最多。
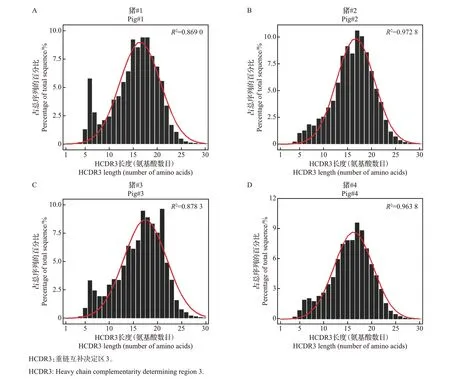
图5 4只仔猪中不同长度HCDR3分布情况Fig.5 Distribution of HCDR3 with different lengths in four piglets
3 讨论
BCR 通过特异性识别和结合抗原在适应性免疫应答中发挥重要作用,了解不同状态下抗体库的组成特征对于研究病理情况下机体对病原的抗体反应十分重要。由于机体抗体库具有高度多样性,使用普通的Sanger测序根本无法测序完全,所以需要依赖二代测序技术认识抗体库的全貌。尽管目前抗体库高通量测序技术已广泛应用于人及其他物种,但几乎没有关于猪的研究报道,所以开发适用于猪抗体库高通量测序的方法十分必要。本研究通过多重PCR扩增猪BCR重链文库,成功构建猪抗体库高通量测序方法,并分析了4 只健康猪外周血单个核细胞BCR重链的组成和特征。
猪IgH 的V、D、J 基因数量比其他物种(例如人和小鼠)少,猪只有来自一个VH3 家族的15 个IGHV 基因,与兔相似[15],而人类拥有来自7 个V 基因家族超过50种IGHV基因,小鼠拥有来自16个V基因家族超过100 种IGHV 基因[16]。本研究通过测序发现,猪抗体库重链V、D、J 基因使用呈现偏好性,15 个IGHV 基因中有8 个基因(IGHV1-4、IGHV1S2、IGHV1-15、IGHV1-14、IGHV1-6、IGHV1-8、IGHV1-10、IGHV1S5)的使用总频率超过80%,有5 个IGHV 基因的使用频率极低,这和之前报道IGHV1-4(文献中称为VHA)、IGHV1-6(VHB)、IGHV1S2(VHC)、IGHV1-8(VHE)是猪免疫前抗体库中最主要的使用基因[4]相类似。我们的测序序列涵盖了所有功能性IGHV 基因,充分证明我们的测序深度完全足够。先前有研究报道只有2 个IGHD(IGHD1和IGHD2)和1 个IGHJ(IGHJ5)是有功能的基因[2],本研究测序结果与此基本一致,即IGHD1和IGHD2是主要的表达基因,IGHD3和IGHD4的表达极少。在测序序列比对过程中存在诸多影响比对结果的因素,如片段相似性、连接多样性、体细胞超突变、测序错误等。由于在V、D、J重排过程中末端脱氧核苷酸转移酶(TdT)的作用会引起连接处核苷酸的插入和删除,有时很难将每条测序序列精准匹配到相应的基因片段,尤其是长度较短的D基因片段[17]。V、D、J重排过程中对某些基因的偏好在其他物种中同样有出现,例如小鼠IgH 表现出对VH1 家族的偏好使用,约50% 的基因都来自VH1[16]。
理论上,猪BCR重链有300种可能的V、D、J组合(15V×4D×5J=300VDJ),然而,由于实际利用的VH、DH和JH基因高度受限,造成V、D、J 组合相对有限,研究表明最高变区HCDR3 的多样性可以弥补猪IgH 库有限的组合多样性[18]。本研究从4 只仔猪样本中获得的HCDR3 序列最少为12 万条,最多达到35万条,和之前低通量测序结果相比反映的信息更全面;分析结果显示HCDR3长度符合正态分布,平均长度约为15.8 个氨基酸,比人类HCDR3 平均长度(11.5 个氨基酸)长[19]。当机体处于正常状况,免疫系统未受病原感染时,BCR随机组合呈现多克隆状态,一旦受到病原刺激则会出现特定重排和B细胞克隆性扩增,本研究建立的猪抗体库高通量测序方法可以协助更精确地区分病原特异性的克隆序列,辅助临床疾病的诊断和治疗。
4 结论
本研究成功建立了评估猪抗体库的高通量测序方法,阐明了猪抗体库IgH 的V、D、J 基因的使用呈现高度选择性,该方法获得的序列数是以往低通量测序的1 000倍以上,分辨率更高,可以更全面地认识猪抗体库的组成特征,为进一步深入研究不同疾病状态下猪抗体库特异性变化提供指导。
