脂质过氧化在环境污染物生化效应研究中的应用与展望
2021-11-02裘红权沈小铁刘璟林道辉黄益丽
裘红权,沈小铁,刘璟,林道辉,黄益丽
(浙江大学环境与资源学院,浙江省有机污染过程与控制重点实验室,杭州 310058)
脂质与蛋白质、核酸、糖类是组成所有生命体的4类基础生物化学大分子。脂质在生物功能上大多作为结构物质参与细胞膜的组成,或作为能量物质为机体提供能量。随着分子生物学的发展,蛋白质、核酸的研究得到了高度关注,而对脂类的研究则关注得相对较少。然而,脂质在生命活动过程中也是不可或缺的一部分,特别是作为细胞膜组分,脂质在细胞内各物质的空间区分和定位上以及在生物信号的跨膜传递等过程中至关重要,是目前生物化学的攻关难点之一[1]。
在环境科学研究领域,人们越来越关注环境健康问题,包括各类环境污染分子或理化胁迫因素对生命体的生理生化活动的影响(生化效应)。脂质作为4 大基础生物大分子之一也受到了极大的关注。与结构和功能具有丰富多样性的蛋白质、核酸和糖类相比,脂质的结构和功能在物种间相对保守,因此,针对脂质的检测指标较少,以脂质过氧化反应(lipid peroxidation,LPO)为主。本文综述了脂质过氧化反应在环境污染物生化效应中的研究现状,总结了影响脂质过氧化反应指标的因素,并展望了未来脂质在环境污染物生化效应研究中的应用和趋势。
1 脂质过氧化反应过程及检测
1.1 脂质过氧化反应过程
脂质的过度氧化也称脂质过氧化反应,一般定义为多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)或脂质的氧化变质。多不饱和脂肪酸是脂质过氧化反应的优选底物,其结构中的双键是反应的重要部位。脂质过氧化反应的化学本质是氧化应激引起的自由基链式反应[2]。以花生四烯酸为例,多不饱和脂肪酸过氧化反应的总过程如图1所示。
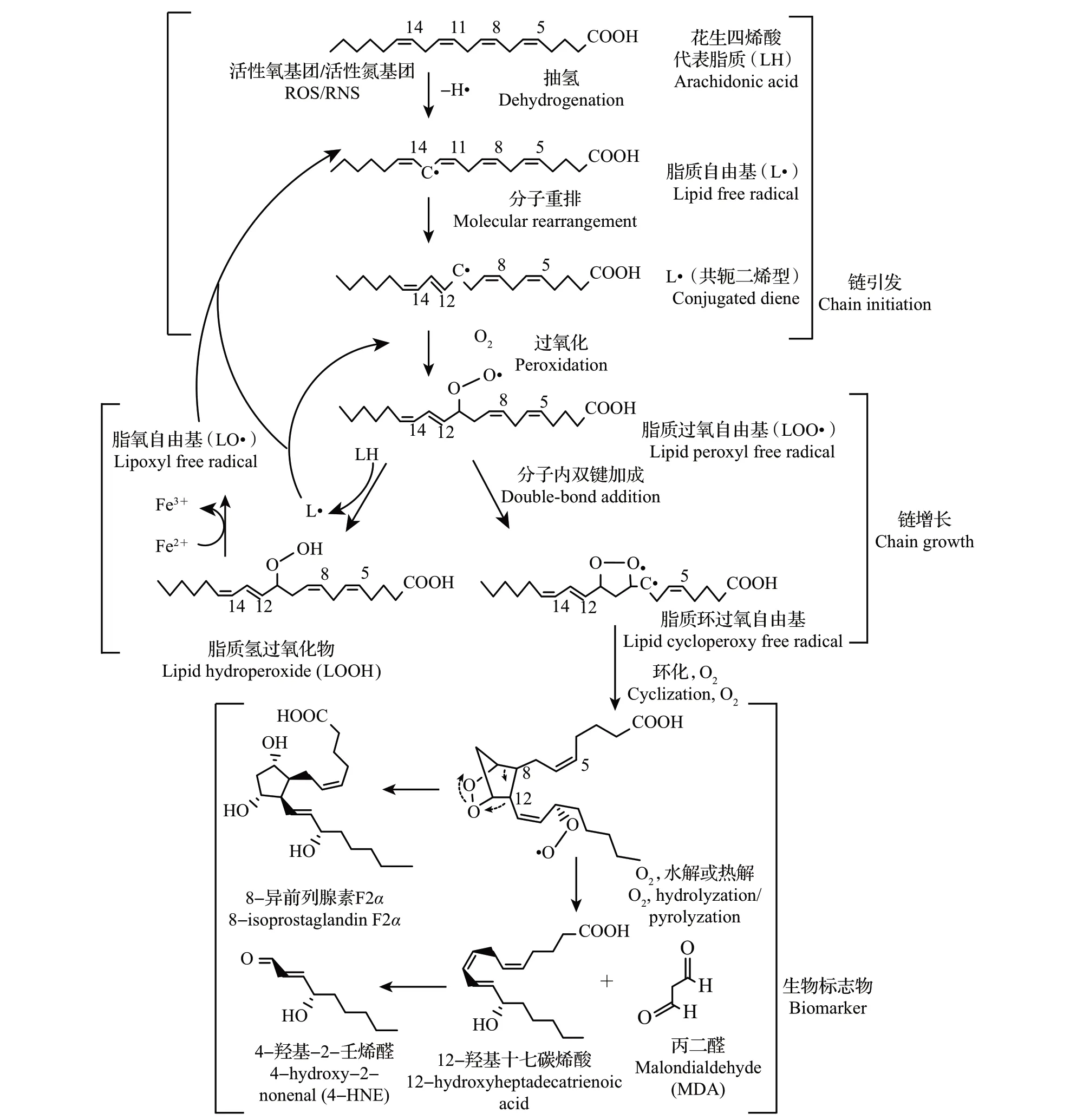
图1 脂质过氧化反应的总过程Fig.1 Whole process of lipid peroxidation(LPO)
多不饱和脂肪酸分子中烯丙基氢比较活泼,由于双键减弱了与之连接的碳原子与该碳原子上氢原子之间的C—H 键,所以氢容易被抽去。能抽氢而引发脂质过氧化反应的因子很多,包括活性氧基团(reactive oxygen species, ROS)和活性氮基团(reactive nitrogen species,RNS)。例如,羟基自由基(·OH)可以从2 个双键之间的—CH2—抽去1 个氢原子后,在该碳原子上留下1 个未成对电子,形成脂质自由基(L·)。L·经分子重排、双键共轭化,形成较稳定的共轭二烯衍生物。在有氧条件下,共轭二烯自由基与氧分子结合生成脂质过氧自由基(LOO·)。LOO·能从附近另一个脂质分子(LH)抽氢生成新的脂质自由基(L·),从而形成循环反应。这就是脂质过氧化反应的链增长阶段。链增长的结果是导致脂质分子的不断消耗和脂质过氧化反应物如脂质氢过氧化物(lipid hydroperoxide, LOOH)等的大量形成[2]。
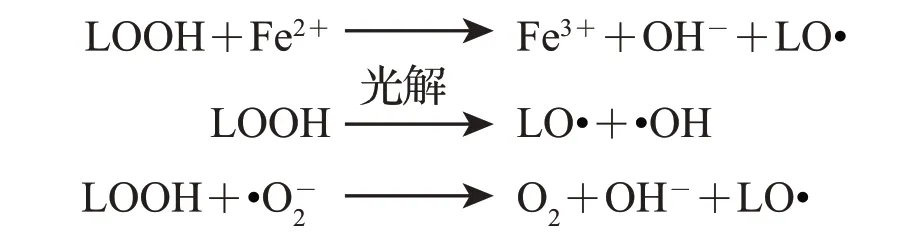
LOOH 可通过类Fenton 反应、光解或其他反应生成脂氧自由基(LO·):
脂质过氧化反应过程中生成的LO·、LOO·等活性氧自由基也参与链引发和链增长反应。LOO·还可以通过分子内双键加成,形成环过氧化物、环内过氧化物及自由基,最后断裂生成各种醛类,主要是丙二醛(malondialdehyde,MDA)、4-羟基-2-壬烯醛(4-hydroxy-2-nonenal, 4-HNE)、8-异前列腺素,以及短链的酮、羧酸和烃类等。因此,LOOH、MDA、4-HNE、8-异前列腺素等常常被用作脂质过氧化反应的生物标志物。
1.2 脂质过氧化反应检测
在低pH和高温条件下,MDA很容易与2-硫代巴比妥酸(thiobarbituric acid,TBA)发生化学计量数之比为1∶2 的亲核加成反应,生成红色荧光加合物MDA-TBA,可用分光光度法定量检测。目前,TBA法是检测脂质过氧化反应最常用和经典的方法。然而,生物样品中的MDA 可能来源于其他生化反应,脂质过氧化物的形成和分解不是其唯一来源;TBA 也可能与其他TBA 活性物质(thiobarbituric acid reactive substances,TBARS)发生反应。因此,TBA法具有一定的局限性[3]。
生物膜是生命系统中最容易发生脂质过氧化反应的场所,因为它具备脂质过氧化反应的2 个必要条件:一是氧气分子;二是多不饱和脂肪酸。氧气为非极性物质,在膜脂中浓度很高。很多多不饱和脂肪酸如花生四烯酸,是磷脂(膜脂的主要成分)的组成成分,而多不饱和脂肪酸比饱和脂肪酸和单不饱和脂肪酸更容易被氧化[2]。脂质过氧化反应引发的自由基连锁反应加剧了氧化应激,进一步损害包括蛋白质和核酸在内的细胞实体,对细胞膜的损伤尤为严重。脂质过氧化反应通过增加膜内部的介电常数与微黏度增加了质膜的通透性[4]。另外,脂质自由基与其他脂质和生物大分子如蛋白质相互作用引起交联,膜蛋白被永久性缔合,质膜韧性增加,流动性降低,从而导致污染物更易进入细胞[5]。基于此原理,有些研究通过检测细胞膜通透性来评价脂质过氧化反应的发生和程度。
为了抵御高活性自由基产生的危害,生物已经进化出一套完整的抗氧化系统。机体内已知有2种抗氧化系统,即非酶抗氧化系统和酶抗氧化系统。非酶抗氧化系统含L-抗坏血酸(维生素C)、生育酚(维生素E 的水解产物)、(还原型)谷胱甘肽(glutathione,GSH)、类胡萝卜素,以及微量元素铜、锌、硒等。酶抗氧化系统含过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD),以及谷胱甘肽体系和硫氧还蛋白体系等。POD中的过氧化氢酶(catalase,CAT)能催化过氧化氢分解,而SOD主要将超氧阴离子自由基(·)转化为O2和H2O2[6]。抗氧化系统在很大程度上影响着脂质过氧化反应的过程和进度,因此,抗氧化系统的成分和酶活性也常常作为检测指标用来评价脂质过氧化反应的发生和机制。
2 脂质过氧化反应在环境污染物生化效应中的研究现状
以“lipid peroxidation”为主题,利用“web of science”核心合集数据库及其检索分析工具,在环境科学领域统计了近25年来的相关研究论文数,结果如图2 所示。从中可知,相关论文数呈逐年上升趋势,说明脂质过氧化反应在环境科学领域得到了广泛关注和应用,是环境污染物生化效应的重要指标。
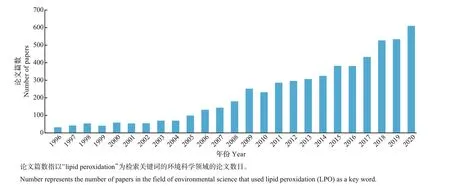
图2 近年来脂质过氧化反应相关论文的发表篇数Fig.2 Number of LPO-relevant papers published in recent years
本文以不同污染物或不同受试生物为甄别条件,挑选了环境科学领域主流期刊上100 多篇文献进行总结和综述。统计发现,受试物种多达50 种,涵盖4 大生物界,包括动物25 种、植物19 种、真菌2种、原核生物4种。其中,原核生物以大肠埃希菌和光合细菌为主,植物主要包括双子叶植物、单子叶植物和藻类,动物主要包括软体动物、节肢动物、环节动物以及脊索动物中的硬骨鱼纲和哺乳纲。
脂质过氧化反应指标可以应用于不同分类阶层的物种,一方面说明了生命的同一律,另一方面也说明了脂质在所有生命过程中的重要性。生命的基本结构是细胞,脂质作为细胞膜的结构物质在细胞形成以及进化过程中起到了先锋作用,在研究生命体对环境因素的生化效应中也是不可或缺的一部分。
已有文献中研究污染物或污染因素的种类非常丰富。根据污染物性质可以分为金属或类金属(表1)、纳米材料(表2)、有机污染化合物(表3)以及其他环境理化胁迫因素(表4)。其中,大多数污染物对脂质过氧化反应有提升作用。
2.1 金属或类金属
已报道的能显著促进脂质过氧化反应的金属有铝、铜、镉、铅、钒、锌和银等,如表1所示。一些金属或类金属会破坏机体氧化平衡而导致氧化应激。一般来说,这些金属特别是氧化还原活性金属可产生ROS,并耗尽细胞的主要抗氧化剂(如谷胱甘肽等),从而引起抗氧化酶水平的变化,如谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽巯基转移酶(glutathioneS-transferase,GST)、CAT和SOD 等。这些变化可能导致膜脂、蛋白质和DNA的氧化损伤。因此,由金属引起的氧化应激所造成的细胞损伤是金属产生毒性的机制之一[7]。
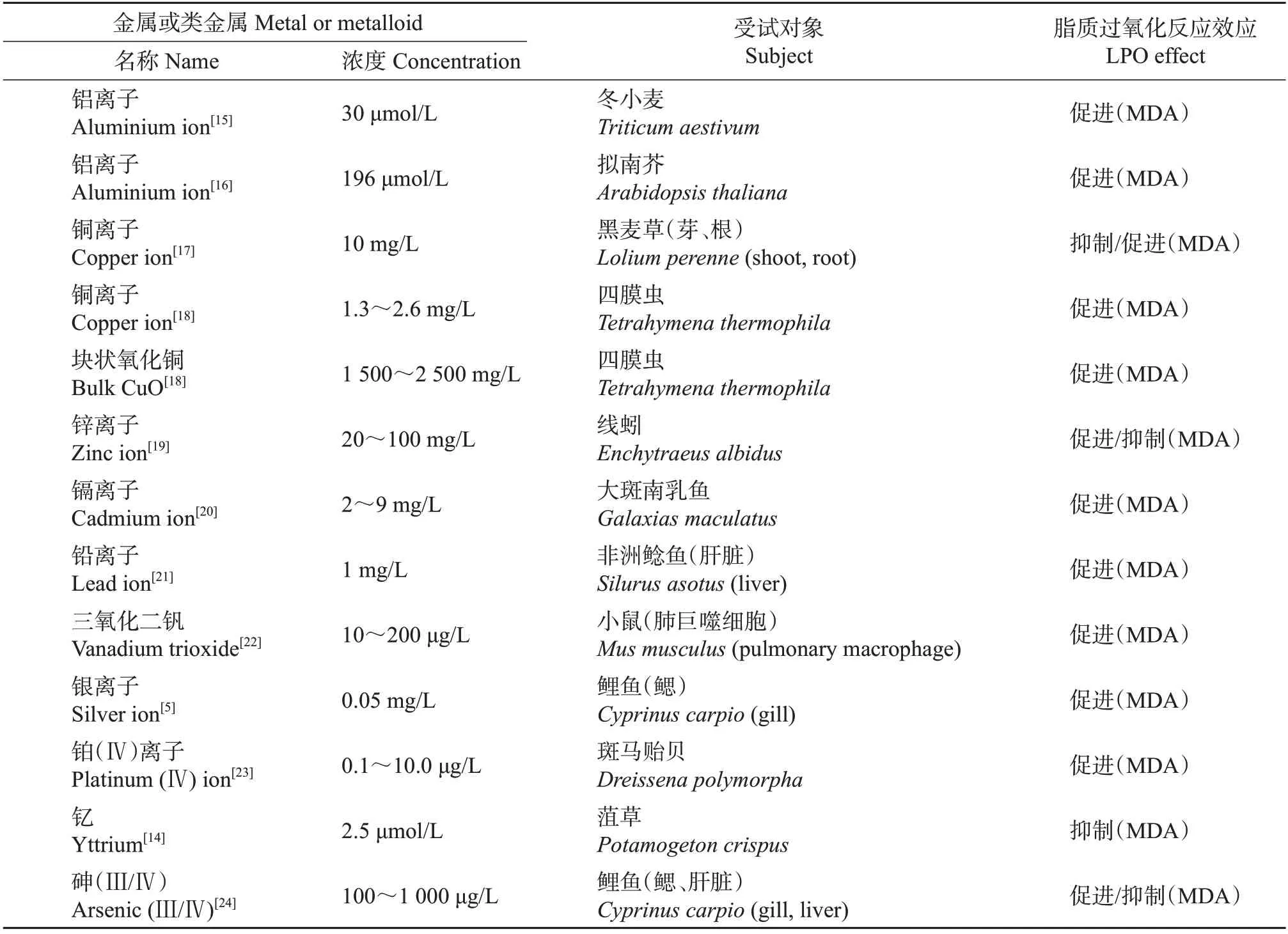
表1 不同金属或类金属对不同受试物种的脂质过氧化反应指标的影响Table 1 Effects of different metals or metalloids on LPO indexes in different tested species
Fenton 反应和Haber-Weiss 反应是金属诱导ROS 产生的重要机制,而铁和铜是其重要的诱发剂。Fe2+、Cu+可通过Fenton 反应和Haber-Weiss 反应积极介导ROS 的产生。细胞铁死亡是一种铁依赖性细胞程序性死亡,其启动主要依赖于细胞内铁超载及由此产生的脂质过氧化反应的信号[8]。
与铁和铜相比,锌虽被证明能诱导贻贝发生脂质过氧化反应,但其诱导ROS产生的能力不强[9]。有实验表明,锌单独作用不会改变MDA 含量[10];但也有实验发现,细胞质锌的增加使MDA含量减少[11]。
铝胁迫可显著诱导2种蓝藻——宽松鱼腥藻和灰色念珠藻的细胞氧化损伤。该损伤主要通过细胞产生活性氧中间体(如·、H2O2、·OH)来介导,其在生物系统中的促氧化活性或源于铝超氧化物半还原态自由基(·)的形成[12]。铝还可诱导类囊体膜中电子传递速率的降低而导致ROS产生的增加[13]。
有些金属可以清除自由基。有实验表明,稀土元素能通过直接清除自由基或与抗氧化剂相互作用间接消除自由基来减轻植物的氧化损伤。如稀土元素钇可通过降低Habere-Weiss 和Fenton 反应中的·和H2O2水平来减少·OH的产生,进而抑制镍(150、200 μmol/L)胁迫下菹草自由基的合成和膜断裂,从而缓解了菹草的氧化损伤[14]。
2.2 纳米材料
随着纳米材料在工业、农业上的应用和推广,越来越多的纳米材料被释放到环境中,其环境健康效应也引起了广泛关注。
研究发现,无论是金属基纳米材料还是碳基纳米材料,多数纳米粒子能诱导ROS自由基的产生并造成生物体氧化损伤(表2)。如纳米氧化铜对四膜虫的毒性体现在诱导ROS的产生,改变细胞膜脂肪酸组成以及细胞膜透性上[18]。银纳米颗粒可能攻击n-3多不饱和脂肪酸中的二十二碳六烯酸和二十碳五烯酸的双键,引发如图1 所示的经典的脂质过氧化反应物自由基链式反应,从而产生脂质过氧化反应[5]。纳米材料的高表面体积比会加剧氧化,如三氧化二钒纳米颗粒诱导的过氧化物效应比类似的块状材料更强,其高活性就归因于高表面体积比,其比表面可高达600 m2/g,难溶性的三氧化二钒能快速转化为可溶性的五氧化二钒,从而更多地接触细胞[22]。
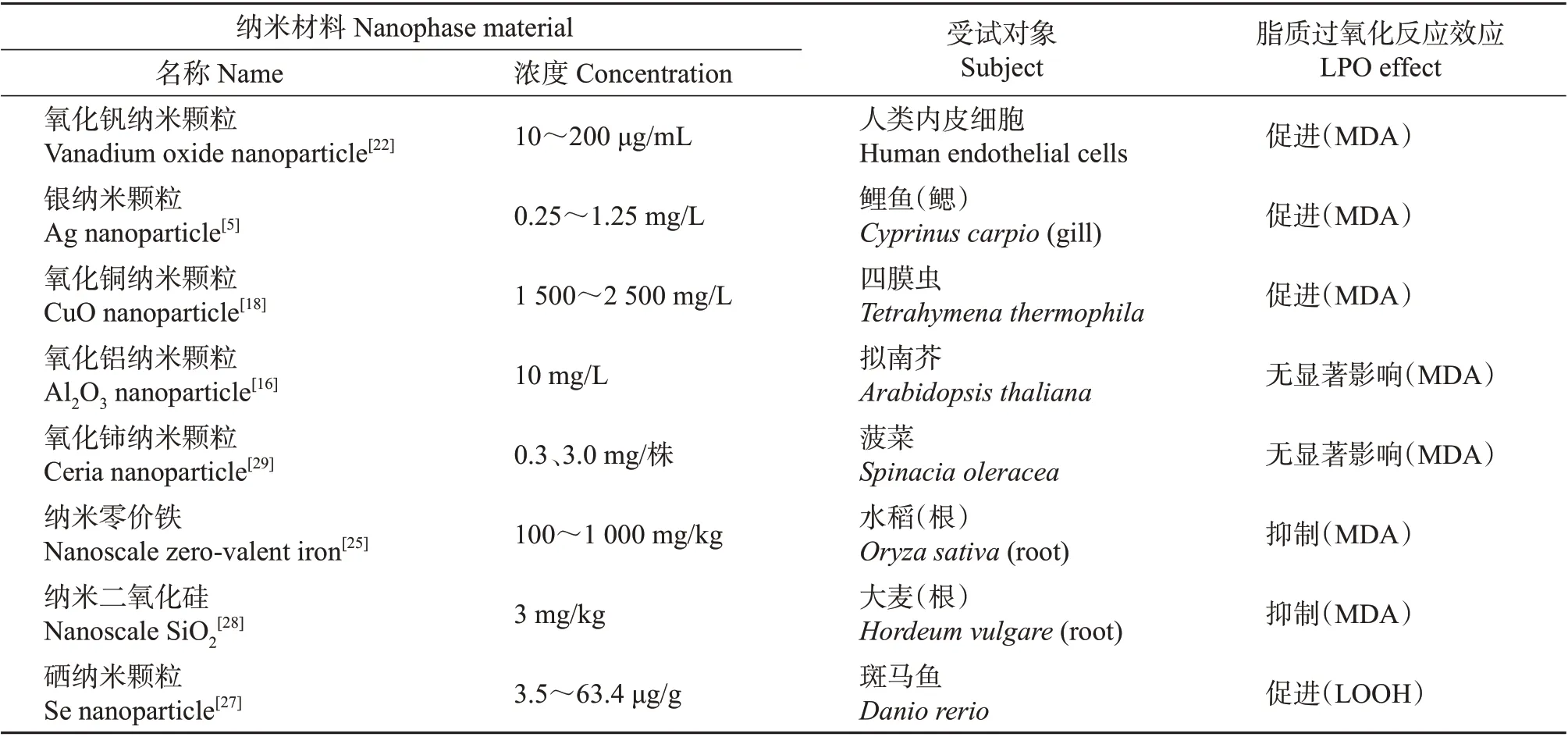
表2 不同纳米材料对不同受试物种的脂质过氧化反应指标的影响Table 2 Effects of different nanophase materials on LPO indexes in different tested species
一些纳米粒子对试验生物的脂质过氧化反应无显著影响。如氧化铝纳米颗粒(98 μmol/L 或10 mg/L)对拟南芥的光合作用、生长和脂质过氧化反应没有影响,反而会通过刺激根系发育相关基因和营养相关基因的转录来促进根系生长[16]。也有纳米粒子通过清除自由基或提高抗氧化系统活性来抑制脂质过氧化反应。虽然大量研究表明,进入细胞内的工程纳米粒子可诱导ROS的增加,然而在纳米零价铁(100~1 000 mg/kg)处理下,水稻根中活性氧含量的变化提示纳米零价铁可能具有清除自由基的能力[25]。
在很多情况下,纳米材料的脂质过氧化反应效应仍有待商榷。纳米颗粒浓度不同,其引起的脂质过氧化效应可能完全相反。硒是人体必需的微量元素。研究表明,硒可保护鱼类免受氧化应激和脂质过氧化反应的作用,适量的纳米硒可诱导抗氧化酶活性,从而减轻盐胁迫造成的脂质过氧化反应[26];但超营养剂量硒(3.5~63.4 μg/g)会呈剂量依赖性地增加斑马鱼大脑的脂质过氧化反应[27]。在对大麦实验中,纳米二氧化硅单独使用(3 mg/kg)对大麦根或叶的脂质过氧化反应没有显著影响,而与对乙酰氨基酚合用后(3 mg/kg 纳米二氧化硅+400 mg/kg对乙酰氨基酚),与单独用对乙酰氨基酚相比,合用对大麦根脂质过氧化反应起抑制作用(对叶无显著影响),这可能与纳米二氧化硅刺激巯基化合物和抗坏血酸过氧化物酶活性有关[28]。
2.3 有机污染物或化合物
有机污染物对环境和人类健康的有害影响已成为全球关注的问题。环境有机污染物的种类非常多,在本综述中,主要包含药物及个人护理品如抗生素、抑菌剂、常用精神性疾病药、镇痛药,农药化肥如草甘膦、氯氰菊酯、乙烯叉二脲,以及多环芳烃、增塑剂、溴代阻燃剂、苯系物、微囊藻毒素、土壤改良剂等(表3)。
大部分有机污染物能引起生物显著的脂质过氧化反应效应。多环芳烃能在人体内引起显著的氧化胁迫,攻击脂质和核酸,造成生物分子的氧化损伤并进一步引起癌症、心血管疾病等[30]。如加纳库马西人群的尿液中MDA 和单羟基多环芳烃(monohydroxylated polycyclic aromatic hydrocarbons,OH-PAHs)浓度之间呈显著正相关,提示脂质过氧化反应的发生与多环芳烃的暴露有关[31]。水环境中的苯并芘在低浓度条件下能促进养殖水产动物(虹鳟、梭子蟹)的脂质过氧化反应[32]。菲暴露可显著降低SD大鼠CAT活性,同时增加MDA浓度[33]。塑料中常含双酚类增塑剂,动物体内和体外实验表明,双酚A可通过产生ROS/RNS、降低抗氧化酶活性来诱导氧化应激/硝化应激,导致肝组织氧化损伤如脂质过氧化反应,如双酚A 暴露可显著降低小鼠肝SOD、CAT 和GSH-Px 等抗氧化酶的活性,也降低GSH 的水平以及氧化损伤相关基因的相对表达[34]。一些苯系物在低浓度条件下也能显著诱导脂质过氧化反应效应(表3)。
在处理废水或固体废物时,其中的药物与个人护理品的化学成分具有潜在的环境风险[35]。双氯芬酸属于非甾体类抗炎药,在一定程度上对大斑南乳鱼的鳃、肾的脂质过氧化反应起抑制作用,但对其肝脏的脂质过氧化反应有明显促进作用,且双氯芬酸在环境中会与其他污染物形成复合污染效应[20]。许多抗生素类药物如土霉素、金霉素、环丙沙星、磺胺甲噁唑等,以及镇静、镇痛类常用药物成分排放到环境中,对其中广泛存在的低等动物、藻类以及一些经济作物如黄瓜、大麦产生一定的毒性,诱发脂质过氧化反应,并进一步引起生态效应(表3)。
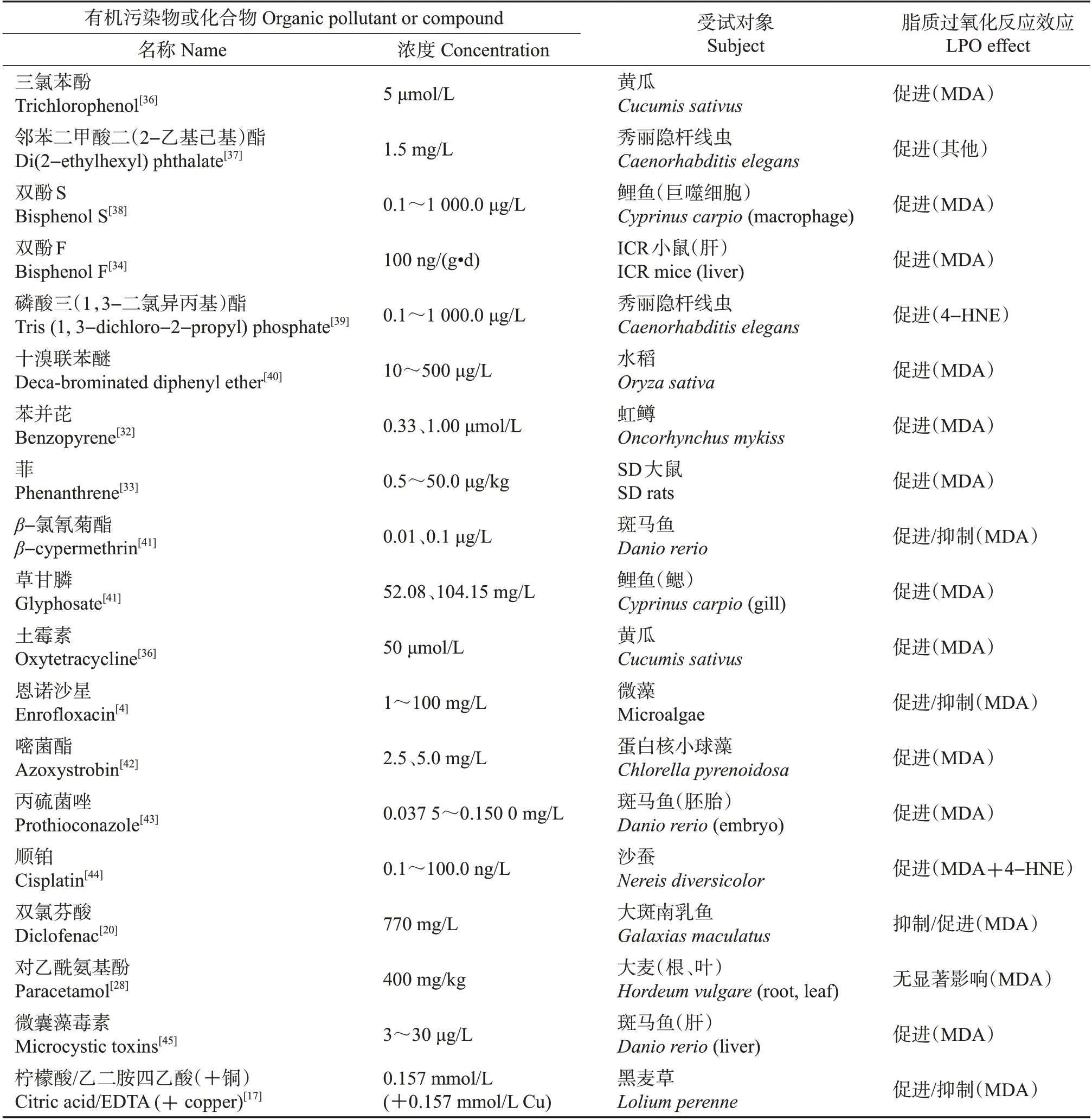
表3 不同有机污染物对不同受试物种的脂质过氧化反应指标的影响Table 3 Effects of different organic pollutants on LPO indexes in different tested species
在农业生产活动过程中使用的农药、化肥及土壤改良剂的环境健康效应也受到了广泛关注(表3)。研究发现,除草剂草甘膦在土壤中能显著诱导番茄植株产生氧化应激效应,产生过氧自由基,并干扰抗氧化酶系统,但是脂质过氧化反应指标MDA含量只在根际上升[46]。水体中,草甘膦能诱导鲤鱼体内产生氧化压力,显著增加其鳃部MDA含量,引起脂质过氧化反应。杀虫剂β-氯氰菊酯对斑马鱼存在对映异构体选择性毒性,低浓度条件下可显著增加其肝脏MDA含量,引起脑脂质过氧化反应[41]。
2.4 其他环境理化胁迫因素
人类的一系列工业、农业活动以及对大自然的改造活动,正悄然而显著地影响着全球范围内的环境状况。二氧化碳等温室气体过度排放引起的全球气候变暖、海水酸化,大气污染物日趋复杂,臭氧浓度上升,白色污染塑料制品形成的微塑料,核电技术的发展带来的环境辐射等问题,都是地球生物面临的新的环境胁迫因素。
大气中二氧化碳水平的增加使水中的二氧化碳-碳酸盐平衡向酸性方向移动。研究表明,模拟全球变暖和海洋酸化的实验条件,能诱导2种模式生物厚游仆虫和特氏杜氏藻的脂质过氧化反应显著增加[47]。在全球变暖情况下,温度上升和污染物会对生物体造成复杂的协同影响效应。翠绿丝䗓卵期热浪处理与生命后期农药暴露引起的氧化应激之间存在显著相互作用,在生命早期所经历的热浪胁迫影响了其在以后的生命阶段对胁迫的反应,总体上,卵期和幼体期的热处理都导致其MDA水平升高[48]。
臭氧可以通过气孔进入植物组织并诱导产生ROS,如超氧阴离子自由基和过氧化氢,活性氧的攻击会导致膜变性以及脂质过氧化反应终产物MDA的积累[49]。细颗粒物(particulate matter 2.5,PM2.5)内化到内皮细胞中会破坏细胞内的铁和氧化还原平衡,并随着炎性细胞因子的分泌而导致细胞铁死亡。PM2.5引起的铁死亡可以通过脂质过氧化反应抑制剂(Fer-1)和铁螯合剂(DFOM)在药理学上进行挽救[8]。土地盐碱化是全球普遍存在的环境问题,盐胁迫对植物等危害较大。如氯化钠胁迫引起草莓植株严重的氧化应激,表现为MDA 和H2O2水平的升高[26]。
微塑料的概念一经提出就引起了环境科学家们的强烈关注。微塑料的毒性与其粒径大小、剂量及与外源性化学物质的相互作用有关[50]。有实验表明,聚苯乙烯塑料(100~400 μmol/L)对虹鳟无显著的脂质过氧化反应[51];也有实验表明,聚苯乙烯微塑料(5 μmol/L)呈浓度依赖性诱导中华绒螯蟹发生脂质过氧化反应[52]。有实验以大西洋的欧洲鲈鱼、竹筴鱼、白鲭为研究对象,在其中发现了微塑料,并证明了其脂质过氧化反应毒性[53]。
环境中各类辐射引发的环境健康问题也是近年来的研究热点之一。核电技术的发展也带来环境辐射的风险。研究发现,电离辐射如伽马射线辐射能引起大型溞的氧化应激,诱导产生氧自由基,促进脂质过氧化反应等[54]。紫外线辐射能与TiO2协同促进微藻的脂质过氧化反应,增加膜通透性并导致细胞内含物泄露[55]。超声辐射也可以使铜绿微囊藻产生自由基,通过抑制光合作用、诱导脂质过氧化反应来破坏细胞[56]。
不同环境理化胁迫因素对不同受试物种脂质过氧化反应的影响如表4所示。

表4 不同环境理化胁迫因素对不同受试物种的脂质过氧化反应指标的影响Table 4 Effects of environmental physical and chemical stress factors on LPO indexes in different tested species
3 影响脂质过氧化反应指标的因素
脂质过氧化反应作为一种反映机体氧化应激状态的指标,它的指示作用比较显著可靠,检测简单可行,已被广泛地应用到环境科学的污染物生化效应研究中。然而,脂质过氧化反应针对不同物种和应激源具有短暂性和可变性,其生物标志物检测的特异性也偶有争议。实验中许多因素,如机体差异、污染物的暴露时间和浓度、机体抗氧化系统的平衡作用,以及一些容易被忽略的复杂或复合因素,都会对脂质过氧化反应指标结果产生影响[41],如图3所示。
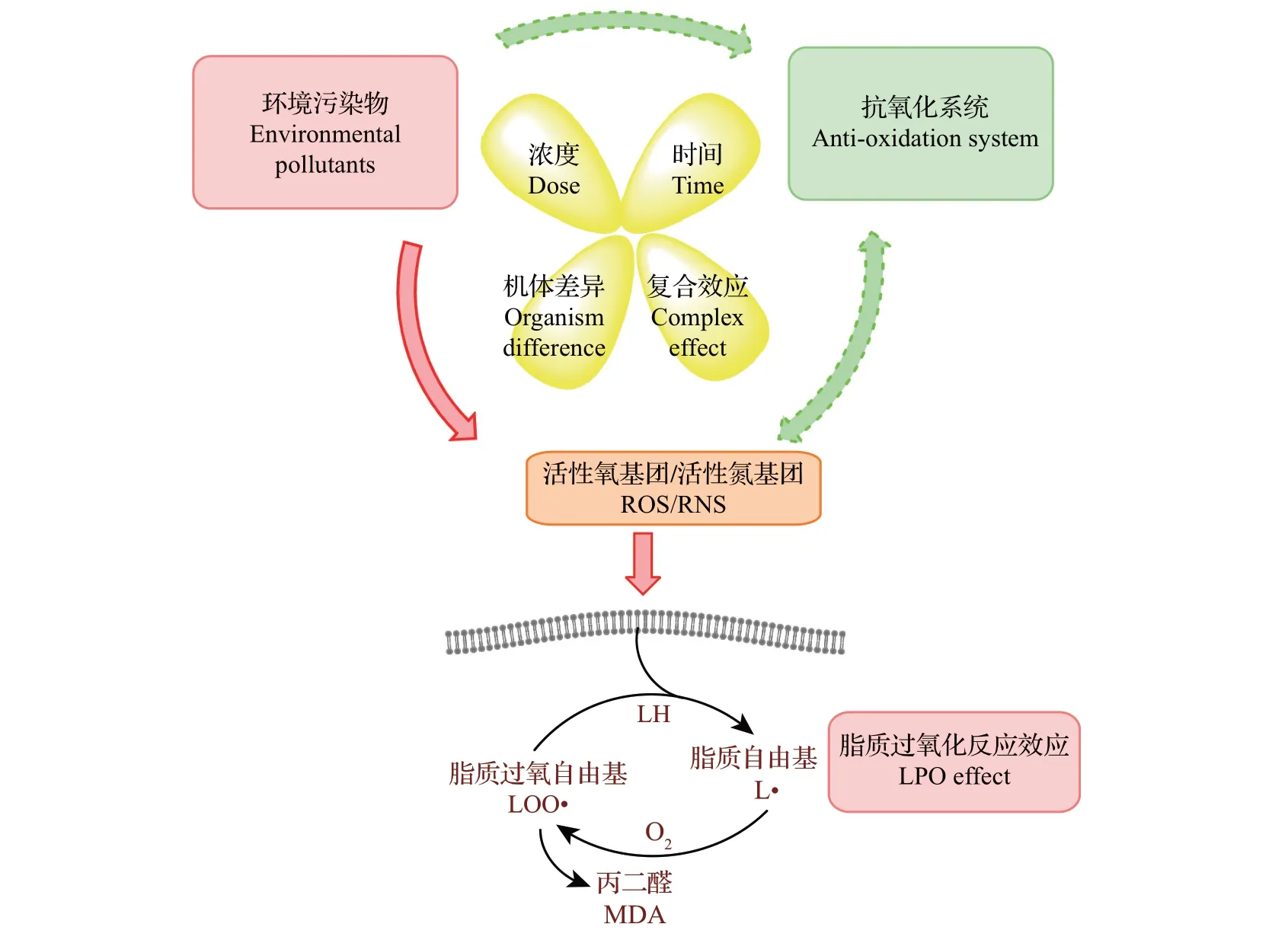
图3 环境污染物或污染因素引起脂质过氧化反应的机制及其影响因素示意图Fig.3 Schematic illustration of the mechanism and influencing factors of LPO caused by environmental pollutants or contamination factors
3.1 机体差异
性别差异、年龄差异及生物体的不同组织或器官差异,都会使机体脂质过氧化反应存在差异。有研究发现,在加纳的库马西人群中,重金属和多环芳烃的暴露都会影响机体脂质过氧化反应指标,但是不同年龄和性别的人群对污染物反应有差异。如萘暴露导致的持续性头痛和呼吸困难的发生概率在性别上,女性显著高于男性,在年龄上,21~60岁年龄组MDA含量指标最高[31];而与重金属暴露相关的MDA 水平在61~85 和3~20 岁年龄组中最高[58]。
对于水生生物,常选择鳃组织来检测生物标志物,因为它与周围水环境直接接触,是摄取污染物的第一线,且受其他酶活性和生殖周期的影响较小[9]。在金属诱导的氧化应激研究中,生物体消化腺中的MDA含量与鳃组织相比呈现相反的趋势:消化道中较高浓度的金属硫蛋白(metallothionein, MT)可能抑制了MDA 的形成;消化腺细胞质锌的增加也会减少MDA 含量。总体而言,鳃可能比消化腺对金属诱导的氧化应激更敏感[11]。肝脏是外来污染物的主要解毒场所,一般情况下,活性氧对生物膜脂质的氧化损伤在肝脏中的发生率特别高,但也正因肝脏是解毒的主要场所,其抗氧化能力也更突出[59]。如暴露于砷(Ⅲ/Ⅳ)的鲤鱼鳃MDA 含量升高,而其肝脏MDA含量却显著降低[24]。
对于植物,根和芽组织中发生的脂质过氧化反应往往差异显著。如草甘膦暴露下番茄植株根和芽的MDA水平差异显著:在根中,高浓度草甘膦造成MDA水平与对照组相比增加53%;在芽中,MDA含量呈剂量依赖性降低,芽中的巯基化合物或在解毒中起着重要作用[46]。暴露于铜离子的黑麦草也有类似的情况,其根和芽中的MDA 含量有较大的差异[17]。
3.2 污染物暴露浓度和时间的影响
与大多数生理生化反应类似,脂质过氧化反应对污染物的响应受污染物浓度和暴露时间影响。污染物浓度较低时,短暂的促氧化反应往往伴随强烈的抗氧化反应;当污染物浓度突破“阈值”时,生物标志物测量值将大幅增加,但也可能因为细胞被极端损坏而降低[19]。因此,污染物浓度对脂质过氧化反应指标的影响可能只在一定范围内呈线性关系。如多环芳烃中的苯并(a)芘和苯并(k)荧蒽在0.5~50.0 μg/L 质量浓度范围内,对高栉孔扇贝的MDA 含量指标呈剂量和时间依赖性提升作用;在低于1.0 μg/L 时可提高血淋巴的SOD 活性,而在高于10.0 μg/L时短时间内抑制其活性,具有强脂质过氧化反应毒性[60]。
脂质过氧化反应水平与污染物暴露时间也并非总是呈线性关系,实验中往往得到MDA 水平先升后降、先降后升、低位徘徊或波动变化的结果。如暴露于锌或镉的线蚓在第4 天时体内活性氧积累,脂质过氧化反应水平增加,但在第8天时没有观察到脂质过氧化反应水平进一步增加[19]。暴露于10.0 μg/L铂离子的斑马贻贝MDA 检测值在第1 天时大幅增加,在第4天时增加值下降;当铂离子质量浓度为0.1、1.0 μg/L 时,在第1 天斑马贻贝MDA 检测值下降,但在第4 天其检测值与对照组相比显著增加[23]。
总之,暴露时间和浓度直接影响脂质过氧化反应指标,涉及机体抗氧化机制与过程,因此,对脂质过氧化反应的测定不能局限于一个时段,或小范围浓度,需要扩大浓度范围,并进行全程评估。随着研究数据的积累,人们对各类污染物生化效应的认识将逐渐清晰。
3.3 细胞抗氧化系统的平衡作用
在细胞内,氧化与抗氧化是一个动态平衡的生命过程。对氧化应激机制的阐述往往同时借助氧化机制和抗氧化机制。当平衡体系失衡并偏向于氧化时,氧化应激被建立。当时间延长,生物体可能成功通过抗氧化系统消除应激因子并从氧化状态中恢复,也可能发生极端氧化损伤而导致其细胞破裂,这都会导致脂质过氧化反应水平测量值降低。在大部分研究中,探讨污染物氧化应激效应除了测量脂质过氧化反应的MDA 和LOOH 等指标,往往也同时测量细胞抗氧化系统的各种成分或酶的活性,如SOD、GSH、GST、CAT 等酶的活性或氧化产物[19]。
一些环境污染物或环境因素通过增强抗氧化作用而有效降低脂质过氧化反应指标含量。如吡唑甲酰胺能通过抗氧化作用减轻硝酸铅对非洲鲶鱼引起的脂质过氧化反应[21]。前文提到的生物体不同部位、不同年龄存在脂质过氧化反应指标差异,根本原因也是抗氧化防御能力有差异。
一些污染物通过抑制抗氧化系统酶活性来增强氧化效应。如甲硫威会导致罗马蜗牛抗氧化酶如SOD、CAT 和GSH-Px 的活性显著降低,这些酶是抵御自由基的第一道防线,其活性的降低必将引起高活性自由基不能被及时清除,从而导致脂质过氧化反应增强[61]。
3.4 其他复杂因素的影响
在实验中,我们往往探究某一种特定污染物或因素对脂质过氧化反应的影响,但生物体所处的真实生境往往是复杂的,有多种污染物并存,同时受到一些不可控的环境、物理、化学因素影响。这些不同的污染因素、环境因素相互影响,相互作用,在诱导生物体的氧化应激效应时会产生复合效应,进一步影响脂质过氧化反应指标。
污染物复合效应往往具有不可预测性,即使是简单的二元应激源组合,其产生的复合效应和影响也具有高度复杂性。如:单独镉暴露能显著降低大斑南乳鱼肾的CAT 活性,抑制抗氧化防御系统,导致脂质过氧化反应升高;单独抗氧化剂双氯芬酸的暴露导致大斑南乳鱼肾脏脂质过氧化反应降低;当两者同时发生在特定浓度的城市水域时,会互相抵消产生的生物效应,该作用与机体部位有关[20]。双酚A 单独暴露对斑马鱼胚胎产生较强的氧化损伤效应,MDA 水平上升,而氧化石墨烯和双酚A 具有拮抗效应,能缓解由此产生的氧化损伤毒性[62]。多壁碳纳米管或全氟辛烷磺酸单独暴露均会显著增加斑马鱼的MDA 水平,但多壁碳纳米管的存在能降低全氟辛烷磺酸对早期生命阶段斑马鱼的发育毒性[6]。某些化学复合因素能缓解脂质过氧化反应。如盐胁迫产生的交叉保护效应能显著增强库德里阿兹威氏毕赤酵母的镉耐受性,盐胁迫使酵母细胞GSH 含量和GST 活性增加,其解毒作用增强,从而缓解脂质过氧化反应[63]。某些化学复合因素可加剧脂质过氧化反应。对黑麦草的研究表明,柠檬酸与铜的组合放大了脂质过氧化反应效应,这可能与柠檬酸螯合能力较弱有关[17]。
还有一些复杂环境因素往往容易被忽视。如一项水污染研究中,在夏季,作为对照流域的鱼中存在额外高的脂质过氧化反应值,氧化应激可能受到温度及代谢率上升等方面的影响,而在不同的取样点,夏、冬2季鱼类的脂质过氧化反应没有标准或清晰的模式[59]。因此,各种潜在的化学、物理复合因素仍需被研究,在真实环境中对脂质过氧化反应的评估需要适当从一元转向多元,综合考虑拮抗、协同等相关作用。
4 脂质在环境科学研究中的应用展望
脂质作为4 大基础生物大分子之一,参与许多生物化学反应过程,在细胞代谢网络中也起着举足轻重的作用。从上文阐述的脂质过氧化反应指标在多种生物物种、多种环境污染物生化效应中的应用也说明了脂质的重要性。
在很长一段时间里,脂质被认为只是作为结构物质参与生物膜的组建,以及作为能量物质在代谢中为机体储存或提供能量。但是随着生物化学研究的深入,人们发现脂质除了以上2 种生物学功能外,还展示了更精细的生理功能,如作为信号物质基础对细胞信号的传递产生重要影响[1]。以往生物信号的跨膜传递往往归功于细胞膜上的蛋白质分子,然而最近的研究表明,细胞膜中的膜脂成分、磷脂的饱和度可能通过调节膜蛋白与信号分子的相互作用活性,或者通过与信号分子直接结合,间接或直接参与细胞信号传导[1]。因此,除了生物膜通透性的指标,我们期待未来能有更多与生物膜功能有关的检测指标应用到环境科学研究中。
随着组学技术的发展和普及,现代组学技术已经广泛而深入地应用到环境科学研究中[64]。基因组学、转录组学可以揭示各物种细胞中参与脂类代谢的相关基因和基因的表达差异,蛋白质组学可以发现与脂类代谢相关的酶和蛋白质的功能,代谢组学可以表征脂质代谢过程中一系列中间产物的差异,各种组学手段的结合可以丰富我们对脂质生物功能的认识,并为寻找与脂质代谢相关的酶或基因作为生物标志物提供基础信息。CHEN等成功以脂质为研究对象,以脂肪酸组成、细胞膜组分和功能、脂肪酸合成关键酶活性以及脂质过氧化反应等为检测指标,探讨手性污染化合物对植物的生化效应的影响,为脂质在环境科学研究中的应用提供了很好的案例[65]。
总之,脂质过氧化反应是以脂质为对象探讨环境污染物生化效应的经典方法,在环境科学中将继续发挥重要作用。然而仅停留在终端产物的检测不足以充分认知脂质对污染物的响应机制,对脂质在环境科学研究中的重要性的认识还应该通过更多的检测指标来实现。未来可以结合细胞膜的功能研究,或是利用现代组学的手段,深入开展脂质在环境科学中的研究与应用。
