浙江省2市动物源大肠埃希菌及肠球菌耐药性比较和分析
2021-11-02唐标郝运林家辉王静鸽吉小凤钱鸣蓉杨华
唐标,郝运,林家辉,王静鸽,吉小凤,钱鸣蓉,杨华*
(1.浙江省农业科学院农产品质量安全危害因子与风险防控国家重点实验室,杭州 310021;2.浙江省农业科学院农产品质量安全与营养研究所,杭州 310021;3.浙江理工大学生命科学与医药学院,杭州 310018;4.青海大学农牧学院,西宁 810016)
大肠埃希菌(Escherichia coli)[1]和肠球菌(Enterococcus)[2-3]是动物源和食品源最常见的2 种细菌,不仅是引起尿路感染、菌血症等多种细菌性感染疾病的重要条件致病菌,也分别是革兰氏阴性菌和阳性菌的耐药性水平指示菌[4-5]。近年来,抗生素因在细菌性疾病的预防和治疗方面作用突出而被大量使用,导致动物源细菌耐药性问题日益严重[6]。耐药菌可以通过养殖人员的动物饲养过程或通过食物链直接传播给人,也可以通过污染土壤、水源等环境间接传播给人,这使得细菌耐药性问题严重威胁着公共卫生安全[7]。除此之外,大肠埃希菌和肠球菌是重要的耐药基因储存库[8-9],可通过携带耐药基因的质粒和可移动遗传元件的转移进行水平传播[10-11],导致细菌耐药率不断增加。尽管我国开展了动物源细菌耐药性监测[12],但是仅在省级层面从个别养殖场采集了代表性菌株,对于反映市级水平的细菌耐药性水平研究仍存在空缺。
本研究对浙江省金华和台州2市各7个畜禽养殖场的动物进行肛拭子采样,通过对大肠埃希菌和肠球菌分离培养后再进行药物敏感性试验,获得了2 市的细菌耐药性水平并进行了比较,旨在为动物源细菌耐药性监测和控制提供依据。
1 材料与方法
1.1 样品来源
2020年5月分别从浙江省台州市7个养殖场(2个肉鸡场、5个规模猪场)采集健康动物的肛拭子样品140份,从浙江省金华市7个养殖场(2个肉鸡场、5 个规模猪场)采集健康动物的肛拭子样品144 份。样品采集后置于低温(2~8 ℃)样品箱中,并在当日运回实验室进行大肠埃希菌和肠球菌分离前处理工作。
1.2 主要试剂
LB(Luria-Bertani)琼脂培养基、缓冲蛋白胨水(buffered peptone water, BPW)、伊红美兰(eosin methylene blue,EMB)琼脂培养基购自北京陆桥技术股份有限公司;肠球菌显色培养基购自山东省青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒购自上海捷瑞生物工程有限公司;GelRed核酸染料、DL5000 分子标志物购自杭州擎科梓熙生物技术有限公司;药敏检测板购自上海星佰生物技术有限公司。
1.3 试验方法
1.3.1 大肠埃希菌和肠球菌的分离培养
将肛拭子接种于已灭菌的BPW 溶液中,在37 ℃条件下增菌12 h,用接种环取混浊的菌液分别划线于EMB 平板和肠球菌显色平板上,并置于37 ℃培养箱中培养16~24 h;从2 种选择性培养基上挑取可疑单菌落,再次划线于相应的选择性培养基上培养,然后挑取可疑菌落划线于LB 平板上。在37 ℃培养箱中培养16~24 h,再挑取单菌落纯化培养一次,最后刮取适当LB 平板上的菌落保存于装有20%丙三醇的冻存管中,于-80 ℃冰箱中保存。
1.3.2 细菌鉴定
将保存的细菌接种于LB 培养基上,并在37 ℃条件下培养16~24 h。使用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDITOF-MS)鉴定大肠埃希菌和肠球菌。先使用无菌牙签挑取单个菌落于靶板孔中,并涂抹均匀,随后在孔里滴加1 μL 70%甲酸,室温下静置至风干,再滴加1 μLα-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid, HCCA),室温条件下静置直至完全干燥,最后使用布鲁克高通量生物鉴定系统(Autoflex Speed)仪器中的MALDI Biotyper RTC 软件[13]进行质谱数据采集与分析。将鉴定的结果与数据库中的细菌图谱进行比较,得出的分数若大于2.0,代表鉴定结果可靠。
1.3.3 药物敏感性试验
将大肠埃希菌和肠球菌分别接种在LB琼脂培养基上进行纯培养,参照美国临床实验室标准化委员会(CLSI)的M100-S25文件[14]中推荐的微量肉汤稀释法,使用革兰氏阴性需氧菌药敏检测板测定大肠埃希菌对16种常见抗生素的药敏表型[15],包括氨苄西林(AMP)、奥格门汀(A/C)、庆大霉素(GEM)、大观霉素(SPT)、四环素(TET)、氟苯尼考(FFC)、磺胺异噁唑(SF)、复方新诺明(SXT)、头孢噻呋(CEF)、头孢他啶(CAZ)、恩诺沙星(ENR)、氧氟沙星(OFL)、美罗培南(MEM)、安普霉素(APR)、黏菌素(CL)、乙酰甲喹(MEQ)。使用革兰氏阳性需氧菌药敏检测板测定肠球菌对27 种抗生素的药物敏感性,包括青霉素(PEN)、奥格门汀(A/C)、红霉素(ERY)、克林霉素(CLI)、恩诺沙星(ENR)、氧氟沙星(OFL)、头孢噻呋(CEF)、头孢西丁(CFX)、磺胺异噁唑(SF)、苯唑西林(OXA)、万古霉素(VAN)、复方新诺明(SXT)、多西环素(DOX)、氟苯尼考(FFC)、泰妙菌素(TIA)、替米考星(TIL)、庆大霉素(GEN)、利奈唑胺(LZD)、杆菌肽(BAC)、四环素(TET)、吉他霉素(KIT)、黄霉素(FLA)、恩拉霉素(EDC)、喹烯酮(QCT)、那西肽(NOS)、阿维拉霉素(AVI)、弗吉尼亚霉素(VGM),其中后9种抗生素主要用于促生长。耐药折点参考CLSI(M100-S26、M45-A2、VET01-A4)制定的值。另外,大肠埃希菌对安普霉素和乙酰甲喹,肠球菌对克林霉素、氧氟沙星、头孢噻呋、头孢西丁、苯唑西林、复方新诺明、庆大霉素、杆菌肽、四环素、吉他霉素、黄霉素、恩拉霉素、喹烯酮、那西肽、阿维拉霉素、弗吉尼亚霉素等16种抗生素没有定义耐药折点。对于没有折点标准的,通过药物最小抑菌浓度(minimal inhibitory concentration,MIC)的分布图展示比较,并对计算出来的MIC50和MIC90值进行比较。菌株ATCC 25922和ATCC 29212分别作为大肠埃希菌和肠球菌的质控菌株。
2 结果与分析
2.1 大肠埃希菌和肠球菌的分离结果
从所有284份肛拭子样品中均分离出了大肠埃希菌和肠球菌,并通过飞行质谱鉴定方法对分离的大肠埃希菌和肠球菌进行了确认。所有的预测分值大于2.0,代表能够可靠地鉴定到种。所有分离的细菌经过飞行时间质谱采集的图谱与质控菌株图谱比较后发现一致性较高,结果可靠(图1)。
图1 质控菌株的基质辅助激光解吸电离飞行时间质谱鉴定图谱Fig.1 Identification spectra of quality control strains by MALDI-TOF-MS
2.2 大肠埃希菌的耐药情况
对金华市144 株大肠埃希菌进行药敏试验,结果如图2 所示,其中安普霉素和乙酰甲喹没有定义折点,不统计耐药率。大肠埃希菌对14 种抗生素的耐药率从大到小为四环素(87.5%)>磺胺异噁唑(81.2%)>复方新诺明(69.4%)>氨苄西林(66.7%)>氟苯尼考(56.9%)>大观霉素(52.8%)>庆大霉素(19.4%)>恩诺沙星(13.9%)>头孢噻呋(8.3%)=氧氟沙星(8.3%)>奥格门汀(6.3%)>头孢他啶(2.1%)>美罗培南(0.7%)>黏菌素(0%)。检测到1 株美罗培南耐药菌,未检测到对黏菌素耐药的大肠埃希菌(图2)。从MIC分布来看,144株大肠埃希菌的分布较广,其中磺胺异噁唑的MIC有74%(104/144)高于512,表现出较高的耐药水平,头孢他啶、美罗培南的MIC 分布在较低水平,黏菌素的MIC在小于2的范围内呈正态分布(图3)。
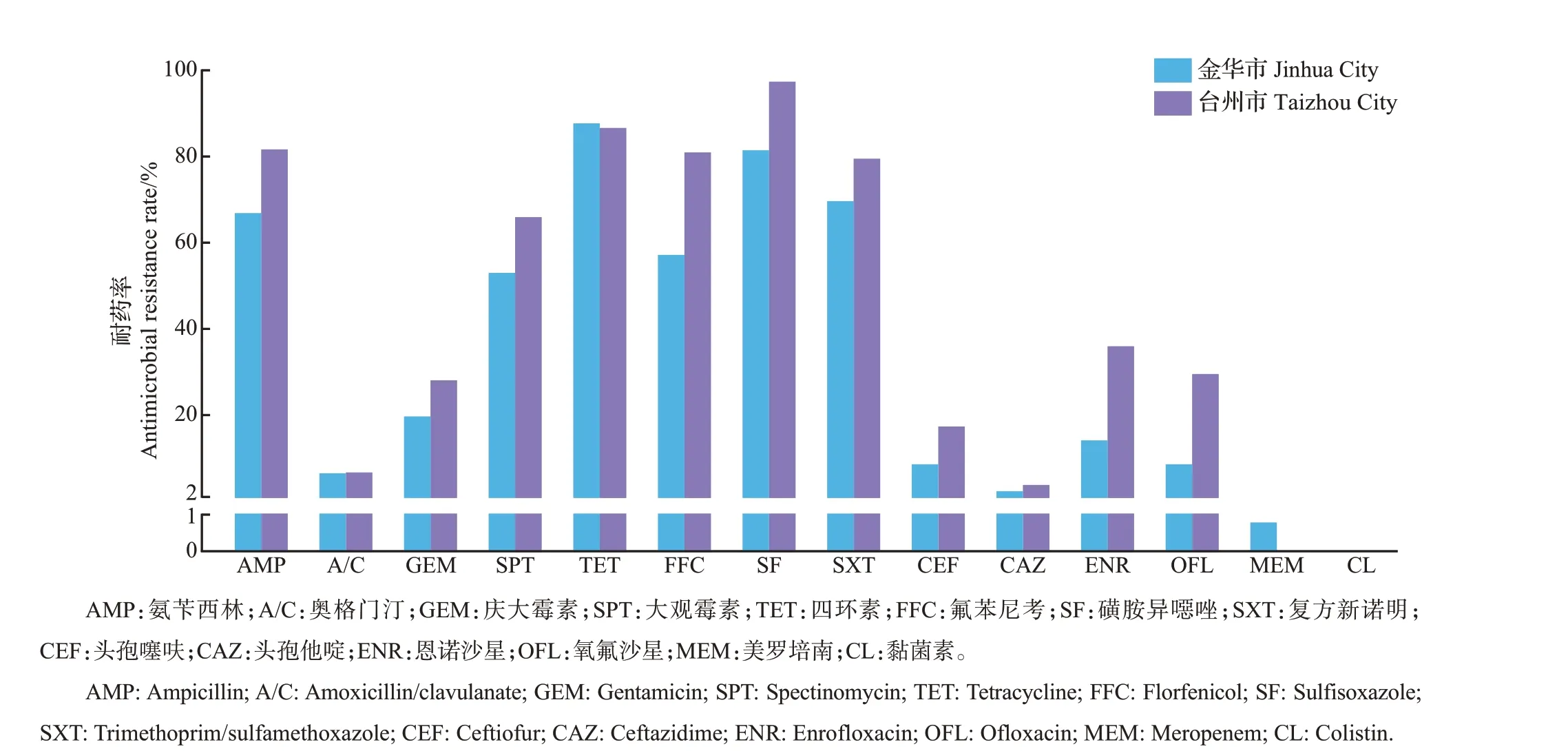
图2 金华市和台州市大肠埃希菌的耐药率比较Fig.2 Comparison of antimicrobial resistance rates of E.coli isolated from Jinhua City and Taizhou City
台州市140 株大肠埃希菌对14 种抗生素的耐药率从大到小排列为磺胺异噁唑(97.1%)>四环素(86.4%)>氨苄西林(81.4%)>氟苯尼考(80.7%)>复方新诺明(79.3%)>大观霉素(65.7%)>恩诺沙星(35.7%)>氧氟沙星(29.3%)>庆大霉素(27.9%)>头孢噻呋(17.1%)>奥格门汀(6.4%)>头孢他啶(3.6%)>美罗培南(0%)=黏菌素(0%)。美罗培南、黏菌素的耐药菌均未被检出(图2)。台州市大肠埃希菌对16 种抗生素的耐药性和MIC 分布情况与金华市相似,但是相比金华市显示出了更高的耐药水平。台州市大肠埃希菌对14种抗生素中的11种耐药率比金华市高,金华市大肠埃希菌仅对四环素和美罗培南的耐药率稍高于台州市。另外,从安普霉素和乙酰甲喹的MIC分布趋势来看,台州市的耐药水平稍高于金华市,其中从台州市分离的大肠埃希菌对安普霉素的MIC90是64,大于金华市的数值16(图3)。
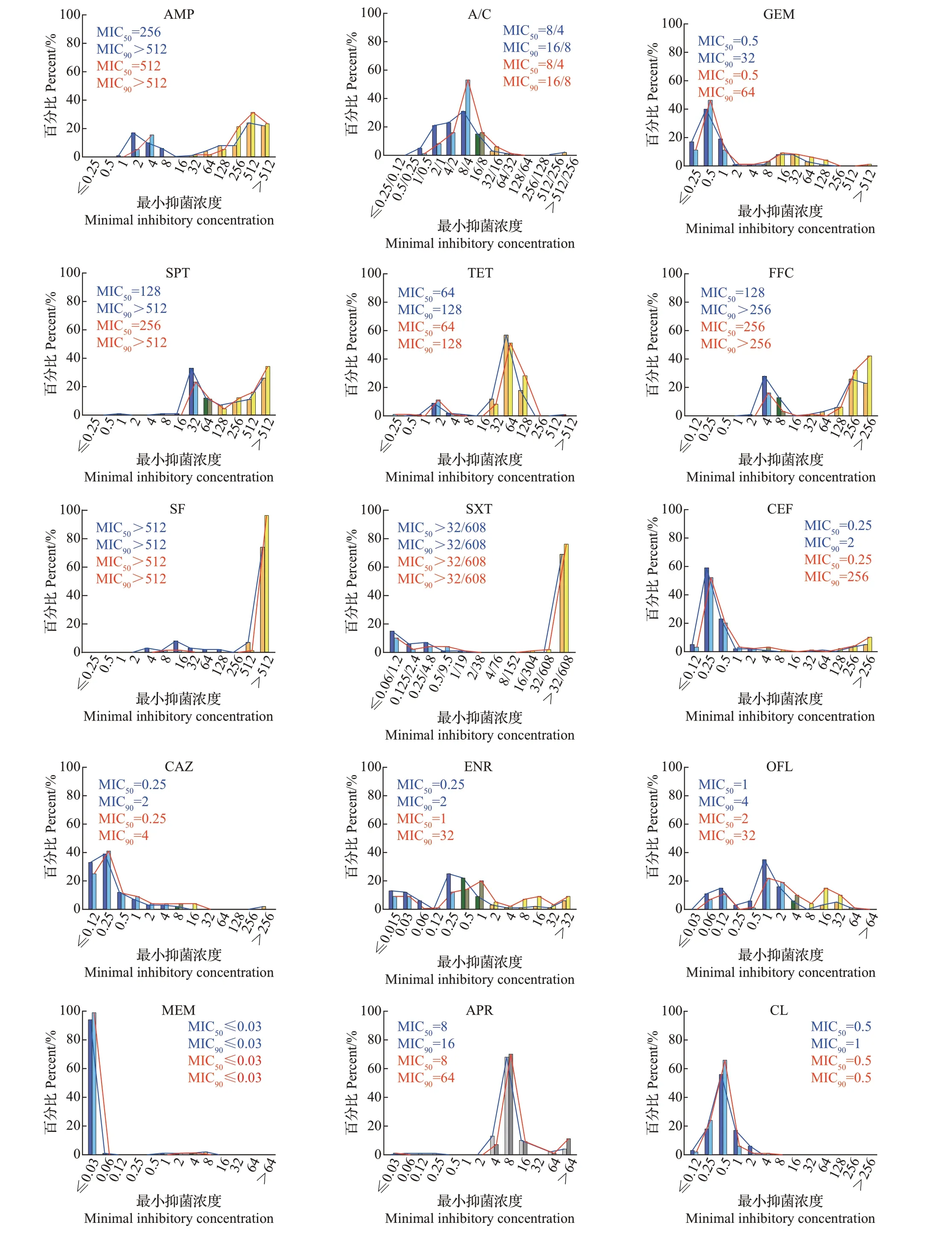

图3 金华市和台州市16种抗生素对大肠埃希菌的MIC分布Fig.3 MIC distributions of 16 antibiotics to E.coli isolated from Jinhua City and Taizhou City
2.3 肠球菌的耐药性情况
对金华市144 株肠球菌做了27 种抗生素的药敏检测,其中克林霉素、氧氟沙星、头孢噻呋、头孢西丁、苯唑西林、复方新诺明、庆大霉素、杆菌肽、四环素、吉他霉素、黄霉素、恩拉霉素、喹烯酮、那西肽、阿维拉霉素、弗吉尼亚霉素等16 种抗生素没有定义肠球菌的耐药折点,不做耐药率比较。肠球菌对其他11 种药物的耐药率从大到小排列为磺胺异噁唑(100.0%)>泰妙菌素(98.6%)>替米考星(97.9%)>红霉素(83.3%)>氟苯尼考(69.4%)>利奈唑胺(34.0%)>多西环素(27.1%)>恩诺沙星(22.9%)>万古霉素(0.0%)=青霉素(0.0%)=奥格门汀(0.0%)(图4)。从MIC 来看,多数抗生素的MIC分布范围较大,且部分抗生素的MIC已超出检测范围,尤其是磺胺异噁唑和喹烯酮;红霉素、克林霉素、苯唑西林、替米考星等抗生素的MIC 也有超过60%的菌株大于检测范围(图5),从MIC 的分布更能反映出肠球菌的高水平耐药性。
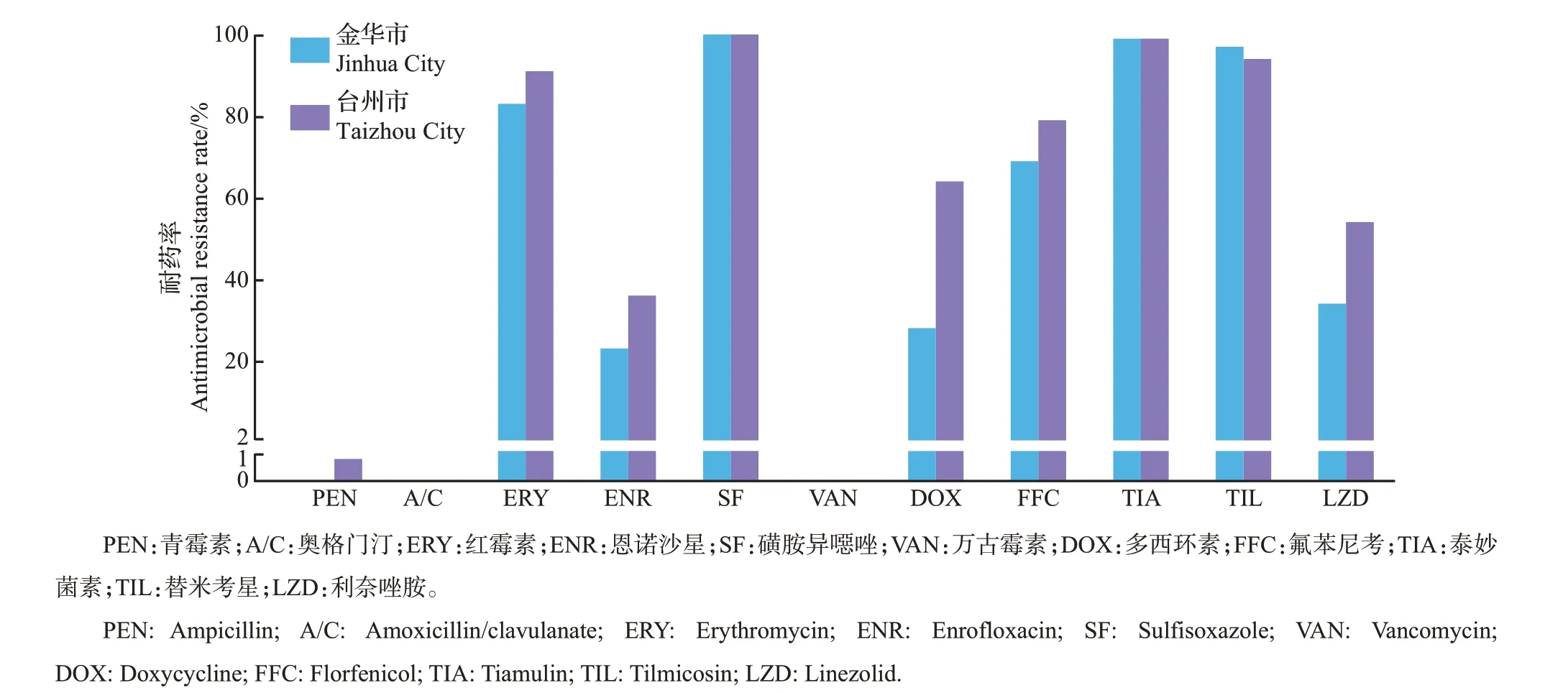
图4 金华市和台州市肠球菌的耐药率比较Fig.4 Comparison of antimicrobial resistance rates of Enterococcus isolated from Jinhua City and Taizhou City
台州市肠球菌的耐药率从大到小为磺胺异噁唑(100.0%)>泰妙菌素(98.6%)>替米考星(94.3%)>红霉素(91.4%)>氟苯尼考(78.6%)>多西环素(64.3%)>利奈唑胺(53.6%)>恩诺沙星(36.4%)>青霉素(0.7%)>万古霉素(0.0%)=奥格门汀(0.0%)。磺胺异噁唑和泰妙菌素依然是耐药水平最高的2种抗生素,除此之外,还发现了1株青霉素耐药菌株。相较于金华市,台州市肠球菌对多西环素、利奈唑胺和恩诺沙星的耐药率明显大于金华市。此次试验中没有发现奥格门汀和万古霉素耐药肠球菌(图4)。台州市肠球菌对抗生素的MIC分布与金华市比较接近,MIC 的分布都比较广泛。在耐药折点及以下,MIC呈正态分布,比如青霉素、奥格门汀、恩诺沙星、氧氟沙星和万古霉素。在相同的耐药率下,通过MIC 的分布可以看出,台州市的肠球菌对泰妙菌素耐药水平高。对于没有折点的抗生素,通过MIC的分布趋势和MIC50/MIC90可以比较耐药性水平。台州市的肠球菌对阿维拉霉素、弗吉尼亚霉素、氧氟沙星、头孢噻呋、头孢西丁和庆大霉素耐药水平高于金华市,而金华市的肠球菌对恩拉霉素的耐药水平略超过台州市(图5)。另外,即使所有菌株对万古霉素均敏感,通过比较MIC50也能发现,来源于金华市的菌株对万古霉素的耐药水平略高于台州市。
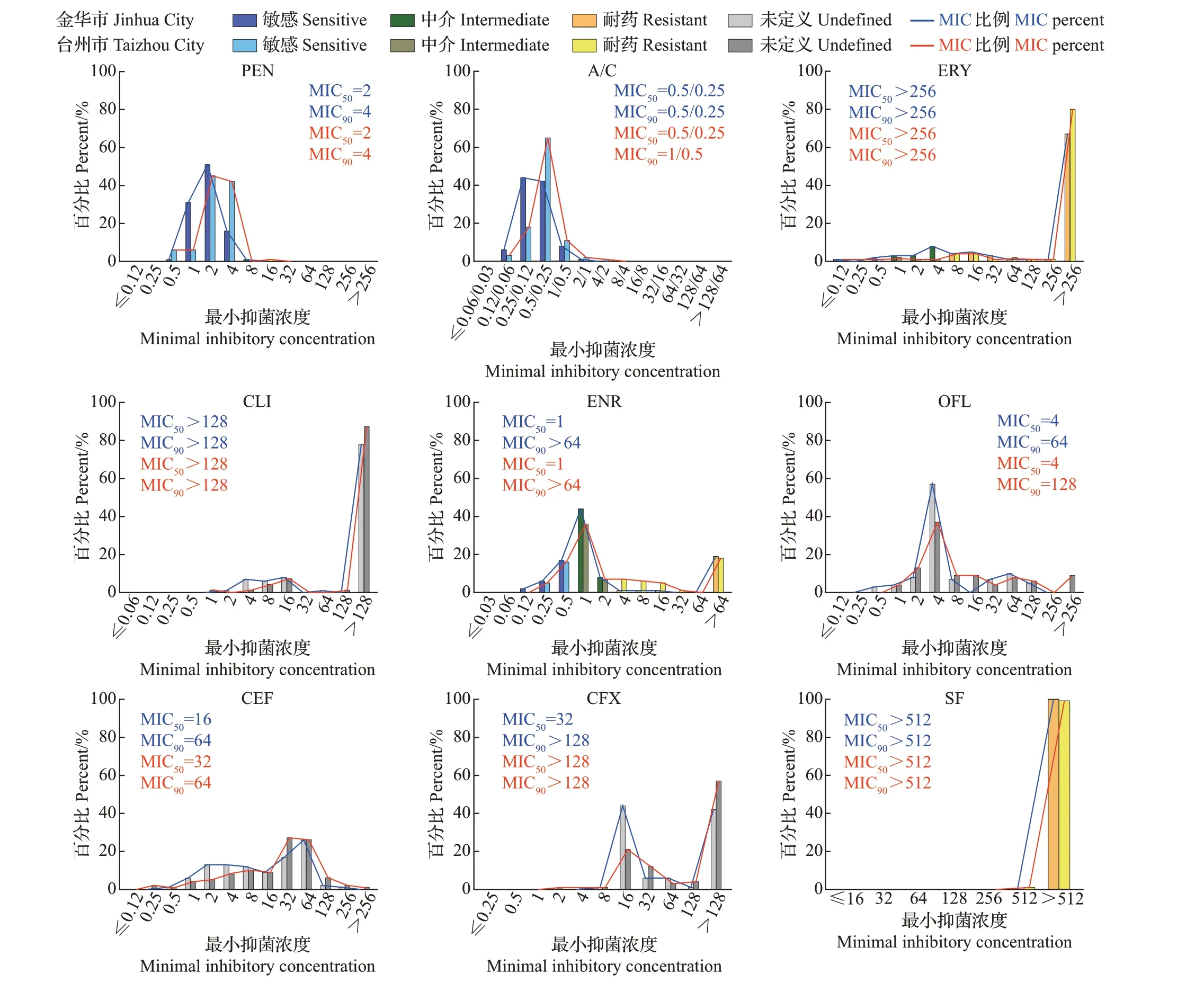
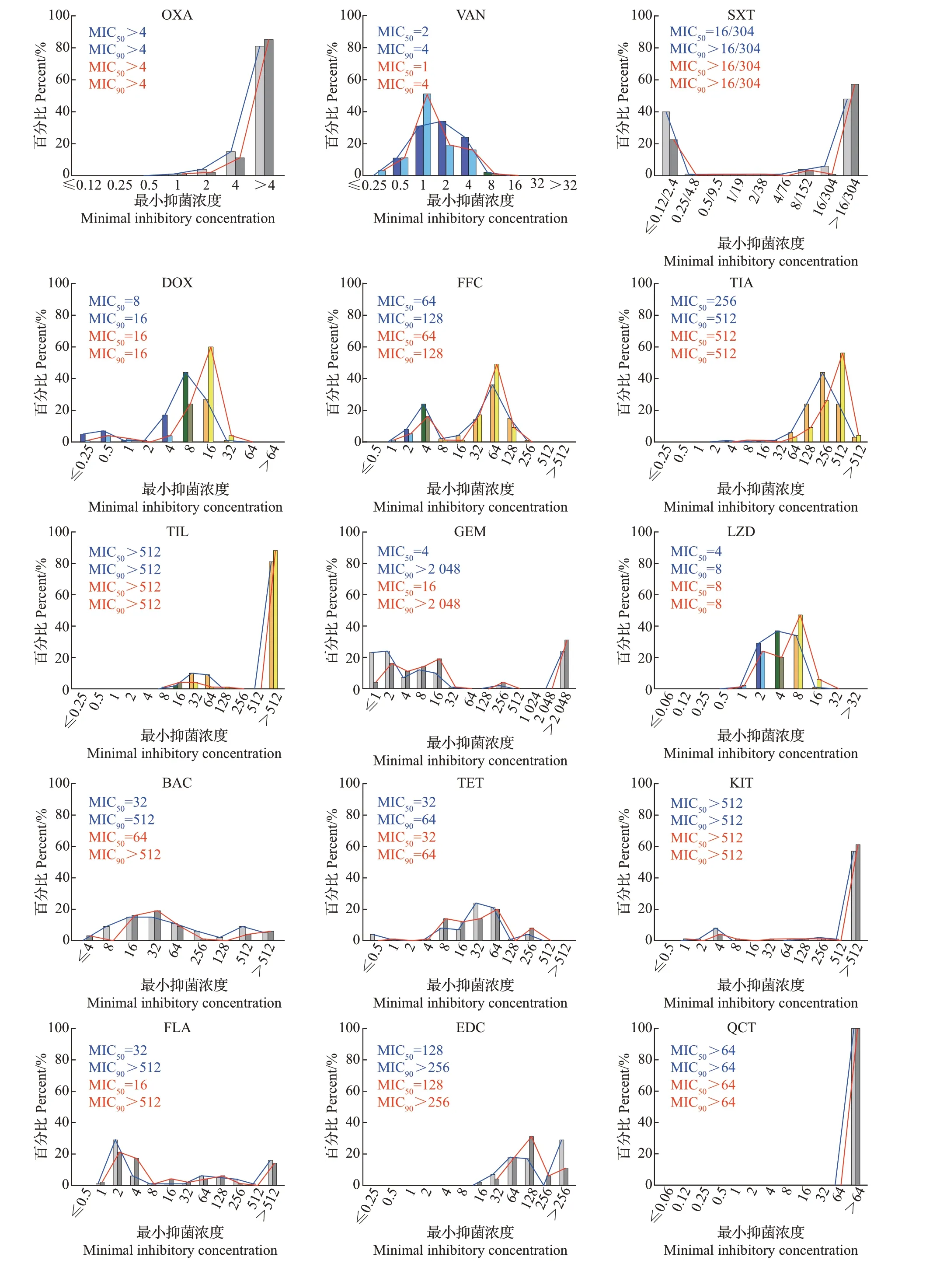
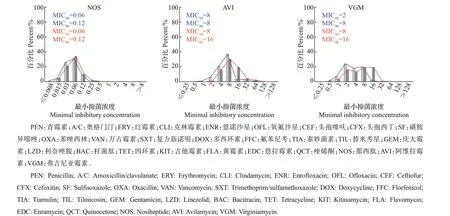
图5 金华市和台州市27种抗生素对肠球菌的MIC分布Fig.5 MIC distributions of 27 antibiotics for Enterococcus isolated from Jinhua City and Taizhou City
2.4 多重耐药性分析
对金华市大肠埃希菌的耐药谱分析发现,有3株大肠埃希菌对11 种抗生素同时耐药,仅有10 个菌株对全部抗生素敏感,耐药谱型共有40种(表1)。其中AMP-SPT-TET-FFC-SF-SXT 耐药谱型占比最高(16.0%),其次是AMP-TET-SF-SXT(7.6%)和AMP-GEM-SPT-TET-FFC-SF-SXT(5.6%)。另外,对台州分离的大肠埃希菌进行分析发现,耐药谱最广的3 种谱型可对11 种抗生素耐药,分别是AMPA/C-GEM-SPT-TET-FFC-SF-SXT-CAZ-ENROFL(0.7%)、AMP-A/C-GEM-SPT-TET-FFC-SFSXT-CEF-ENR-OFL(0.7%)、AMP-GEM-SPT-TETFFC-SF-SXT-CEF-CAZ-ENR-OFL(0.7%)。个数占比最高的耐药谱型分别是AMP-SPT-TET-FFCSF-SXT(23.6%)、SF(7.1%)和AMP-SPT-TET-FFCSF-SXT-ENR-OFL(6.4%)(表2)。2市的大肠埃希菌多重耐药情况较为普遍,但是台州市的耐药谱型更多(46 个),且未发现敏感菌株。77.8%金华市来源的大肠埃希菌抗3 类以上抗生素,而台州市则有84.3%的大肠埃希菌抗3 类以上抗生素。从耐药谱中可以发现,氟喹诺酮类药物恩诺沙星和氧氟沙星的耐药相关性较高,表现出同种药物的交叉耐药性。

表1 金华市大肠埃希菌的耐药谱Table 1 Antimicrobial resistance patterns of E.coli isolated from Jinhua City

表2 台州市大肠埃希菌的耐药谱Table 2 Antimicrobial resistance patterns of E.coli isolated from Taizhou City
金华市来源的肠球菌共有14种耐药表型,其中ERY-SF-TIA-TIL 耐药表型占比最高(31.0%),其次是SF-TIA-TIL 耐药表型(12.5%)。金华市有9株肠球菌最多同时对7 种药物耐药,耐药谱型为ERY-ENR-SF-DOX-TIA-TIL-LZD(表3)。而台州市的肠球菌共有17种耐药谱型,其中ERY-ENRSF-DOX-TIA-TIL-LZD(19.3%)和ERY-SF-DOXTIA-TIL-LZD(19.3%)耐药谱型个数占比最高,其次是ERY-SF-DOX-TIA-TIL耐药谱型(18.6%)(表4)。此次统计肠球菌具有耐药折点的抗生素共11个,相比大肠埃希菌耐药谱型较少,但是2市的肠球菌多重耐药率均达到97%以上,明显高于大肠埃希菌。
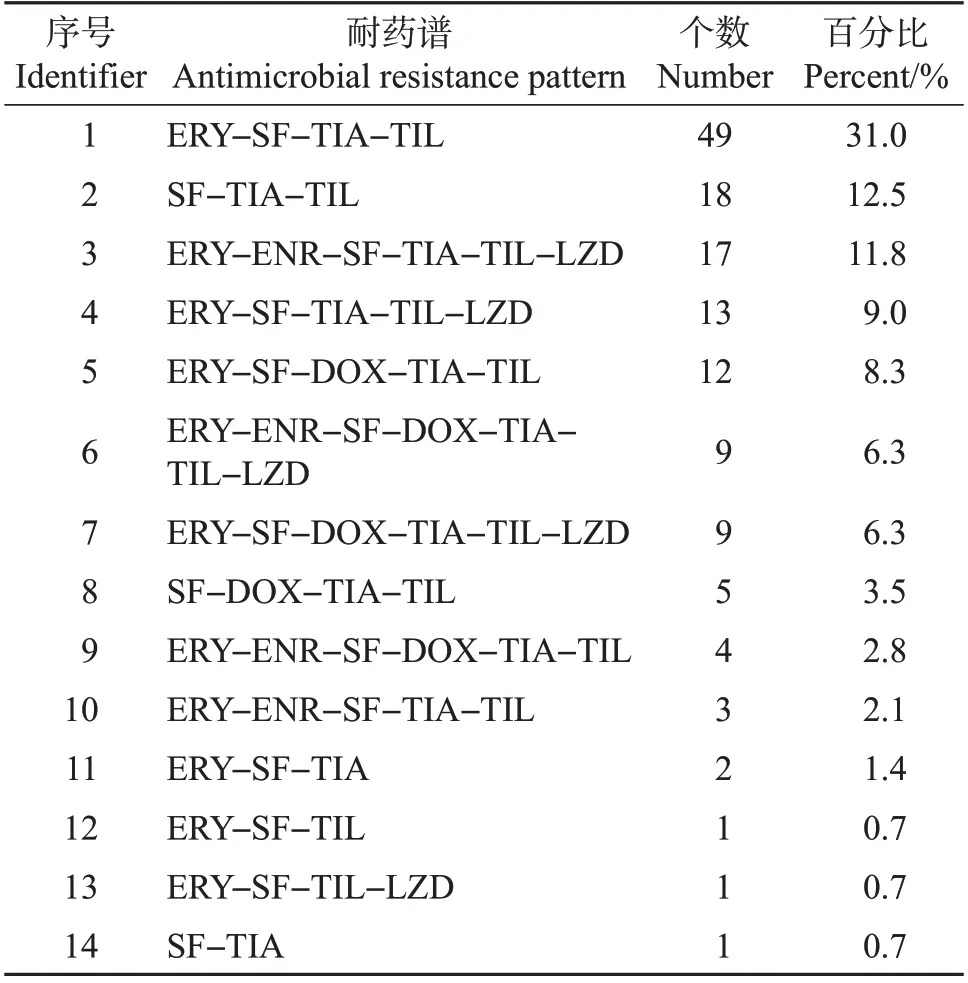
表3 金华市肠球菌的耐药谱Table 3 Antimicrobial resistance patterns of Enterococcus isolated from Jinhua City
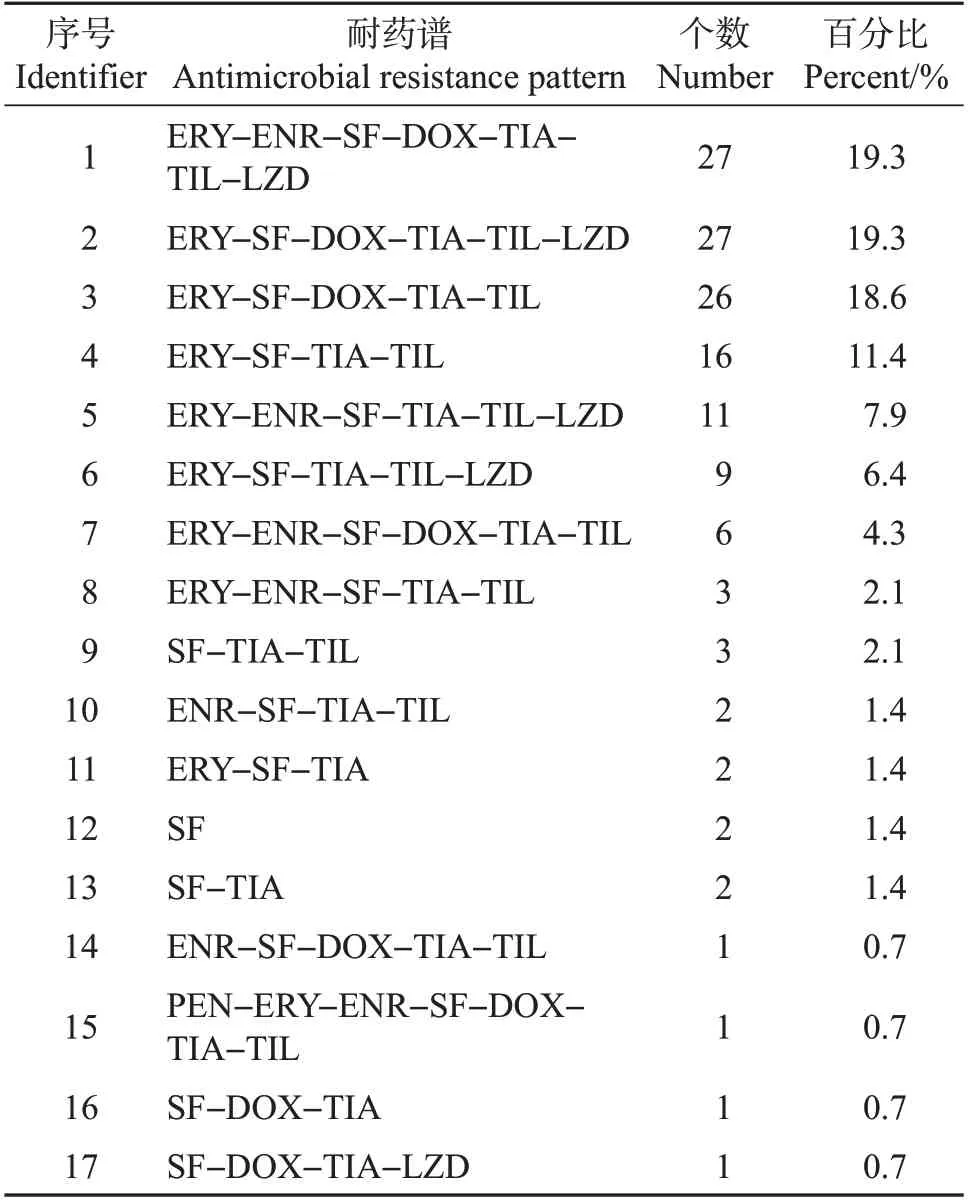
表4 台州市肠球菌的耐药谱Table 4 Antimicrobial resistance patterns of Enterococcus isolated from Taizhou City
3 讨论与结论
大肠埃希菌和肠球菌是条件致病菌,一般情况下不致病,但是可以作为耐药基因的“储存库”,是公共卫生安全的潜在威胁。本研究从金华市和台州市的畜禽肛拭子样本中共分离鉴定了大肠埃希菌和肠球菌各284株,二者的分离率均为100%。据报道,MALDI-TOF-MS 对细菌的鉴定已成为临床上新兴的、便捷的、准确的方法[13,16],本研究中对动物源细菌的鉴定采用这一方法是在农业领域中应用的有益尝试,可提高检测效率。从药敏检测结果看,2 种细菌耐药水平较高,耐药谱型较多,且多重耐药情况严重。其中大肠埃希菌最多对11 种抗生素具有耐药性,肠球菌最多对7 种抗生素具有耐药性。2市分离的大肠埃希菌均对磺胺异噁唑和四环素的耐药率最高,其次是复方新诺明、氨苄西林和氟苯尼考。肠球菌耐药率最高的是磺胺异噁唑和泰妙菌素,其次是替米考星和红霉素。据报道,中国畜禽养殖中使用量最多的抗生素是四环素类、β-内酰胺类、大环内酯类、酰胺醇类、磺胺及增效剂类等[17-18],本试验结果印证了动物源细菌的耐药性水平与抗生素使用量呈正相关的结论。
在畜禽养殖中禁止使用的药物,试验结果则显示出对其极低的耐药水平。美罗培南是一种用于临床治疗的碳青霉烯类抗生素,对产超广谱β-内酰胺酶和AmpC 酶的肠杆菌都具有优异的抑制作用[19]。本研究分离到1 株美罗培南耐药菌株,需要进一步试验研究其耐药基因类型及传播机制。黏菌素(多黏菌素E)属于多黏菌素类药物,是治疗碳青霉烯类耐药肠杆菌科细菌性疾病的有效抗生素。过去由于动物源细菌对黏菌素的耐药率持续上升[20],农业部于2017年禁止将多黏菌素类药物用于促生长使用,随后细菌对其耐药率不断下降[21]。FANG等于2019年从浙江省106家屠宰场的猪肉样本中未分离到黏菌素耐药大肠埃希菌[22],而此次试验也未分离到黏菌素耐药菌株,符合耐药率下降预期。这说明对兽用抗生素的管控,是控制细菌耐药性的有效方法[23]。
此次试验对2 市的动物源细菌耐药性进行监测,是在同一时间对相同养殖类型和数量的养殖场进行采样,并使用统一的药物敏感性检测方法,是对市(县)级动物源细菌耐药水平进行评估和差异比较的有益尝试。本研究从耐药率、MIC 分布、耐药谱型等方面进行了细菌耐药性水平比较,并发现台州市的大肠埃希菌和肠球菌分离株菌各方面反映的耐药水平均高于金华市。在此次试验中,将MIC分布情况进行量化分析,在没有耐药折点国际标准的情况下,可为耐药性水平的评估提供参考,相比耐药率数据更加准确全面;也可为下一步的耐药折点制定提供依据。综上所述,建议政府部门应加强兽用抗生素的管控和细菌耐药水平的监测力度,促使养殖户规范使用抗生素,使细菌耐药性问题得到控制。
