基于RTCA技术的复方丹参片体外溶出与一致性评价研究
2021-11-02周悦马晓斐马丽霞张佳庄欣雅余亦婷张倩董洁陈军严国俊
周悦,马晓斐,马丽霞,张佳,庄欣雅,余亦婷,张倩,董洁,陈军,严国俊
(南京中医药大学药学院,江苏 南京 210023)
中药固体制剂的体外溶出评价是制剂处方、工艺条件等一致性评价的可靠方法,也是制剂批内、批间质量一致性评价的公认方法[1]。与化学药品质量控制不同,对于中医药理论指导下的中药,特别是复方制剂,药效是由多种成分共同协作的结果,若以其中一种或几种指标性成分作为检测对象,都难以反映中药复方的整体性,也难以完全代表中药制剂的质量与药效,因此有必要改善和更新固体制剂溶出度的考察标准和方法[2-3]。而生物活性检测是一步到位直接考察药物安全性与有效性的质量控制方法,以生物效价作为中药溶出度的检测方法已经成为研究发展的新趋势[4-6]。
生物活性测定法从中药的生物效应出发,能够反映中药的临床活性,可以用于中药的质量控制与评价。本实验以复方丹参片为模型药,依据大鼠心肌细胞(H9C2)对复方丹参片不同时间的溶出液呈现浓度梯度依赖[7],利用RTCA技术实时监测不同时间溶出药液的细胞动态变化[8],获得时间剂量依赖性细胞反应曲线(Time-dose-dependent cell response curves,TCRPs),建立一种以细胞指数(Cell index,CI)为指标的细胞生物效应溶出动力学模型,并与紫外分光光度法检测的溶出度结果进行相似性评价。该法从中药的整体效应出发,弥补了化学成分与临床疗效或毒性关联性小的缺陷,对于中药固体制剂溶出度评价研究提供了新的方法,也为中药的质量一致性评价提供新的思路。
1 材料与方法
1.1 实验仪器
85-2型恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);RC-3溶出度测试仪(天津新天光公司);UV-2401紫外可见分光光度计(日本岛津公司);HH-4数显恒温水浴锅(常州国华电器有限公司);FA1104N型电子分析天平(上海精密科学仪器有限公司);MZY-U20V超纯水机(南京妙之仪电子科技有限公司);RTCA实时无标记细胞分析仪(杭州艾森生物有限公司);Sorvall ST16R台式高速冷冻离心机;Sorvall ST16R台式低速离心机(美国Thermo公司);3111型CO2培养箱(美国Thermo公司);涡旋振荡仪(美国Bio-Rad公司);ECLIPSE Ti-S型倒置显微镜(日本Nikon公司);1300 SERIES A2生物安全柜(美国Thermo公司)。
1.2 药品与试剂
复方丹参片(云南白药基团股份有限公司,批号:ZMC1712);复方丹参片(广州白云山和记黄埔中药有限公司,批号:J19A004);复方丹参片(广西药用植物园制药厂,批号:180501-066);盐酸(AR,莱阳精细化工厂,批号:20110219);胰蛋白酶溶液(Gibco公司);RTCA板(杭州艾森生物有限公司);DMEM培养基(Corning公司)。
1.3 细胞
大鼠心肌细胞(H9C2细胞)购自中国科学院上海细胞库。
1.4 复方丹参片溶出度供试样品的制备
1.4.1 不同溶出时间样品 取空白人工胃液1 000 mL置于溶出杯中,加热至37 ℃,调节转篮转速为100 r·min-1,将精密称定质量的复方丹参片分别放入转篮内,以空白人工胃液接触药片时为零时刻开始计时,按10、20、30、40、50、60、70、80 min定时取样,每次取样10 mL(立即补充同温同体积的空白人工胃液)用微孔滤膜滤过,取续滤液即得。
1.4.2 完全溶出样品 另取复方丹参片10片,精密称定,计算出平均片质量(W),将称定的片剂研细,再精密称取相当于W的量,置1 000 mL烧杯中,置于恒温磁力搅拌器上,向烧杯内加入1 000 mL空白人工胃液,并以药片粉末接触人工胃液零时刻开始计时,在(37.0±0.5) ℃水浴中均匀搅拌2 h,取10 mL用微孔滤膜滤过,取续滤液即得。
1.5 大鼠心肌H9C2细胞培养
将复苏的H9C2细胞置于饱和湿度的细胞培养箱中,用含10%FBS的DMEM培养基,在37 ℃、5%CO2条件下培养细胞至85%融合度时,用0.25%胰蛋白酶消化传代,倒置显微镜中观察,取对数生长期的细胞,1 000 r·min-1离心5 min,计数板下计数,调整细胞浓度至2×104mL-1用于细胞实验。
2 方法与结果
2.1 基于RTCA复方丹参片生物效应溶出度的测定
2.1.1 复方丹参片生物效应溶出方法学考察
2.1.1.1 精密度试验 取适量复方丹参片,置于研钵内捣碎,精密称取10、15、20 mg分别加入1 mL人工胃液中充分溶解,配制成10、15、20 mg·mL-1的储备液。经过稀释后,配成终浓度为0.6、1.0、1.4 mg·mL-1的药液。将0.6、1.0、1.4 mg·mL-13种样品分别在RTCA仪器中进样6次,同时监测这3种质量浓度的样品作用于细胞产生的CI值。经数据分析,计算得出每种样品的RSD。结果表明,3种质量浓度的样品在 0~64.24 h内细胞指数的RSD均小于3.0%,说明在0~64.24 h时间段精密度良好。
2.1.1.2 重复性试验 取复方丹参片适量,置于研钵内捣碎,精密称取15 mg,平行6份,用1 mL人工胃液溶解,分别配制成储备液15 mg·mL-1,再进行稀释最终配成浓度为1.0 mg·mL-1的药液,分别进样,进行细胞指数的测定,计算出6份平行样品在不同时间点的RSD。结果表明,样品在0~48.23 h内细胞指数的RSD均小于3.0%,说明在0~48.23 h时间段重复性良好。
经过复方丹参片生物溶出方法学的考察,综合数据可知,0~48 h是细胞指数最佳的选择范围。
2.1.2 基于RTCA测定不同时间溶出样品的TCRPs 在细胞检测板的每个小孔中先加入50 μL生长介质,再加入密度为2×104mL-1的特定细胞悬液100 μL。将此细胞检测板在室温下放置30 min后,放到培养箱中连续培养。20~24 h后,当细胞数量稳定时,取H9C2细胞的细胞检测板,除对照组外,换液并向每孔中加入“1.4”项下的不同时间点的溶出药液样品和完全溶出样品50 μL,每个溶出样品设3个复孔。将加好样的检测板放入实时细胞电子分析仪中,继续检测72 h,测得各样品溶液作用于H9C2细胞后所产生的细胞指数,从而获得各个样品的TCRPs曲线(图1~3)。

图1 批号ZMC1712复方丹参片溶出样品的TCRPs曲线
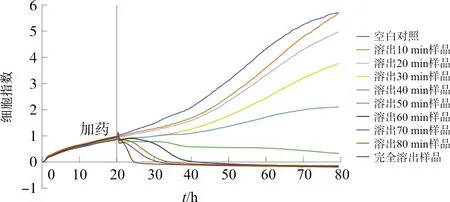
图2 批号J19A004复方丹参片溶出样品的TCRPs曲线

图3 批号180501-066复方丹参片溶出样品的TCRPs曲线
由不同时间溶出样品的TCRPs曲线数据可知,加入不同时间溶出样品后细胞会出现不同趋势的生长状态变化,加药前CI稳定上升,加药后不同样品的CI出现大幅度的变化,溶出时间短的样品组CI呈现稳定上升趋势,溶出时间长的样品组CI持续下降。不同厂家的TCRPs曲线之间存在较大差异,加药后呈现稳定浓度梯度依赖性,选取各时间段RSD值最小进行分析。批号ZMC1712复方丹参片在加药后20.39~22.31 h时间段内细胞指数呈现稳定的质量浓度梯度依赖性,因此选取该段为分析的最佳时间段;批号180501-066复方丹参片在加药后24.36~26.40 h时间段内呈现稳定的质量浓度梯度依赖性,故选取该段为分析的最佳时间段;而批号J19A004复方丹参片在加药后,不同溶出时间样品之间的TCRPs曲线会出现短暂的交错状态,在32.14~34.14 h时间段内细胞指数也呈现出稳定的质量浓度梯度依赖性,因此选取该段为分析的最佳时间段。

图4 不同厂家复方丹参片的生物效价溶出度曲线
2.1.3 不同时间溶出样品的生物效价溶出度 选取具有稳定质量浓度梯度的细胞指数-溶出时间曲线,进行溶出度(Q)的计算,结果见表1~3。根据溶出度结果绘制不同批号的复方丹参片生物效价溶出曲线,见图4。
Q=(CIi-CIck)/(CI0-CIck)
CIi指各时间点溶出样品的CI值,CIck指不加药物时的CI值,CI0指药物完全溶出时的CI值。
2.2 利用紫外分光光度法测定复方丹参片溶出度
2.2.1 检测波长的选择 复方丹参片在(282±2) nm处有最大吸收[9],采用“1.4.2”项下复方丹参片完全溶出样品在200~400 nm处检测,在283 nm处有最大吸收,见图5,故选定283 nm为检测波长。
2.2.2 线性关系考察 量取“1.4.2”项下复方丹参片完全溶出样品适量,用人工胃液稀释成相对溶出量90%、70%、50%、30%、20%、10%的浓度系列,以人工胃液为空白,测定283 nm波长下的A值。以相对溶出量为横坐标(X),A值为纵坐标(Y),计算回归方程,回归方程为Y=0.024 2X-0.006 8,r=0.999 6。

图5 复方丹参片完全溶出样品的UV吸收光谱

表1 批号ZMC1712复方丹参片不同溶出时间点样品的CI值

表2 批号J19A004复方丹参片不同溶出时间点样品的CI值

表3 批号180501-066复方丹参片不同溶出时间点样品的CI值
2.2.3 稳定性试验 量取适量相对溶出量为50%的溶液,分别在0、2、4、8、10、12、24 h测定A值,考察溶液稳定性,结果RSD为1.81%,表明药液在24 h内稳定性良好。
2.2.4 精密度试验 量取适量复方丹参片完全溶出的药液,重复测定6次,记录下A值,求得样品的RSD为0.84%,表明该仪器精密度良好。
2.2.5 溶出度的测定 每次精密称取复方丹参片1片的质量为Wi,并按照“1.4.1”项下制备10、20、30、40、50、60、70、80 min的复方丹参片溶出样品微孔滤膜滤过,取续滤液用紫外可见分光光度计于283 nm处测定不同时间点溶出样品的A值(Ai);取复方丹参片10片,精密称定,计算出平均片质量(W),将称定的片剂研细,再精密称取相当于W的量,并按照“1.4.2”项下制备完全溶出样品,微孔滤膜滤过,取续滤液用紫外可见分光光度计于283 nm处测定A值(A0);按公式计算溶出度(Q),Q=(WAi/WiA0)×100%,结果见表4。根据结果绘制3个厂家的复方丹参片UV溶出度曲线,见图6。

表4 不同批号复方丹参片的紫外分光光度法溶出度结果

图6 不同厂家复方丹参片的UV溶出度曲线
2.3 考察复方丹参片生物效应溶出曲线与紫外溶出曲线的相关性
2.3.1 差异因子f1与相似因子f2差异因子f1是计算在每一时间点2个曲线差异的百分率(%),是2条曲线相对误差的衡量参数;相似因子f2为对偏差的平方和的平方根的倒数进行对数转换,为2条曲线溶出百分率(%)相似性的衡量参数。一般情况下,当差异因子f1值≤15且相似因子f2值≥50,则认为2条溶出曲线相似,反之,则认为不相似[10]。公式中Rt和Tt分别代表参比制剂和受试制剂在时间t的释放度,n为时间点的个数(公式如下)。

图7 不同厂家复方丹参片生物效价溶出曲线 与紫外溶出曲线
利用DDSolver软件[11],以紫外溶出曲线作为参比制剂,生物效价溶出曲线作为受试制剂,将对应数据输入软件,可快速获得3批复方丹参片生物效价溶出曲线与紫外溶出曲线的差异因子f1和相似因子f2的结果,2种方法的溶出曲线见图7。
经分析,批号ZMC1712、批号J19A004和批号180501-066复方丹参片生物效价溶出曲线与紫外溶出曲线的差异因子f1分别为12.08、8.17和7.30,均小于15;相似因子f2分别为55.97、62.49和61.61,均大于50。结果表明同一厂家的复方丹参片生物效价溶出曲线与紫外溶出曲线基本相似。
2.3.2 溶出动力学模型拟合 目前常用的溶出速率模型有零级模型、一级模型、Weibull模型等,其中零级模型考察是否恒速释药,一级模型考察是否非恒速释药,Weibull模型几乎适用于所有溶出曲线。采用DDSolver软件对2种评价方法下的溶出曲线进行零级模型、一级模型及Weibull模型拟合,拟合结果见表5。并求出各批次最佳模型的溶出参数,累积释放率T25,用于考察药物是否有突释;T50和Td用于确定药物的释药特性;T80用于考察释药是否基本完全,结果见表6~7。

表5 复方丹参片溶出模型拟合结果

表6 批号ZMC1712和180501-066复方丹参片

表7 批号J19A004复方丹参片零级模型拟合溶出参数
从拟合结果看,批号ZMC1712和180501-066复方丹参片紫外分光光度法与生物效价的溶出曲线均对Weibull模型拟合度更佳;批号J19A004复方丹参片紫外分光光度法与生物效价的溶出曲线的最佳拟合模型为零级速率模型,说明其溶出规律为恒速释药。结果表明不同厂家之间最佳拟合模型不一致,不同厂家之间存在质量差异。最佳模型的溶出参数结果可知,各批号的复方丹参片无突释情况;同一厂家2种评价方法下的T50和Td差异性并不大;T80基本完全溶出时间比较:批号J19A004>批号180501-066>批号ZMC1712,批号J19A004复方丹参片完全溶出最慢,而批号ZMC1712复方丹参片完全溶出最快。
由上述紫外吸收和细胞生物效应为指标的溶出度差异可看出,不同厂家生产的同一规格的复方丹参片,其体外溶出行为差异较大,可推断其体内释放行为和药效差异也不可避免的具有差异,一致性较差。中药制剂的质量一致性影响因素众多,与中药原料、饮片炮制、提取纯化工艺,成型辅料及工艺等都密切相关,需要全过程标准化控制,保障中药品质完整一致的传递,最终才可形成质量和疗效一致的中药制剂。
4 讨论
溶出度试验是中药固体制剂质量控制的有效手段,但评价方法常以单一或多个活性成分作为研究对象,未能体现中药多成分、多环节、多靶点的特征,并不能获得中药质量评价的完整参数,缺乏科学性与整体性。若以单一的化学成分溶出曲线衡量固体制剂的质量仍然可能存在不足,甚至会与药物的真正疗效出现偏离。生物效应评价法是继性状评价、化学评价之后,推动中药质量标准走进临床、关联疗效的有效途径和手段,特别适用于结构复杂或理化方法不能测定其含量,或者理化测定不能反映其临床生物活性的药物,主要表现在具有较强的专属性、直接关切中药有效性与安全性、简单快速,符合中药物质基础研究现状,在中药质量控制和评价中具有独特的优势。该方法可以在不以化学成分为目标的基础上,从整体出发,对中药固体制剂进行溶出动力学的评价。
本实验以复方丹参片作为多成分的化学集合体,将此集合体作用于H9C2细胞群落,药物作用于细胞会产生可定量的电信号,利用RTCA实时检测获得CI,并得到以CI为指标的生物效应溶出曲线。与传统检测细胞增长率的方法比较,RTCA具有动态、实时、高效、免标记等优点,能真实反映药物作用于细胞的动态过程。
与单个或多个化学成分评价相比,紫外光谱将中药或中药复方的各类化学成分相互叠加,是化学成分相互作用的总和,一定程度上可以反映中药的“整体”信息。结果显示,不同厂家复方丹参片溶出样品之间的TCRPs曲线具有差异性,不同厂家之间的生物效价溶出曲线也有明显区别。相似因子法便于计算,但未考虑数据的变异性,易受溶出时间点数目的影响,具有一定的局限性。因此补充了差异因子法和模型依赖法,对2种评价方法进行相似性研究。将生物效应评价法与紫外分光光度法的溶出结果进行比较,同一厂家的复方丹参片生物效价溶出曲线与紫外溶出曲线均具有相似性,且最佳拟合模型一致;不同厂家之间最佳拟合模型不一,且溶出参数存在差异,与紫外分光光度法溶出结果一致,生物效应评价法也可以说明不同生产厂家之间质量存在差异性,结果表明基于RTCA建立的复方丹参片细胞指数溶出度模型具有可行性。从中药的生物效应出发,建立符合中医整体观的中药固体制剂细胞生物效应溶出度评价方法,可以弥补单一化学成分评价的缺陷,保证质量与有效性一致,为中药复方制剂的一致性评价提供新的思路和方法。
