驼源肠道外致病性大肠杆菌分离鉴定及生物学特性分析
2021-10-30樊嘉琦马维武周学章宁夏大学西部特色生物资源保护与利用教育部重点实验室宁夏银川750021
樊嘉琦,马维武,周学章 (宁夏大学 西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021)
肠道外致病性大肠杆菌(extraintestinal pathogenicE.coli,ExPEC)是一类能在肠道内无症状定殖,但能引起机体其他组织器官感染的病原体,它能吸收宿主体内的营养物质,且能逃逸宿主的免疫防御[1-2]。最初,ExPEC仅见于尿路感染、新生儿脑膜炎和败血症中,但后续研究发现其可在宿主多种部位引起感染,于是 RUSSO等[3]在2000年最先将这类能引起肠外疾病的非共生性大肠杆菌称为ExPEC。分子生物学研究发现,ExPEC含有iutA(螯铁蛋白受体)、papA/papC(P菌毛)、afa/dra(Dr抗原结合位点)、sfa/foc(S和F1C菌毛)、kpsMTⅡ(Ⅱ型荚膜多糖)5种毒力基因。PEIRANO等[4]证实含有2种及2种以上毒力基因便可确证为ExPEC。近年来,ExPEC引发的多种疾病已给畜牧业造成严重的经济损失,其携带多种毒力基因,呈现多重耐药性,且能造成人畜传播,对人类健康存在潜在威胁[5-6]。研究发现,ExPEC可导致猪、鸡、貂、羊、狐狸、华南虎和虎鲸等动物发病,但在双峰驼中的相关研究未见报道。本试验为查明内蒙古阿拉善双峰驼群体性死亡的原因,采集死亡双峰驼脏器,进行病原菌分离鉴定及生物学特性分析,测定菌株耐药性,检测毒力基因,为及时治疗发病双峰驼提供用药方案,也为该地区双峰驼的疫病防控提供科学依据。
1 材料与方法
1.1 病料来源及其疾病发生背景内蒙古阿拉善左旗属温带荒漠干旱区,典型的中温带大陆气候,以风沙大、年降雨量低、日照充足、年蒸发量高为主要特点。2018年9月,该地区异常连续降雨,在低洼地区形成积水。阿拉善左旗饲养的8 600多峰双峰驼,在饮用积水后有740峰发病,l04峰死亡。发病双峰驼的临床症状为腹胀,腹泻,呕吐,眼结膜充血,体温升高至40℃左右,呼吸加快且沉重。发病双峰驼大多在72 h内死亡。对死亡双峰驼进行病理解剖发现,瘤胃内有污黑色酸臭液体;真胃黏膜充血、出血;小肠出血;肠淋巴肿大;肝肿大,有点状出血;肺脏充血,局部有出血点;肾皮质有出血点且肿大。采集死亡双峰驼肺脏、肝脏、肾脏、心脏和肠管等组织器官,进行病原微生物分离鉴定。
1.2 实验动物试验用鼠为6周龄昆明小鼠,体质量约为20 g,购自宁夏医科大学实验动物中心。
1.3 主要试剂营养肉汤琼脂、LB肉汤、哥伦比亚血琼脂、伊红美蓝琼脂培养基、胰蛋白胨大豆琼脂(TSA Agar)、琼脂粉购于青岛高科技工业园海博生物技术公司;药敏纸片购于杭州微生物试剂有限公司;5种肠道内致病性大肠杆菌核酸检测预分装试剂盒购于深圳生科原生物有限公司。
1.4 样品的处理以及病原菌的分离无菌采集死亡双峰驼的肺脏、肝脏、肾脏、心脏、肠管等组织器官样本,分别接种于营养肉汤琼脂平板,于37℃培养。
1.5 革兰染色和菌落形态观察革兰染色后观察细菌的形态及颜色,分别涂布于LB琼脂培养基、伊红美蓝琼脂培养基和哥伦比亚血平板,在37℃培养18~24 h。
1.6 生化鉴定挑取单菌落,用生理盐水调节麦氏比浊度至0.5,加入生化鉴定板中,使用全自动细菌生化鉴定仪进行鉴定。
1.7 分离菌的型别划分和鉴定分离株经培养后提取DNA,按照5种肠道内致病性大肠杆菌核酸检测预分装试剂盒(荧光PCR法)说明书进行PCR反应,反应条件:95℃ 10 min;95℃ 30 s,63℃ 30 s,72℃ 90 s,30个循环;72℃ 5 min。
1.8 菌落基因组测序提取菌株的基因组DNA,经琼脂糖凝胶电泳检测后,送北京百迈客生物科技有限公司进行测序。
1.9 菌落16S rRNA序列分析提取菌株的基因组DNA,PCR扩增16S rRNA基因,PCR产物经琼脂糖凝胶电泳检测后,送生工生物工程(上海)有限公司测序。对测序结果进行BLAST分析并构建该病原菌系统进化树及同源性图。
1.10 动物回归试验用无菌生理盐水将细菌悬液调整至3×108CFU/mL。随机选取体质量为(20±5) g 的12只健康小鼠,试验组6只,对照组6只。试验组小鼠腹腔注射0.25 mL(10 g)菌液,对照组小鼠注射等量生理盐水。正常条件下饲养并观察小鼠活动情况,解剖死亡小鼠,并取其内脏器官进行病理观察。
1.11 菌株药物敏感性试验将菌株涂布于LB平板,无菌条件下将药敏纸片(分别包括氯霉素类、β-内酰胺类、氨基糖苷类、四环素类、磺胺类、喹诺酮类和多肽类等20种药物)贴到LB平板上,置于37℃培养箱培养。
1.12 耐药基因的检测根据药敏试验结果,对耐药基因进行初步判定和分析,参照文献[7-8]设计并合成耐药基因鉴定引物,提取细菌DNA和质粒进行检测。耐药基因包括基因sul-1、sul-2、aph(3) -2、aph(3)-1、qnrA、qnrB、qnrS、acc(6)-ib-cr、aac(3)-Ⅳ、aac(3)-Ⅱ、cmlA、floR、cat-1、SHV、CMY-2、CTX-M、CTX-M-3、TEM、tet(A)、tet(B)、tet(C)、tet(D)、tet(E)、ant(3')-Ⅰ。
1.13 重要毒力基因PCR检测参照文献[9-10],合成毒力基因的PCR引物,提取DNA和质粒进行检测。毒力基因包括irp2、fyuA、iucA、iucD、iutA、fimA、fimC、iss、hlyA、tsh、eaeA、vat、stx1、stx2、colV、colBM、hlyA、sheA、ehly和ehx。
2 结果
2.1 细菌的分离及培养特征对死亡双峰驼各脏器进行细菌分离,结果显示,在肝脏中分离出细菌(图1A),将分离出的菌株进行纯化,命名为M。通过染色和显微镜观察发现M为革兰阴性杆菌,形态均匀,末端圆钝,呈聚集或分散排列(图1E)。M在LB琼脂培养基上形成白色、圆形且光滑的菌落(图1B);在伊红美蓝培养基上菌落呈亮金属的光泽(图1C);在哥伦比亚血平板上出现溶血环(图1D)。

A.营养肉汤琼脂平板分离病原菌;B.病原菌在LB琼脂培养基的生长情况;C.病原菌在伊红美蓝琼脂培养基的生长情况;D.病原菌在哥伦比亚血平板的生长情况;E.病原菌革兰染色结果图1 M在不同培养基的生长情况及革兰染色结果
2.2 细菌生化鉴定结果全自动生化仪生化鉴定显示,M属于大肠杆菌属。D-山梨醇、D-海藻糖、β-半乳糖、乳酸盐产碱、D-葡萄糖、琥珀酸产盐碱、葡萄糖发酵、α-半乳糖苷酶、D-麦芽糖、D-甘露糖、D-甘露醇、鸟氨酸脱羧酶、赖氨酸脱羧酶、β-葡萄糖苷酸酶、O/129耐受和酪氨酸芳胺醇为阳性,其余为阴性。
2.3 5种肠道内致病性大肠杆菌核酸检测结果通过荧光PCR检测发现,PCR基线减去曲线拟合相对荧光单位的最大Ct值为7.04。M不属于肠侵袭性大肠杆菌、肠致病性大肠杆菌、肠产毒性大肠杆菌、产志贺毒素大肠杆菌和肠集聚型大肠杆菌中的任何一种。
2.4 基因组测序结果对菌株M基因组进行测序和分析发现其为大肠杆菌,基因总长度为4 768 782 bp。进一步分析其毒力基因,发现M含有832种毒力基因,且含有肠道外大肠杆菌特有的papA/papC、sfa/foc和kpsMTⅡ 3种毒力基因,充分证明菌株M为ExPEC。测序检测进一步发现该菌株含有氨基糖苷类、β-内酰胺类、氯霉素类、磺胺类、四环素类、多肽类等29种耐药基因。
2.5 大肠杆菌16S rRNA系统进化分析将菌株M的16S rRNA序列与GenBank中其他12株大肠杆菌的16S rRNA核酸序列进行对比,结果显示菌株M与其他大肠杆菌间的核苷酸同源性为93.4%~99.7%,其中与加拿大野猪源分离株(CP062901)、中国鸡源分离株(CP055259)、中国猪源分离株(CP047461)的序列同源性最高,达到99.7%,而与加拿大牛源分离株(GQ222405)、中国猪源分离株(KJ477007)的序列相似性最低,仅为93.4%。通过MEGA 7.0的Clusta W工具对齐后,利用Maximum-likelihood模型构建其系统发育树,同时使用SDT V1.2软件分析菌株M与其他12株大肠杆菌的序列相似性。系统发育树结果表明,菌株M与CP062901、CP055259、CP047461的同源相似性最高,属于同一遗传分支;与鸭源、人源、牛源、麋鹿源等其余9种大肠杆菌相似性较低,不属于同一分支(图2A);同源相似性结果表明,菌株M与CP062901、CP055259、CP047461相交的颜色最深,表明菌株M与这3株大肠杆菌的相似性最高(图2B)。

图2 16S rRNA基因的系统发育树(A)及同源相似性图(B)
2.6 动物回归试验结果注射菌液10 min后,与对照组相比,试验组小鼠更加亢奋,运动量明显增加。12 h后,试验组小鼠死亡5只,1只精神萎靡,行动迟缓,被触碰时无明显反抗动作,对照组小鼠无任何异常。对死亡小鼠进行解剖后发现,肺脏有明显出血并有轻微花斑,肝脏充血并且肿大,其余器官无明显变化(图3)。从死亡小鼠的肺脏、肝脏和脾脏组织中均分离出菌株M。

从左到右为肺脏、肾脏、脾脏、心脏、肝脏图3 死亡小鼠脏器
2.7 药物敏感性试验结果药物敏感性试验结果显示,分离株对头孢噻肟、新霉素、庆大霉素、丁胺卡那、多粘菌素、环丙沙星、氟氧沙星敏感,对阿莫西林、苯唑西林、氨苄西林、土霉素、四环素、多西环素/强力霉素、链霉素、磺胺嘧啶、复方新诺明、磺胺异噁唑/甲氧苄啶、恩诺沙星、氟苯尼考耐药。
2.8 基因组和质粒DNA的耐药基因检测结果分别以菌株M的基因组和质粒DNA为模板,对24种耐药基因进行PCR扩增。结果如图4所示,可以检测出磺胺类耐药基因sul-1、sul-2;β-内酰胺类耐药基因TEM、四环素类耐药基因tet(B)、氨基糖苷类耐药基因aph(3)-1和氯霉素类耐药基因cmlA、cat-1。
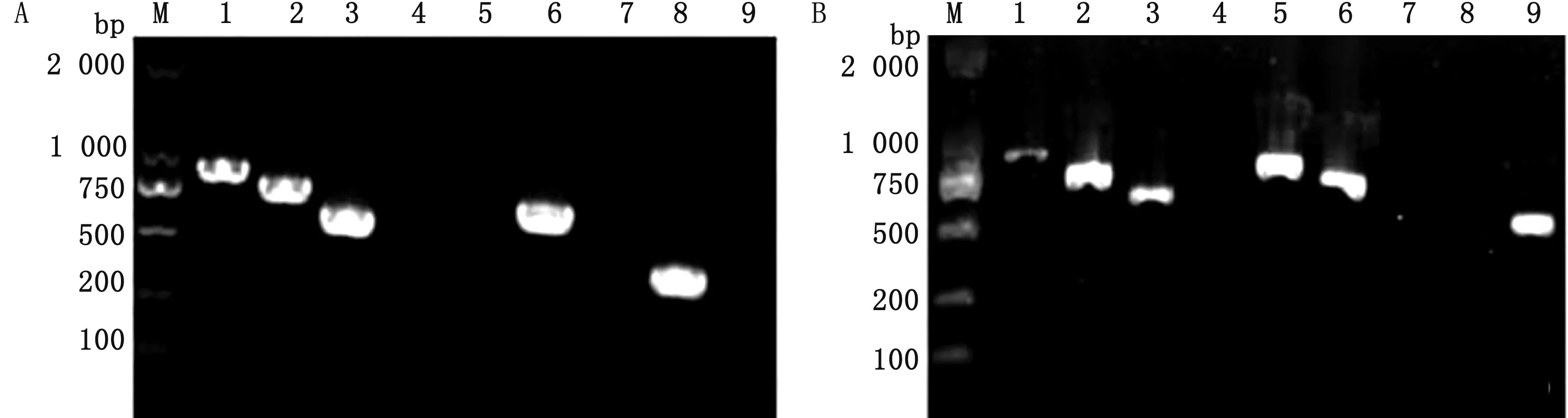
A.基因组DNA的PCR扩增结果;B.质粒的PCR扩增结果。M.DL2000 DNA Marker;1~9分别为TEM、tet(B)、aph(3)-1、aac(3)-1、sul-1、sul-2、qnrB、cmlA、cat-1图4 大肠杆菌分离株的耐药基因PCR扩增
2.9 基因组和质粒DNA的毒力基因检测结果分别以该菌株的基因组和质粒DNA为模板,对其毒力基因进行PCR扩增。结果如图5所示,在细菌基因组和质粒中都可以检测到HPI毒力岛基因irp2和fyuA,Ⅰ型菌毛基因fima和fimC,Iss蛋白基因iss,大肠杆菌素基因colBM、溶细胞素基因sheA以及气杆菌素基因iucA。
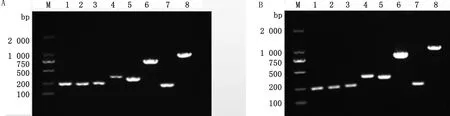
A.基因组PCR扩增结果;B.质粒PCR扩增结果。M.DL2000 DNA Marker;1~8分别为irp2、fyuA、iucA、fimA、fimC、iss、colBM、sheA图5 大肠杆菌分离株的毒力基因PCR扩增
3 讨论
根据临床特点和致病特性,ExPEC主要分为致肾盂肾炎大肠杆菌(UPEC)、新生儿脑膜炎大肠杆菌(NMEC)、禽致病性大肠杆菌(APEC)和败血性大肠杆菌(SEPEC)[8]。ExPEC是一种重要的病原菌,可导致人畜共患传染病,该致病菌可以穿透机体屏障,如NMEC能突破血脑屏障引起新生儿脑膜炎,部分APEC也能突破血脑屏障引起新生大鼠脑膜炎。ExPEC缺乏宿主特异性,可以跨种属传播,所以其危害程度远高于肠道内致病性大肠杆菌[6,11]。近年来,在动物体内ExPEC的分离率越来越高,通过对其血清型、多位点序列、外膜蛋白、核糖体基因和毒力因子分析,发现动物源ExPEC与人源ExPEC具有高度相似性(如人与家禽分离的ExPEC中ColV/ColBM质粒相似性极高)[5]。JOHNSON等[6]研究证实人的UPEC能跨越宿主屏障定殖于家养宠物体内。范克伟等[12]在急性死亡华南虎肝脏中分离出1株APEC,认为其有可能来自于饲喂的家禽。KRISHNAN等[11]发现APEC可在人类中引起感染,而人源ExPEC有可能在禽类中引起大肠杆菌病。DAIRA等[13]发现,因环境或食物的污染,虎鲸体内存在多重耐药和携带大量毒力基因的ExPEC,因此推测ExPEC可在不同宿主之间传播,环境和食物的污染可导致ExPEC的致病性越发增强。
本研究从死亡双峰驼肝脏中分离出1株革兰阴性菌,将其命名为M,生化鉴定发现该病原菌属于大肠杆菌属,测序结果表明菌株M中存在papA/papC、sfa/foc和kpsMTⅡ 3种毒力基因,属于ExPEC。对菌株M的 16S rRNA核苷酸序列进行同源性分析,发现其与加拿大野猪源分离株(CP062901)、中国鸡源分离株(CP055259)、中国猪源分离株(CP047461)的碱基替换率、序列同源性和遗传相似性最高;与中国人源分离株(KJ803886)的同源相似性为94.1%,证明菌株M具有成为人畜共患病原菌的可能性。菌株M与中国猪源分离株(KJ477007)、中国森林麋鹿分离株(JF690871)、美国狗源分离株(CP027104)的亲缘性相差较远,不属于同一遗传分支,说明菌株M并没有特定的地方区域性,其种属源性并不明显,双峰驼中致病菌的来源还需进一步调查。毒力基因检测发现,此次双峰驼体内分离出的ExPEC基因组和质粒中存在与铁元素摄取相关的irp2-fyuA、colBM、iucA基因,还含有帮助菌株免疫逃逸的基因、增强细菌在血清中生存能力的iss基因、与菌株定殖相关的fimA、fimC基因以及促进溶血的sheA基因。通过动物回归试验发现,菌株M的致病性强,定殖部位多,迁移能力强;死亡小鼠的肺脏、肝脏均有病变,死亡小鼠的肺脏、肝脏、脾脏组织中均可分离出菌株M。研究发现ExPEC中大多存在帮助菌株定殖、侵袭、免疫逃逸和铁元素摄取相关的毒力因子[2,14]。陈文静等[15]分离的65株鸭源ExPEC中,检出率为100%的毒力基因为ompA、lux、Spfs,检出率超过72%的毒力基因有iss、tsh、fimC。宋祥军等[16]分离出30株猪源ExPEC,其中vaT基因检出率最高,为70.0%,iutA的检出率为33.33%、kpsMⅡ的检出率为23.33%。马增军等[17]分离出5株猪源ExPEC,发现携带fyuA、ler和iutA基因的菌株致病性较强。 范克伟等[12]在华南虎中分离出1株具有较强致病能力的APEC,小鼠腹腔接种菌株,5 h内全部死亡,且小鼠的多种脏器均受到损伤。现如今,从我国不同动物体内分离出的ExPEC均携带多种毒力基因,这可能是导致ExPEC强致病性的原因之一。本试验获得的分离株具有强毒性和溶血性,对多种脏器造成损害可能是导致双峰驼死亡的原因。
本株ExPEC的耐药性强,药敏试验结果证明其对β-内酰胺类、四环素类、多肽类、氨基糖苷类、磺胺类、喹诺酮类、氯霉素类抗生素耐药;通过PCR试验发现,菌株携带TEM、tet(B)、aph(3)-1、aac(3)-1、sul-1、sul-2、qnrB、cmlA、cat-1耐药基因。近年来ExEPC多重耐药现象十分普遍,张炳亮等[18]发现河南猪源ExEPC耐药基因类型多而复杂,对7种常用抗生素的耐药率超过70%。李元珍等[19]在病人体内分离的85株ExPEC中,对1种或2种药物耐药的ExPEC占56.47%(48/85),多重耐药菌占43.53%(37/85)。通常因抗生素不合理使用才会引起大肠杆菌的多重耐药现象,但双峰驼是半野生养殖动物,养殖时不使用抗生素,本株ExPEC的耐药基因是如何获得的有待深入研究。ExPEC感染现在已成为一个严重威胁世界公共卫生的问题,ExPEC在尿路、腹腔内部的感染较常见,在肺部、血管、骨髓等部位的感染较为少见,本研究首次在双峰驼肝脏内分离出ExPEC[20]。刘璨颖等[21]纯化猪源ExPEC的外膜蛋白OmpC和OmpF,发现OmpC免疫原性较强,用其制作的亚单位疫苗可能成为猪源ExPEC的候选疫苗。最新研究发现一种来自于蛾类体内的抗菌肽可以消除UPEC的生物膜[22].发现盐酸玫瑰树碱能与大肠杆菌拓扑异构酶Ⅳ结合,明显降低ExPEC感染小鼠后的细菌滴度,降低炎症因子的表达。
本研究从死亡双峰驼病料中分离获得了1株致病性强、多重耐药的ExPEC。追溯双峰驼的养殖方式发现,双峰驼属于半野生养殖动物,9月份属于暖季放牧时期,双峰驼饮水量大,放牧时间长,偶遇恶劣天气时,双峰驼饮用野外洼地污水,可能因此导致感染ExPEC。本研究分离的ExPEC来源尚未明确,有待今后进一步的调查研究。
