西藏牦牛源沙门菌的分离鉴定及耐药分析
2021-10-30李天娇周赛赛斑马泽郎卢姊豪尹力鸿吕家煌赵晓慧索朗斯珠西藏农牧学院动物科学学院西藏林芝860000江苏省农业科学院兽医研究所江苏南京2008
李天娇,周赛赛,斑马泽郎,吴 丹,卢姊豪,尹力鸿,2,吕家煌,2,赵晓慧,李 霞,索朗斯珠* (.西藏农牧学院 动物科学学院,西藏 林芝 860000;2.江苏省农业科学院 兽医研究所,江苏 南京 2008)
沙门菌(Salmonella)属肠杆菌科沙门菌属,为革兰阴性短小杆菌。沙门菌血清型较多,国内常见血清型均具有一定致病性,可引发人畜共患病[1-2]。据国内外文献报道[3-11],沙门菌在禽类、家畜、宠物和野生动物中均有发现,并引发相关疫病;也常在食物及其原材料中存在,引起人类食物中毒[12-14]。同时,沙门菌呈全球性分布,由沙门菌引起的疫情曾在世界多国大规模暴发[15]。动物感染沙门菌常引发腹泻、肠炎、流产和败血症等疾病[16]。沙门菌的流行也严重威胁着牛群的健康:成牛感染沙门菌的临床特征表现为水样或血性腹泻,常伴有发热、食欲不振、精神沉郁等症状;犊牛感染沙门菌的死亡率远高于成牛[17]。
牦牛是生长于我国高海拔地区的独特物种,也是西藏当地牧民的主要经济来源之一,西藏更是我国牦牛的主产区之一[18]。沙门菌在牧区长期处于流行状态,主要通过粪口传播,加之牧区牦牛的养殖模式主要以放牧为主,因此环境中的水源和食物极易被污染,从而使其他健康牛也被感染患病,甚至死亡,严重影响牦牛及其产业的健康发展[19]。目前,国内外关于牦牛源沙门菌的研究报道较少,有关西藏地区沙门菌的研究更少[20]。因此本研究从西藏部分地区腹泻牦牛的粪便中分离沙门菌,并对其进行血清型分型、遗传进化分析、耐药表型和耐药基因分析,为西藏牦牛源沙门菌的防治、后续相关研究以及临床用药提供科学的指导。
1 材料与方法
1.1 样品本试验共采集西藏腹泻牦牛粪便91份,其中拉萨市44份、林芝市21份、那曲市26份,将采集的粪便样品编号后置于-80℃保存。
1.2 主要试剂BPW培养基、MRSV培养基、TSB培养基购自美国BD上海有限公司;SS培养基、BS培养基、TSI培养基、营养琼脂及12种抗菌药敏纸片购自杭州微生物试剂有限公司;革兰染色试剂盒购自青岛海博生物技术有限公司;TR101沙门菌属诊断血清试剂盒购自宁波天润生物药业有限公司;Premix TaqTM(TaKaRa TaqTMVersion 2.0)、DL2000 DNA Marker购自大连宝生物有限公司。
1.3 细菌分离纯化参照GB4789.4-2010[21]和LIU等[22]的方法对样品中的细菌进行分离鉴定。利用BPW培养基对粪便样品进行预增菌,在MRSV半固体培养基上对增菌液进行初筛,初筛后在SS琼脂和BS琼脂选择性培养基上复筛,对筛选出的单菌落进行革兰染色并镜检。
1.4 生化试验用纯培养的菌液转种TSI斜面培养基,37℃培养12 h后观察结果,判定标准见表1。

表1 沙门菌生化试验判定标准
1.5 特异性基因鉴定通过PCR技术检测分离菌株的特异性基因invA[23-24],利用引物序列:5′-GTGAAATTATCGCCACGTTCGGGCAA-3′;5′-TC-ATCGCACCGTCAAAGGAACC-3′对分离菌株进行PCR鉴定,通过1.0%琼脂糖凝胶对扩增产物进行电泳分析。
1.6 血清型检测沙门菌的血清型鉴定严格按照宁波天润生物药业有限公司提供的TR101沙门菌属血清诊断说明书操作,观察凝集的情况,记录结果。
1.7 药敏试验参照世界卫生组织(World Health Organization,WHO)推荐的K-B法进行该试验[36]。将纯培养菌液均匀涂布在营养琼脂上,将12种药敏片贴于平皿中央,于37℃倒置培养24 h。参照NCCLS(2013)公布的标准,根据抑菌圈大小,对结果做出判定,药敏结果判定标准见表2。

表2 药敏结果判定标准
1.8 耐药基因检测参考文献[26-29],选择与6类抗生素相关的15种耐药基因进行PCR扩增,引物序列见表3。

表3 沙门菌耐药基因扩增引物及相关信息
1.9 构建系统发育树对分离菌株的invA基因进行PCR检测后,回收特异性扩增片段,将之克隆至pMD18-T载体并进行测序。用NCBI网站在线BLAST程序对测序结果进行比对;利用MEAG 7.0软件,选取部分在GenBank已登录的序列进行比对并构建遗传进化树。
2 结果
2.1 细菌培养分离菌株在BS培养基上形成表面光滑、有金属光泽的黑色单菌落,同时也会形成另一种灰绿色菌落;在SS培养基上形成中心有黑点的无色单菌落;革兰染色的镜检结果显示其为革兰阴性短小杆菌(图1)。
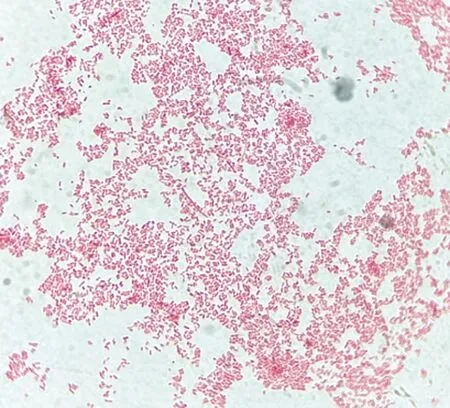
图1 西藏牦牛源分离菌株革兰染色镜检结果(1 000×)
2.2 生化鉴定11株分离菌株均能与三糖铁反应产生H2S,并生成黑色沉淀,能产气、产酸且具有动力,结果见图2。

图2 西藏牦牛源分离菌株生化试验结果
2.3 特异性基因鉴定对分离菌株invA基因进行PCR扩增,产物条带大小约280 bp,与目的条带大小一致,确定分离获得11株沙门菌,鉴定结果见图3,总检出率为12.08%(11/91),其中拉萨市3株、那曲市5株、林芝市3株,沙门菌地理位置占比见图4。

M.DL2000 DNA Marker;+.阳性对照;-.阴性对照;L1~L2.拉萨市样品;Z1~Z2.林芝市样品;N1~N2.那曲市样品图3 牦牛源沙门菌invA基因PCR扩增结果

图4 11株牦牛源沙门菌地理位置分布及占比
2.4 血清型鉴定血清型分型鉴定结果显示:都柏林沙门菌3株,占比27.18%(3/11);丙型副伤寒沙门菌3株,占比27.28%(3/11);伤寒沙门菌2株,占比18.19%(2/11);纽波特沙门菌、阿邦尼沙门菌以及肠炎沙门菌各1株,占比9.10%(1/11)。
2.5 药物敏感性试验由表4可知,分离菌株对6类药物均表现出不同程度的耐药,其中对β-内酰胺类药物的耐药率最高, 对AM、CAZ和CTX的耐药率均为81.82%(9/11),对CFZ的耐药率为72.73%(8/11);对喹诺酮类药物敏感性较高,对NA、CIP的耐药率均为18.18%(2/11)。林芝市分离的菌株耐药情况与其他地区相比较为严重(图5),分离菌株普遍存在多重耐药现象,普遍对3种(L1、N1)及3种以上抗生素耐药,个别菌株(Z2)对10种抗生素耐药。

表4 11株西藏牦牛源沙门菌对12种抗生素药物敏感性试验结果

注:S.敏感;I.中介;R.耐药图5 11株西藏牦牛源沙门菌分离株药物敏感性检测结果
2.6 耐药基因检测6类药物相关耐药基因的PCR检测结果如表5显示:3个地区分离的菌株均对喹诺酮类药物不耐药;拉萨市的3株分离菌和那曲市的5株分离菌均对其余5类药物耐药;林芝市的3株分离菌对其余4类药物耐药,对磺胺类药物不耐药。此外,四环素类耐药基因tetA的检出率高达90.91%;其次是β-内酰胺类耐药基因blaTEM和氯霉素类耐药基因floR,检出率为81.82%;而喹诺酮类耐药基因gyrA和gyrB均未检出。

表5 11株西藏牦牛源沙门菌耐药基因PCR检测结果
2.7 构建系统发育树对6株(每个地区2株不同血清型沙门菌)牦牛源沙门菌分离株的invA基因序列与GenBank登录的核苷酸序列进行同源性比对分析并构建系统发育树。结果如图7显示,西藏牦牛源沙门菌与人源(CP054827.1、CP050728.1)、禽源(CP043563.1、CP051286)、猪源(CP053294.1)、羊源(CP034716.1)、牛源(CP025241.1)以及食物源(CP060507.1)沙门菌同源性为99%~100%;拉萨市分离株L2与那曲分离株N2在同一分支;林芝市分离株与其他分离株同属另一分支;拉萨市分离株L1与食物源沙门菌(CP033255.2、CP033352.2)在同一分支;那曲市分离株N1和林芝市分离株Z2在同一分支,林芝市分离株Z1单独属于一个分支。

注:L1,L2.拉萨市分离菌;Z1,Z2.林芝市分离菌;N1,N2.那曲市分离菌;标尺表示遗传距离,指每个位点有0.000 5个氨基酸替换图7 西藏牦牛源沙门菌invA基因序列进化树
3 讨论
本试验对采集自西藏拉萨、那曲和林芝3个地区的腹泻牦牛粪便进行了细菌的分离培养,并对分离菌进行了染色镜检和生化试验鉴定,结合特异性基因检测结果确定获得了沙门菌11株,分离率为12.08%(11/91)。同储倩等[30]从四川甘孜、阿坝两地牦牛粪便中分离沙门菌的分离率(8.17%)和柏雪等[31]从青藏高原部分地区牦牛粪便中分离沙门菌的分离率(9.23%)相比较高。其中,那曲市牦牛源沙门菌的分离率为19.23%(5/26),占总分离菌数的百分比为45.46%(5/11),远高于其他两地。那曲市与其他两地相比,海拔更高,牦牛生长环境更恶劣;同时西藏牦牛养殖主要以放牧为主,导致病牛不能被及时发现,以至于携带病原的粪便易污染水源和食物,造成健康牛只感染。因此,建议定期检查牛群腹泻情况,适当更换放牧地点;定期清理牛舍,保持牛舍清洁干燥,定期消毒;同时一旦发现腹泻及时医治;做好疫病防控的同时,加强养殖环境的管理。
本试验分离到的西藏牦牛源沙门菌经血清型鉴定,分为都柏林沙门菌、丙型副伤寒沙门菌、伤寒沙门菌、纽波特沙门菌、阿邦尼沙门菌以及肠炎沙门菌6种。其中都柏林沙门菌、丙型副伤寒沙门菌为优势血清型,该结果与关龙伏等[32]、詹发茂等[33]和张斌等[34]对不同地区牦牛源沙门菌优势血清型的研究结果相似。牛作为都柏林沙门菌的天然宿主易被感染,易导致母牛流产,严重影响养殖业的健康发展,该结果的发现应当引起重视[35]。丙型副伤寒沙门菌、伤寒沙门菌和肠炎沙门菌是引起人类腹泻的主要血清型,同时孔雪英等[36]曾从牦牛肉中分离得到丙型副伤寒沙门菌,因此,相关血清型的公共卫生学意义值得引起关注。此外,本次试验中首次从牦牛源中分离出阿邦尼沙门菌。据文献报道,阿邦尼沙门菌毒性较强,可引起类似于伤寒沙门菌病的相关症状[32,37-38],提醒我们需加强监管。
invA基因作为沙门菌的特异性鉴定基因,编码沙门菌的入侵蛋白,该蛋白在沙门菌的致病性上起重要作用,invA基因在沙门菌不同种属间具有高度同源性,与其他生物种属的核苷酸序列无同源关系[23-24]。本试验对6株牦牛源沙门菌(6种血清型各一株)与GenBank中已登录的沙门菌进行对比,结果显示:西藏牦牛源沙门菌与多种动物源(CP054827.1、CP050728.1、CP043563.1、CP053294.1、CP025241.1等)在同一分支上,说明其亲缘性较近,提示我们不同血清型的沙门菌可感染不同的宿主,应加强食品卫生管理,避免沙门菌通过食物感染人,从而引起食物中毒等疾病。
对分离到的11株牦牛源沙门菌进行药物敏感性试验,结果显示:分离菌株普遍具有较高的耐药性。其中,对β-内酰胺类药物(氨苄西林、头孢唑林、头孢噻肟)的耐药率最高,为81.82%,该结果比刘玉英等[39]报道的36.17%高出许多,同时其相关耐药基因blaTEM检出率为81.82%;而对喹诺酮类药物(萘啶酸和环丙沙星)的耐药率为18.18%,相关耐药基因gyrA和gyrB则未检出。此外,对四环素的耐药率为54.55%,该结果与柏雪等[31]发现的四环素药物耐药率为60%的结果相近,相关耐药基因tetB检出率为45.46%,与柏雪等[31]的研究结果相一致;耐药基因tetA检出率为90.91%,耐药表型与耐药基因检出率略有差异,该结果与王华然等[40]发现的沙门菌四环素耐药基因检出率(80.99%)较为接近。本次试验中耐药率和耐药基因检测结果基本一致,说明西藏牦牛源耐药表型与基因型逐渐趋于相同,且存在相关性;但部分结果的差异提示,具体耐药机制还需深入研究。同时,本次实验分离的耐药菌株均表现出不用程度的多重耐药,主要集中在3~9耐,其中以4耐为主,然后是2耐和6耐,分别占总菌株数的36.36%和18.18%。此次试验结果说明西藏部分地区牦牛源沙门菌的耐药情况较为普遍,单一菌对多种药物的耐药情况越来越严重,存在同时携带多种耐药基因的情况,提醒我们急需改善临床用药的种类和抗生素使用方法。
综上,本研究发现沙门菌目前在西藏牦牛中存在一定的流行趋势,且不同动物源沙门菌存在同源性,而单一菌株的对药物的耐药情况和耐药基因携带情况也越来越严重,提示相关部门需重视沙门菌的防治,加强监管;相关养殖户需重视养殖环境,做好卫生清洁;同时也应当注重临床用药,考虑采取多种药物交叉使用,避免超级耐药菌的出现。
