4种家兔呼吸道致病菌多重PCR的建立及初步应用
2021-10-30仇汝龙范志宇宋艳华魏后军陈萌萌朱伟峰薛家宾江苏省农业科学院兽医研究所农业部兽用生物制品工程重点实验室江苏南京210014
仇汝龙,范志宇,胡 波,宋艳华,魏后军,陈萌萌,朱伟峰,薛家宾,王 芳 (江苏省农业科学院 兽医研究所 农业部兽用生物制品工程重点实验室,江苏 南京 210014)
兔呼吸道疾病由细菌、支原体和病毒等因素引发,在兔疾病中发生率仅次于兔肠道疾病[1-2]。随着我国家兔养殖业的发展,中国已经成为世界家兔养殖和消费的大国,兔养殖业的规模化和集约化造成疾病的快速传播,其中呼吸道疾病的发病率也急剧增加[3]。根据家兔呼吸道病流行病学调查[4],细菌是引发兔呼吸道疾病的主要病因,其中多杀性巴氏杆菌是家兔呼吸道疾病的主要致病菌,普遍存在于群居的家兔,常感染成年兔引起兔鼻炎、肺炎及败血症等疾病,且发病率和致死率随兔日龄而增长[5]。在患有呼吸道疾病的兔中常常会检出支气管败血波氏杆菌,因此该菌被认为是共生病原或者是多杀性巴氏杆菌致病的诱因。然而与多杀性巴氏杆菌不同的是,支气管败血波氏杆菌经常感染幼兔并导致其发病[6-7];铜绿假单胞菌和肺炎克雷伯氏菌也被认为是常导致兔呼吸道病的致病菌[8],其临床症状与多杀性巴氏杆菌相似,患病兔在临床上主要表现为精神不振、呼吸困难和食欲消退等症状;肺部症状主要有肺出血、化脓等[9]。4种呼吸道致病菌引发的疾病的临床症状与肺部病理变化相似,且常常为混合感染,不利于临床鉴别和诊断。另外,铜绿假单胞菌和肺炎克雷伯氏菌也是引发人下呼吸道感染的主要致病菌。国内外报道显示,铜绿假单胞菌的感染率常年居下呼吸道感染的首位[10]。因此,建立可快速、有效地鉴定常见家兔呼吸道致病菌的诊断方法迫在眉睫。
本研究建立的4种常见家兔呼吸道疾病致病菌多重PCR方法,可以对铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌进行快速鉴定,对于疾病诊断和细菌分离鉴定具有重要指导意义。
1 材料与方法
1.1 菌株与临床样本兔源多杀性巴氏杆菌C51-17株(保藏于中国典型培养物保藏中心,编号:CCTCC M 2018401)、铜绿假单胞菌JS17株、支气管败血波氏杆菌JS06株、肺炎克雷伯氏菌SD18株(由本实验室分离鉴定并保存)、肠炎沙门菌、大肠杆菌、产气荚膜梭菌、兔出血症病毒、金黄色葡萄球菌均由笔者所在实验室提供。临床样本来自山东、四川、江苏、浙江、福建、河南等地区的规模化兔场采集的37份肺脏和21份鼻拭子。
1.2 主要试剂与仪器TaqPro HS DNA聚合酶购自诺唯赞生物科技股份有限公司;DL2000 DNA Marker和琼脂糖等购自北京擎科新业生物技术有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;核酸蛋白测定仪NanoDrop购自美国赛默飞世尔公司;Eppendorf Mastercycler PCR仪购自美国艾本德中国有限公司;冷冻研磨仪MB-48LD购自浙江美壁仪器有限公司;高速冷冻离心机Centrifuge 5804R购自美国艾本德中国有限公司。
1.3 引物设计与合成参考GenBank中已发布的多杀性巴氏杆菌KMT1基因(GenBank登录号:CP028927.1)、支气管败血波氏杆菌flaA基因(GenBank登录号:CP022962.2)、铜绿假单胞菌gyrA基因(GenBank登录号:NC002516.2)和肺炎克雷伯氏菌rcsA基因序列[11](GenBank登录号:NC_016845.1),利用Primer3.0软件设计4对特异性引物[12],由北京擎科新业生物技术有限公司合成,引物序列及及相关信息见表1。

表1 多重PCR引物序列及相关信息
1.4 多重PCR反应条件的优化将铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌的DNA分别稀释至100 μg/L,等量混匀作为核酸模板。多重PCR反应优化包括退火温度的优化(55.1,55.6,56.3,57.5,58.8,60.0,61.2,62.5℃)以及多重引物浓度优化(由25 μmol/L倍比稀释为8个浓度梯度)。PCR反应体系:5×Taq Pro Buffer(Mg2+Plus) 5 μL ,Taq Pro HS DNA聚合酶0.25 μL,4对上、下游引物(最佳浓度)共4 μL,混合模板DNA 1 μL,加ddH2O补足至25 μL。PCR反应条件:95℃ 预变性2 min;95℃ 变性 30 s,55~60℃退火30 s,72℃延伸1 min,30个循环;72℃延伸7 min。
1.5 多重PCR特异性试验制备多杀性巴氏杆菌、铜绿假单胞菌、肺炎克雷伯氏菌和支气管败血波氏杆菌DNA的混合和单一模板,另外分别提取金黄色葡萄球菌、大肠杆菌、产气荚膜梭菌和沙门菌的DNA及兔出血症病毒RNA反转录的cDNA作为模板,以ddH2O为空白对照,进行特异性检测。
1.6 多重PCR敏感性试验将铜绿假单胞菌、多杀性巴氏杆菌、肺炎克雷伯氏菌和支气管败血波氏杆菌的DNA调整至100 μg/L,等量混合至每种细菌DNA的质量浓度为25 μg/L,以10倍梯度进行稀释,稀释至第8个稀释度,检测该多重PCR对4种细菌病原的敏感性。
1.7 人工感染及兔肺脏病原菌的多重PCR检测将25只4月龄试验兔随机分为试验组和对照组,每组5只,采用肺部注射的方式进行人工感染,注射剂量为1 mL,攻毒剂量分别为多杀性巴氏杆菌 20 CFU、支气管败血波氏杆菌 1×109CFU、肺炎克雷伯菌 1×102CFU、铜绿假单胞菌 1×108CFU。由于多杀性巴氏杆菌感染发病较快,所以接种后24 h,对5只接种多杀性巴氏杆菌的试验兔实施安乐死并取肺脏。攻毒后48 h,取剩余试验兔肺脏,进行匀浆和离心,收取上清为目的样品。分别以4种病原菌感染肺脏的样品等比例混合作为混合样品和未感染兔肺脏样品为模板,按照试剂盒说明书提取细菌DNA并进行PCR检测。
1.8 临床样品的检测利用已建立的4种家兔呼吸道致病菌多重PCR方法,对从山东、四川等地区的规模化兔场采集的37份具有明显病变的肺组织和21份具有明显鼻炎症状兔的鼻试子进行检测。同时与单一PCR检测结果进行比较,以验证该多重PCR方法的可靠性。单一PCR检测参照TOWNSEND等[13]建立的多杀性巴氏杆菌特异性PCR方法,HOZBOR等[14]建立的支气管败血波氏杆菌特异性PCR方法,张伟等[15]建立的铜绿假单胞菌PCR检测方法,王贵升等[16]建立的肺炎克雷伯氏菌PCR检测方法。
2 结果
2.1 多重PCR反应的建立及条件优化以铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌的DNA作为模板进行扩增,试验温度分别为55.1,55.6,56.3,57.5,58.8,60.0,61.2,62.5℃;混合引物浓度由25 μmol/L倍比稀释至第6稀释度。结果表明,退火温度为57.5℃时扩增效果最佳(图1),最佳的引物终浓度为125 nmol/L(图2)。经优化后,多重PCR反应体系:5×PCR Buffer(Mg2+Plus)5 μL,引物(每种引物浓度为6.25 μmol/L,各0.5 μL)4 μL,模板DNA 2 μL,Taq Pro HS DNA聚合酶 0.5 μL,ddH2O 13.5 μL。反应参数:95℃预变性2 min;95℃变性30 s,57.5℃退火30 s,72℃延伸1 min,30个循环;72℃延伸7 min。
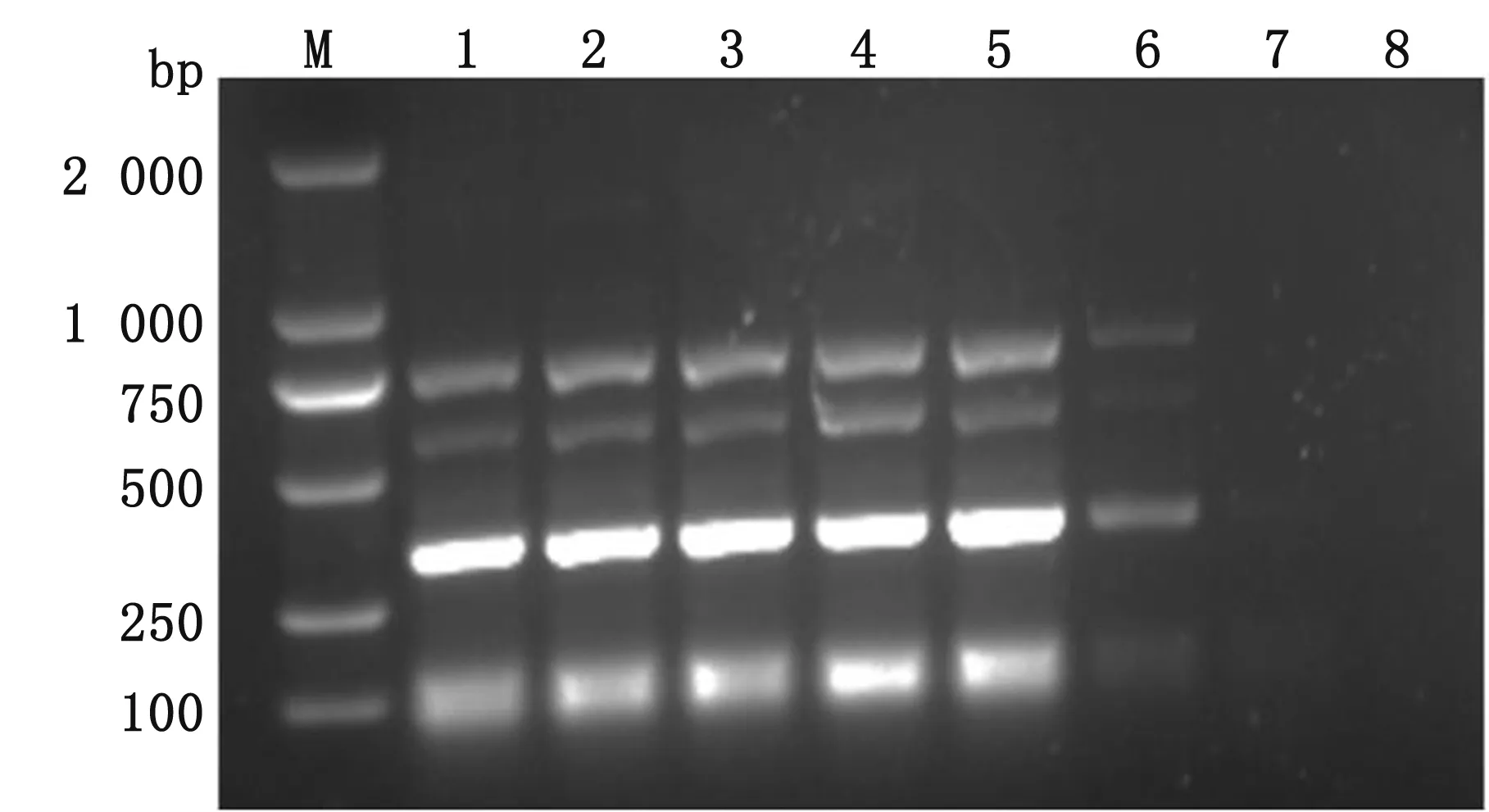
M.DL2000 DNA Marker;1~8. 55.1~62.5℃图1 PCR退火温度的优化
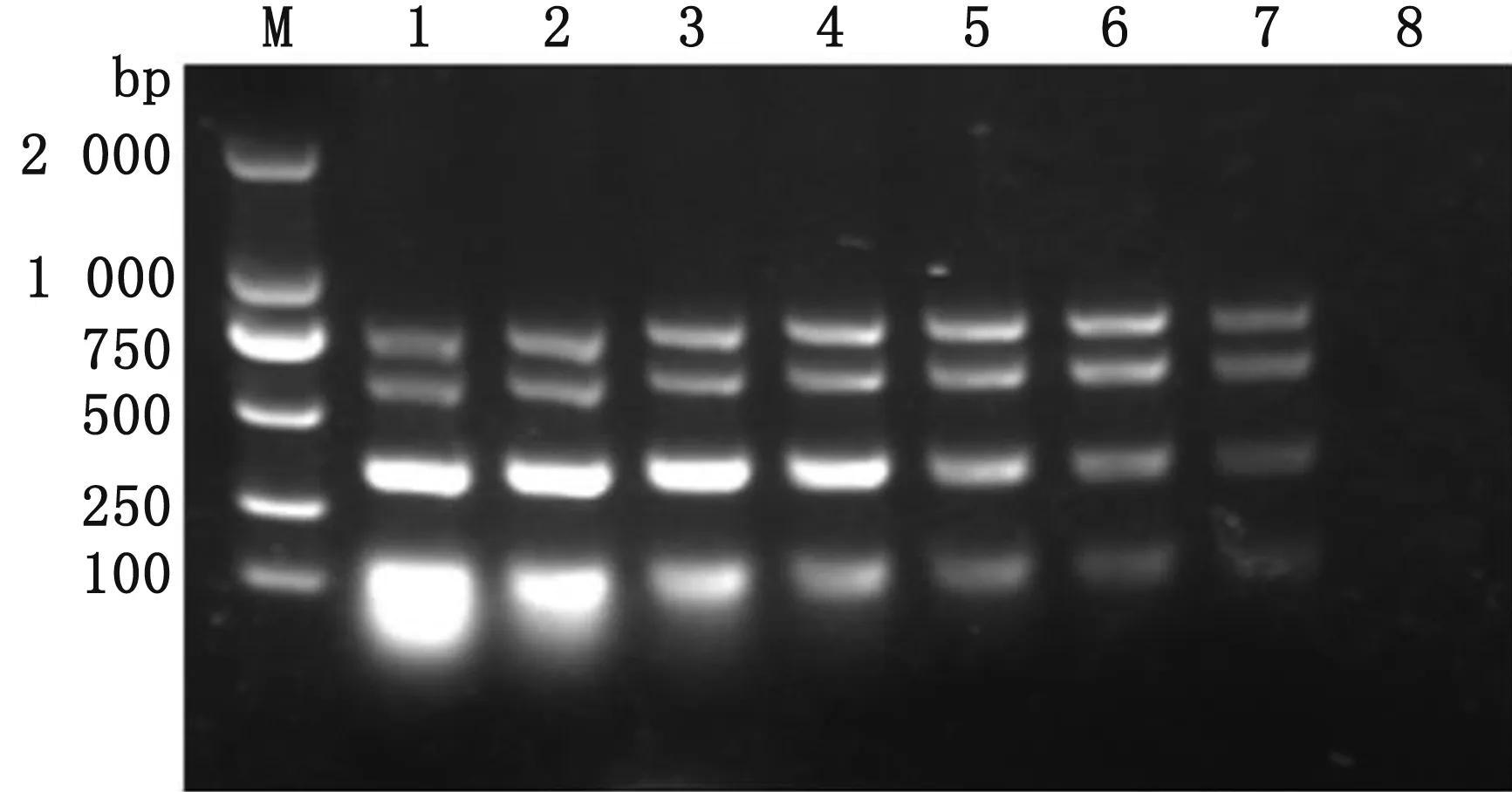
M.DL2000 DNA Marker;1~8.500.00~3.90 nmol/L图2 PCR引物浓度的优化
2.2 特异性试验使用本试验建立的4重PCR方法对兔源铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌样品的目的基因进行特异性扩增,条带大小分别为797,558,321,122 bp,而对金黄色葡萄球菌、大肠杆菌、魏氏梭菌和沙门菌、兔病毒性出血症病毒cDNA和超纯水均无特异性条带(图3),表明该方法具有较好的特异性。
M.DL2000 DNA Marker;1.4种细菌混合模板;2.铜绿假单胞菌;3.肺炎克雷伯氏菌;4.多杀性巴氏杆菌;5.支气管败血波氏杆菌;6.金黄色葡萄球菌;7.大肠杆菌;8.产气荚膜梭菌;9.沙门菌;10.兔出血症病毒cDNA;11.阴性对照图3 PCR特异性试验
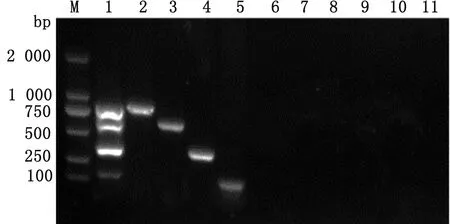
2.3 敏感性试验敏感性试验结果表明,本试验建立的多重PCR方法对铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌DNA的最低检出质量浓度分别为2.5×10-1,2.5×100,2.5×10-2,2.5×10-2μg/L(图4)。

M.DL2000 DNA Marker;1~7. 2.5×101~2.5×10-5 μg/L图4 PCR敏感性试验
2.4 人工感染及兔肺脏多重PCR检测通过肺部注射方式人工感染20只试验兔,于接菌后24,48 h采集兔肺脏,分别取4种致病菌感染组的一份兔肺脏样本等比例混合,最后获得5份包含4种致病菌的混合样本,对照组混合成为1份样本,对6份样本进行多重PCR检测。结果显示,5份混合细菌样本均检测为阳性,对照组则为阴性(图5)。
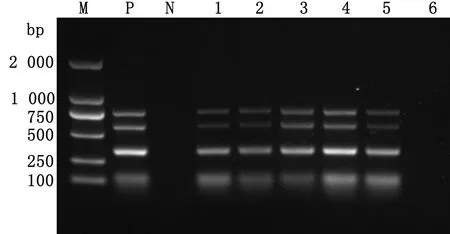
M.DL2000 DNA Marker;P.阳性对照;N.阴性对照;1~5. 4种细菌混合兔肺脏样本;6.对照组兔肺脏样本图5 多重PCR检测人工感染兔肺脏
2.5 临床样品的检测应用建立的多重PCR方法对兔37份肺组织和21份鼻拭子进行检测(表2)。比较多重PCR与单一PCR的检测结果,可见两种方法的阳性检出率无显著性差异(P>0.05),说明该多重PCR方法具有可靠性。
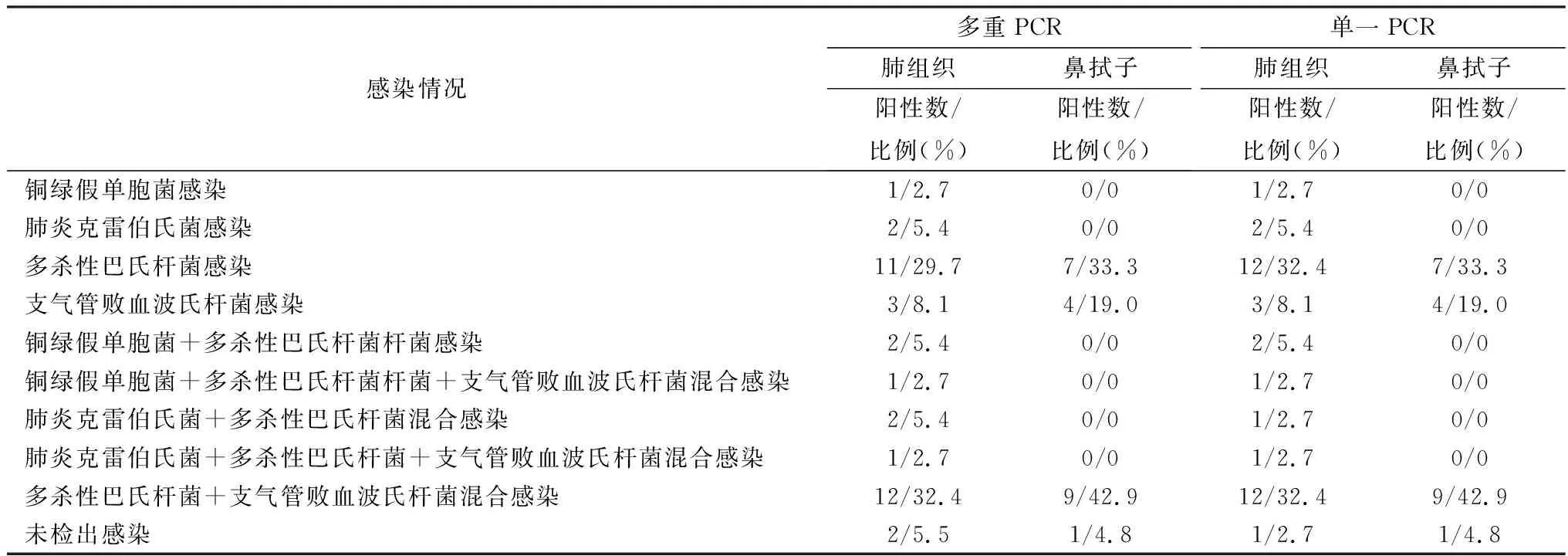
表2 临床样本PCR检测结果
3 讨论
随着家兔养殖业的快速发展,中国已成为世界第一家兔养殖、出口及消费大国。家兔养殖的发展也正向规模化、集约化、机械化和程序化迈进,然而养殖规模扩大导致疾病的快速传播。兔呼吸道疾病对兔养殖业的危害仅次于兔肠道疾病,是引发兔发病和死亡的主要疾病之一。兔呼吸道疾病的诱因主要有生物因素和环境因素[17],其中生物因素主要是致病性细菌,特别是多杀性巴氏杆菌、支气管败血波氏杆菌、铜绿假单胞菌和肺炎克雷伯氏菌,它们也是人兽共患致病菌,对兔场人员的健康造成威胁。多杀性巴氏杆菌是兔呼吸道疾病的主要致病菌,支气管败血波氏杆菌也经常在患病兔呼吸道检出,它们引发感染的临床症状相似,病理变化也难以准确区分。肺炎克雷伯氏菌和铜绿假单胞菌均会引起兔肺炎,肺炎克雷伯氏菌还会引发败血症等症状,并且它们还会和多杀性巴氏杆菌及支气管败血波氏杆菌混合感染兔呼吸道,导致难以通过临床症状及病理变化准确区分。尽管邓钊宾等[18]分别建立了针对兔出血症病毒及细菌的4重PCR,但是尚未有针对铜绿假单胞菌、肺炎克雷伯氏菌、多杀性巴氏杆菌和支气管败血波氏杆菌4种呼吸道疾病致病菌的多重PCR检测方法。
本试验根据铜绿假单胞菌的gyrA基因、肺炎克雷伯氏菌的rcsA基因、多杀性巴氏杆菌的KTM1基因和支气管败血波氏杆菌的flaA基因的保守区域设计多对引物,经多次验证后筛选出4对可同时特异性的扩增出相应目的片段的引物,作为建立多重PCR方法的引物。通过对退火温度和引物浓度进行优化,获得最佳的PCR反应条件。敏感性试验结果证明,本试验建立的针对4种致病菌的多重PCR方法的最低模板质量浓度为0.025~2.5 μg/L,低于已报道的多重PCR方法可检测的最低模板质量浓度,如夏颖等[19]建立的方法的最低模板质量浓度为1 μg/L,说明该方法具有较高的敏感性,达到对临床样本检测的浓度要求[20]。该多重PCR方法可特异的扩增4种致病菌的相应靶基因片段,对其他5种常见的家兔传染病病原均无扩增条带,证明本方法有较强的特异性。临床肺组织和鼻拭子样本检测结果显示,多杀性巴氏杆菌和支气管败血波氏杆菌的检出率较高;同时也存在绿脓杆菌、肺炎克雷伯氏菌的感染,与王孝友等[21]和任克良等[22]报道相似。该方法与单一PCR进行比对,检测结果无明显差异;该方法1次反应仅耗时2.5 h,比已报道的多重PCR时间缩短1/2。
综上所述,本试验建立的检测4种呼吸道疾病致病菌的多重PCR方法具有良好的特异性和灵敏性且反应时间短,可用于家兔呼吸道病的快速鉴别诊断,可为4种家兔呼吸道传染病的流行病学调查提供技术手段。
