牛病毒性腹泻病毒基因2型云南株的分离与鉴定
2021-10-30普浩宇亐开兴杨贵伟程美玲黄必志任珂青尹革芬云南农业大学动物医学学院云南昆明6500云南省草地动物科学研究院云南昆明650
普浩宇,亐开兴,杨贵伟,程美玲,黄必志,王 蓉,任珂青,尹革芬* (.云南农业大学 动物医学学院,云南 昆明 6500;.云南省草地动物科学研究院,云南 昆明 650)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)可通过直接接触和垂直传播途径引起感染[1],其中垂直传播是导致商品化血清BVDV抗原阳性的主要原因[2-3]。不同品种、年龄段的牛对BVDV均易感,以12月龄以下的犊牛最为易感。感染牛临床主要以发热、腹泻、渐进性消瘦及消化道黏膜充血、出血、水肿至糜烂为特征,奶牛感染后呈现产乳量下降或停止,妊娠母牛发生流产。1946年美国最早报道了BVDV的出现[4],随后在比利时、澳大利亚和新西兰等多国也相继报道了该病毒。1980年李佑民等[5]首次从国内牛流产死胎的脾脏中分离得到BVDV,此后相继新疆、内蒙古、甘肃等20多个省市报道了该病毒的出现[6-7]。1989年美国首次报道了BVDV-2的出现[8-9],随后多个国家报道了BVDV-2的流行[10]。我国也有多个省份报道了BVDV-2毒株的流行[11-12],给养牛业造成了严重的经济损失。
BVDV与猪瘟病毒(CSFV)、绵羊边界病毒(BDV)同属黄病毒科瘟病毒属成员[13],属于单股正链RNA病毒,基因组约12.3 kb,病毒粒子为有囊膜的球形颗粒,直径约50~80 nm。基因组两端为非编码区(5′UTR和3′UTR),仅有1个开放阅读框(ORF),编码12种蛋白,其中包含4种结构蛋白(C、E0、E1和E2)。目前,BVDV可分为3个基因型(BVDV-1、BVDV-2和BVDV-3)。根据毒株是否可引起细胞病变效应(cytopathic effect,CPE)和NS2-3氨基酸序列中泛素编码序列的插入情况[14],BVDV分为2个生物型:致细胞病变型(CP)和非致细胞病变型(NCP)[15]。依据5′UTR核苷酸序列和P54氨基酸序列特征可将BVDV-2型毒株分为高毒力毒株和低毒力毒株[16-17]。
2020年云南省景谷县某牛场发生导致犊牛严重腹泻的传染病,本研究采集病样进行疾病的诊断,对病原进行分离、鉴定、扩增分离病原的全基因序列并进行遗传进化分析,揭示了BVDV云南流行株的分子遗传特征,为该病毒的防控提供参考。
1 材料与方法
1.1 主要试剂MDBK细胞(牛肾细胞)购自中国典型培养物保藏中心细胞库;MEM培养基、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗、胰酶购自Gibco公司;cDNA Synthesis Mix、PCR SuperMixⅡ购自北京全式金公司;RNAiso plus、pMD18-T、DH5α、T4连接酶购自大连宝生物公司;DNA纯化回收试剂盒、质粒提取试剂盒购自北京百泰克生物技术有限公司;qRT-PCR试剂iScriptTMcDNA Synthesis Kit、SsoFastTMEvaGreen®SuperMix购自美国Bio-Rad公司;BVDV抗原检测试剂盒(IDEXX cat:99-0010876)购自美国IDEXX公司;多聚甲醛、TritonX-100、封闭液、DAPI购自上海碧云天公司;鼠源抗羊BVDV-2型单抗购自美国Santa Cruz公司。
1.2 样品检测根据NCBI数据库中的参考序列设计了BVDV的检测引物JC-F/JC-R,引物序列见表1,运用RT-PCR方法对采集的样本进行检测。利用质粒回收试剂盒将所得PCR产物进行纯化回收,并连接到pMD18-T载体,连接产物转化入DH5α感受态细胞中培养,筛选阳性克隆并提取质粒送生物公司测序。
1.3 病毒分离在经测序确认的阳性样品中加入等体积的MEM培养基(含0.1%双抗),置于4℃冰箱过夜,使病毒充分悬浮。离心收集上清并用0.22 μm 过滤器过滤,将滤液接种MDBK细胞,感作1 h后换新鲜的MEM培养基(含10% FBS),于37℃、 5% CO2培养箱中继续培养,每日观察。72 h后收取细胞培养物,冻融3次后离心收集上清,再进行下一代培养。
1.4 qRT-PCR检测利用1.2中构建的含有病毒DNA片段的质粒建立绝对定量标准曲线。提取病毒细胞培养物的总RNA,使用随机引物进行逆转录反应,采用SYBR Green法进行qPCR扩增,将所得Ct值带入标准曲线,计算出不同代次细胞培养物的病毒载量。
1.5 ELISA抗原检测将接种病毒的细胞培养至72 h,吸取100 μL细胞培养液,利用BVDV抗原检测ELISA试剂盒对不同代次病毒进行抗原检测,得到不同代次细胞培养物BVDV抗原的D450 nm值。
1.6 免疫荧光试验(IFA)将生长状态良好的MDBK细胞,按1×104个细胞/孔接种96孔培养板,添加含10% FBS的MEM培养基,置于37℃、5% CO2培养箱中培养。待细胞约铺满孔底的85%时,接种100 TCID50病毒,感作1 h后,更换为含有5% FBS的MEM继续培养,于48,72 h弃上清,用37℃预温的PBS(pH7.4)漂洗细胞3遍,向孔中缓慢加入100 μL预冷的2%多聚甲醛固定20~30 min;固定结束后用预冷的PBS漂洗3遍,自然干燥,加入0.3%的TritonX-100穿透15 min,用1%的脱脂奶粉4℃封闭2 h,加一抗4℃过夜孵育;用PBS漂洗3次,自然干燥后加入二抗37℃孵育1 h,用PBS漂洗3次,自然干燥后每孔加入DAPI室温孵育10 min,用PBS洗3遍,用荧光显微镜进行观察并拍照记录。
1.7 病毒毒力测定将病毒液倍比稀释成10-1~10-8共8个浓度梯度,每个浓度设置8个重复,分别接种96孔板培养的MDBK细胞,每日观察,培养5 d 后,各孔细胞均未出现明显的CPE,故采用IFA法检测各试验孔中病毒的增殖情况,按照Reed-Muench法计算该BVDV分离株的TCID50。
1.8 病毒全基因测序及分析根据GenBank数据库中BVDV参考毒株序列,设计全基因扩增引物,由生工生物工程(上海)有限公司合成,引物序列见表1。提取细胞培养物的总RNA,经逆转录获得cDNA,以cDNA为模板,利用全基因扩增引物,用PCR SuperMixⅡ进行PCR扩增。将阳性PCR产物纯化回收并克隆入pMD18-T,将连接产物转化入DH5α中,涂布于抗性平板,过夜培养后挑取单个菌落,扩大培养后提取质粒送生工生物工程(上海)股份有限公司测序,利用DNAStar 6.0进行序列拼接,得到YNJG毒株全基因序列。

表1 BVDV检测和全基因测序引物
2 结果
2.1 样品检测结果显示,在预期大小310 bp处出现特异性条带(图1)。回收纯化特异性扩增条带,克隆至pMD18-T载体,进行序列测定,将所得序列与NCBI 数据库中的BVDV序列进行比对,证实所采集样本为BVDV阳性样本。
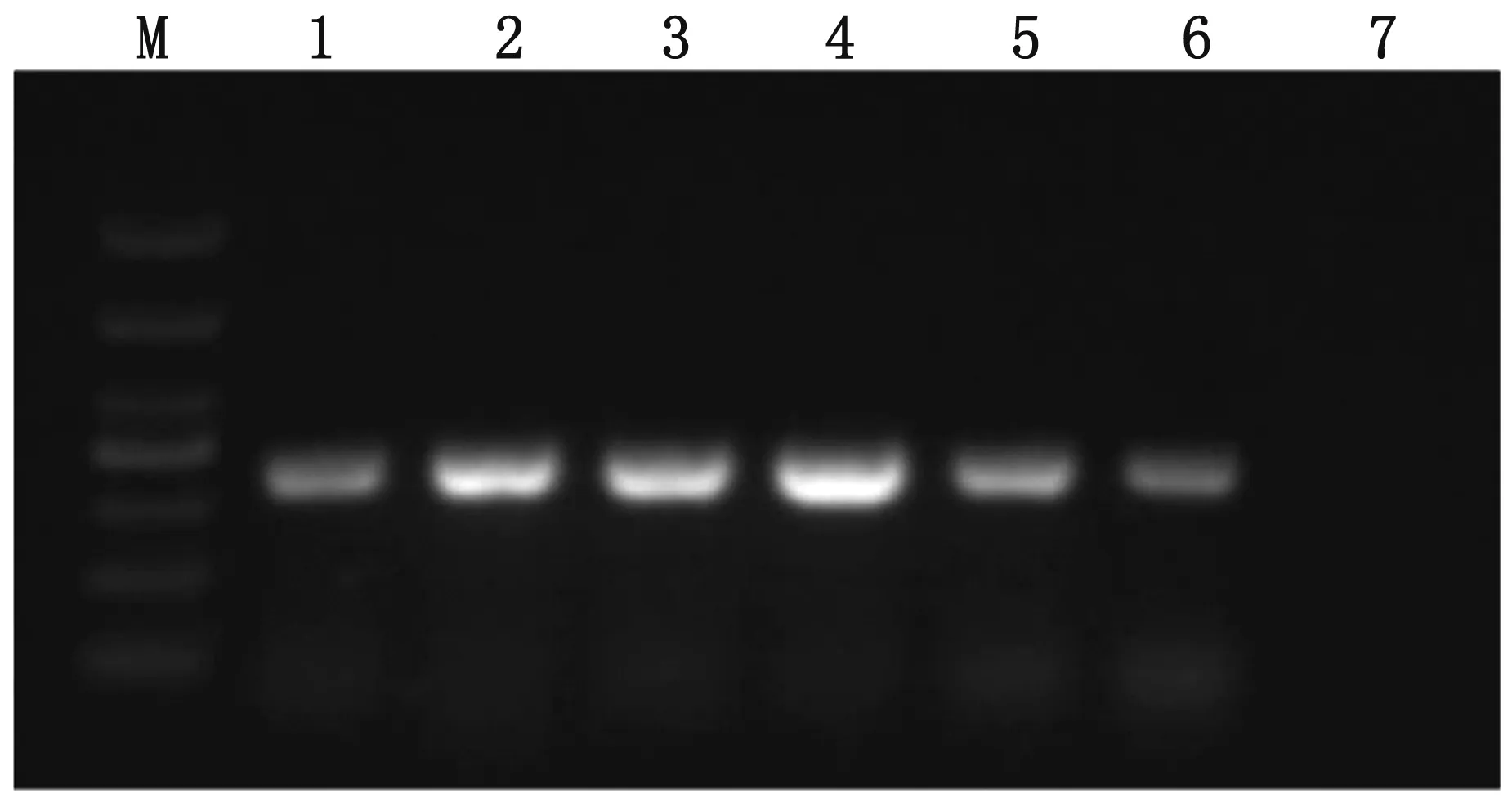
M.DL1000 DNA Marker;1~6.1~6号样品;7.阴性对照(ddH2O)图1 样品BVDV RT-PCR检测结果
2.2 病毒分离及鉴定结果利用qRT-PCR方法检测细胞培养物中的病毒载量,将所得Ct值代入标准曲线,计算出各代次细胞培养物的病毒载量,结果显示,随着病毒接种代次的增加,病毒载量逐渐升高然后趋于稳定(表2)。运用BVDV抗原检测ELISA试剂盒对细胞培养物进行检测,根据不同代次病毒细胞培养物的抗原D450 nm值计算出S/N值(样本/阴性对照>0.4为阳性),结果显示,随着接种代次的增加,上清液中的病毒载量逐渐升高(表3)。将病毒接种于MDBK细胞,收取接毒后48,72 h的细胞样品,通过IFA进行检测,结果如图2所示,荧光标记的BVDV特异性单克隆抗体识别并结合病毒蛋白,在荧光显微镜下可见细胞质出现绿色荧光,可确认分离获得了BVDV毒株。
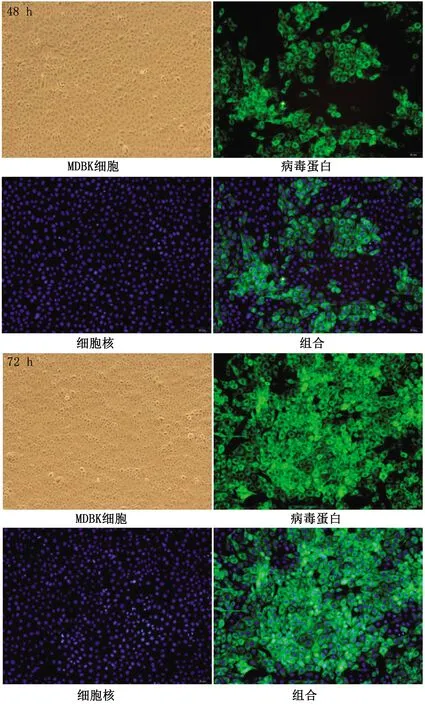
图2 病毒免疫荧光染色结果(200×)
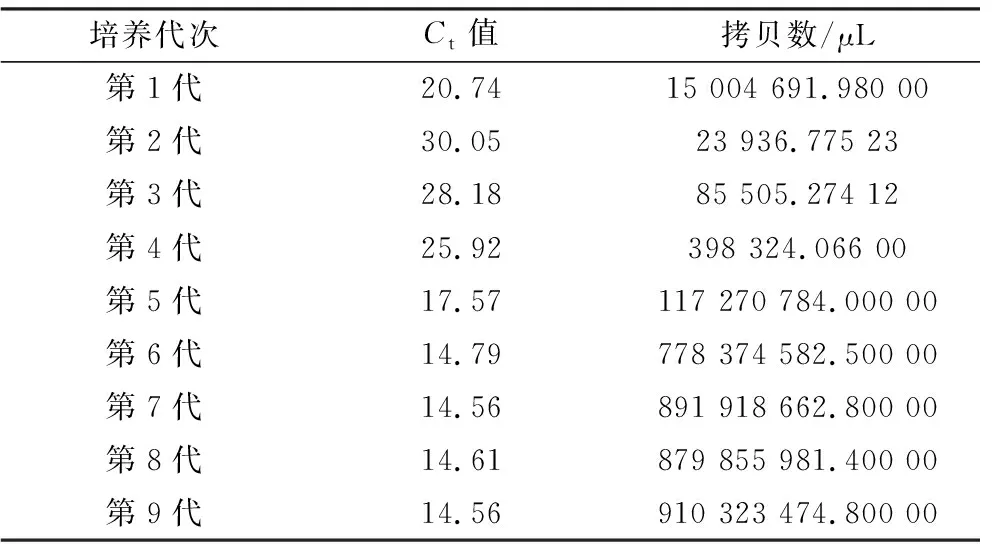
表2 qRT-PCR检测各代次细胞培养物的病毒载量
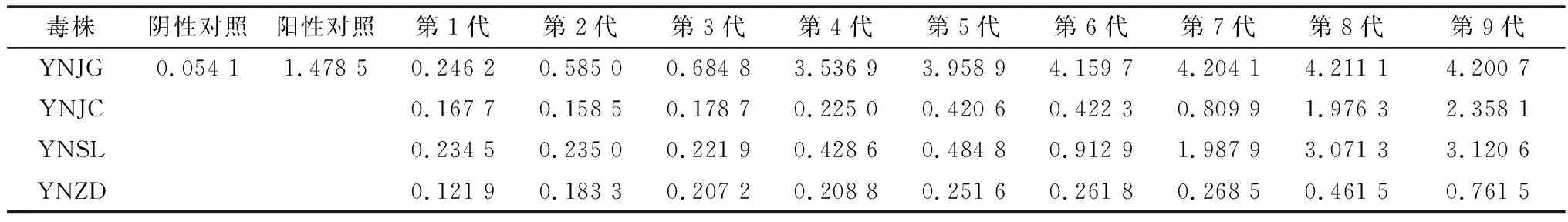
表3 不同代次毒株的ELISA抗原检测S/N值
2.3 病毒毒力测定将病毒液稀释成10-1~10-8共8个梯度,然后接种细胞,培养5 d后,采用免疫荧光染色法观察各试验孔中病毒的增殖情况,根据Reed-Muench法计算出YNJG分离株的滴度为10-4.4TCID50/100 μL。
2.4 基因型分析测序得到该毒株5′UTR序列的大小为384 bp,利用MegAlign与参考毒株(表4)进行比对,并进行系统进化分析,结果显示,YNJG分离株与BVDV-2代表毒株(New York 93、XJ-04等)聚集在一个独立分支,与BVDV-1和BVDV-3明显分开(图3),表明该分离株属于BVDV-2毒株。
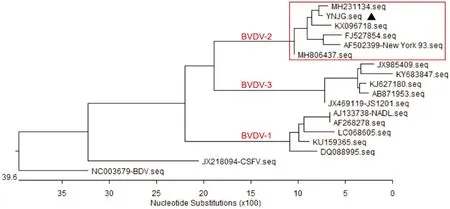
图3 YNJG分离株与参考毒株5′UTR序列的遗传进化树分析
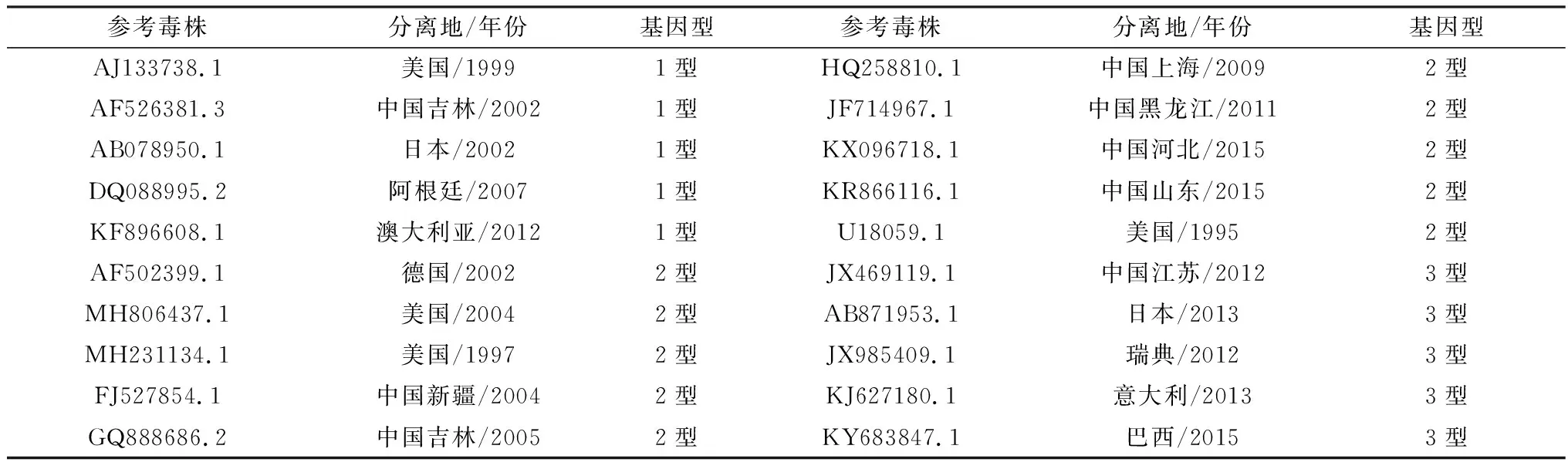
表4 不同基因型BVDV参考毒株信息
2.5 全基因遗传进化分析测序产物拼接后显示,该毒株全基因序列长为12 288 bp,与国内外参考毒株全基因序列进行比对,遗传进化树分析显示:YNJG分离株与BVDV-2代表毒株(New York 93、XJ-04等)聚集在一个分支,与美国分离株9231(MH 806437.1)和B9497(MH 231134.1)亲缘关系最近(图4A);核苷酸同源性分析显示:YNJG与分离株9231和B9497的核苷酸同源性分别为95.4%,94.7%(图4B)。

图4 YNJG与参考毒株全基因遗传进化分析(A)和核苷酸同源性分析(B)
2.6 E2基因氨基酸位点变异分析YNJG分离株E2基因全长1 116 bp,编码372个氨基酸残基。与国内外参考毒株相比,在B细胞抗原表位区116~126 aa(红色框)含有1个N-糖基化位点(黄色三角),其中116位氨基酸为疏水性的丙氨酸(A); T细胞抗原表位区154~162 aa(蓝色框)的158位和162位氨基酸分别为亲水性的苏氨酸(T)和碱性的精氨酸(R);此外,148位和196位氨基酸分别出现T→I和K→R的氨基酸突变(图5)。
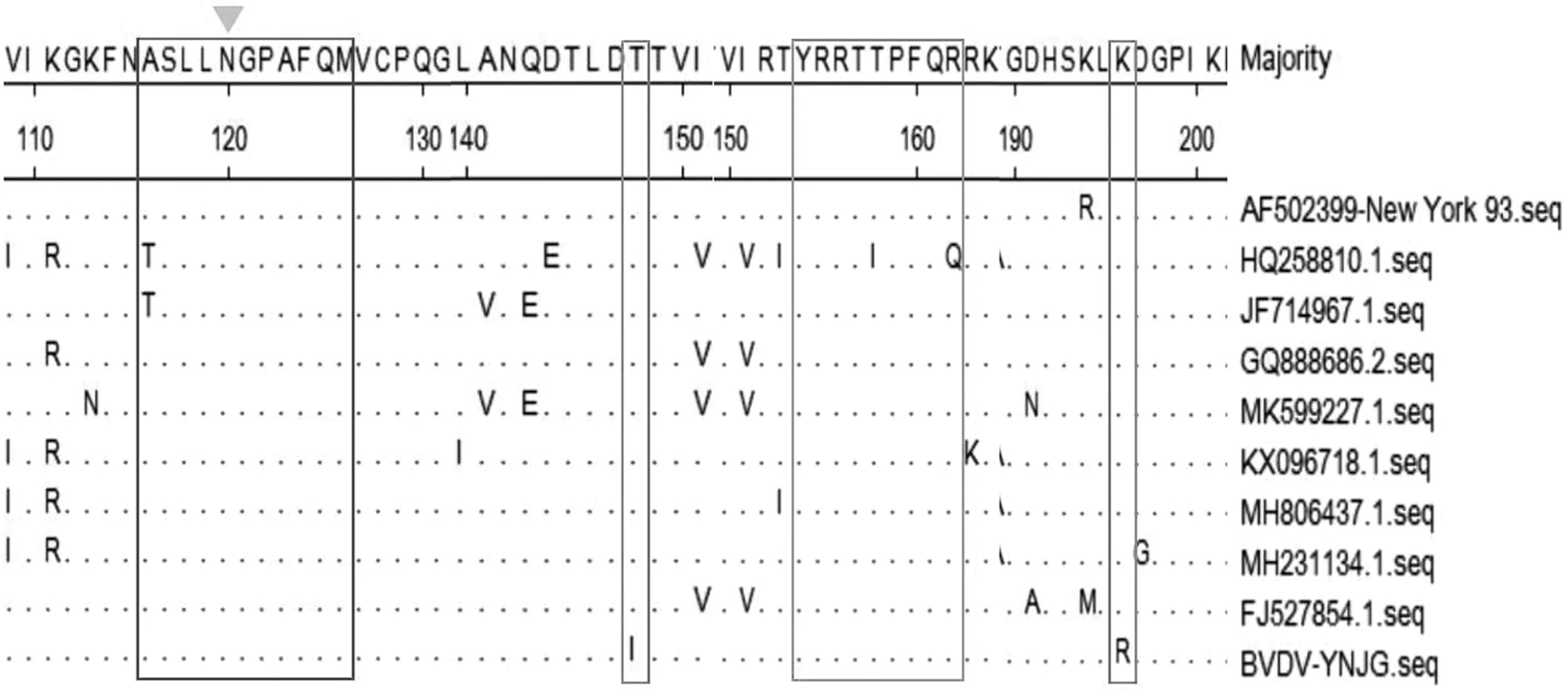
图5 YNJG与参考毒株E2基因氨基酸位点变异分析
2.7 毒株生物型和毒力分析与CP型BVDV-2型代表毒株New York 93(AF502399)相比,YNJG分离株的非结构蛋白NS2和NS3间(1 607 aa)无泛素编码序列的插入,属于非致细胞病变型(NCP)毒株(图6A);与强毒株890(U18059)和New York 93相比,其5′UTR核苷酸序列的第216位核苷酸和275位核苷酸分别为C和T,且其氨基酸全序列的第1 142 位氨基酸处无氨基酸的插入,可能属于低毒力毒株(图6B,C)。
3 讨论
BVDV是危害养牛业健康发展最为重要的病原之一。近年,由于跨国家、地区引种的增加及跨区域调运的频繁[18],我国部分地区发现了BVDV-2的流行[11-12],给养牛业造成了巨大的经济损失,有必要加大对新型毒株的监测和预警。目前,分子流行病学研究和病毒基因组系统发育分析是监测新型毒株出现和分析进化选择方向的主要手段。本研究利用MDBK细胞从临床腹泻的犊牛粪便中分离得到1株BVDV,命名为YNJG。利用qRT-PCR方法检测病毒基因拷贝数,通过ELISA方法检测细胞培养物抗原含量[19],利用特异性BVDV-2抗体对接种YNJG毒株的MDBK进行IFA,结果显示该毒株在MDBK中具有良好的增殖能力,并能与特异性抗体结合呈现出绿色荧光,利用IFA,按Reed-Muench方法测定YNJG分离株的滴度为10-4.4TCID50/100 μL。
设计引物扩增病毒的全基因序列,依照BVDV病毒分型方法[20],使用5′UTR基因序列进行分型,发现该分离株远离CSFV和BDV分支,且与BVDV-2 New York 93、XJ-04等参考毒株聚集在一起,表明YNJG分离株属于BVDV-2毒株支系。病毒全基因遗传进化分析和核苷酸同源性分析显示,YNJG毒株与2018年美国分离株9231(MH 806437)、B9497(MH 231134)的核苷酸同源性分别为95.4%,94.7%。根据BVDV-2毒株的非结构蛋白NS2与NS3氨基酸序列之间有无泛素编码序列的插入,在翻译过程中能否加工产生大量单一的NS3蛋白,将其分为NCP或CP生物型[14]。序列分析显示,YNJG分离株NS2~3氨基酸序列之间无泛素编码序列插入,且不能导致MDBK细胞出现典型的CPE,属于NCP毒株。BVDV-2毒株毒力有强弱之分,5′UTR序列的第216位和275位核苷酸是区分其毒力的分子标记,强毒株分别为T和C,而弱毒株则为C和T[16];研究报道,强毒株在氨基酸全序列第1 142位处有连续76个氨基酸的插入[17];通过与强毒株比对分析显示,YNJG分离株为弱毒株。
E2蛋白是BVDV的主要囊膜蛋白,属于糖蛋白,具有高度的免疫原性,可诱导机体产生中和抗体。YNJG分离株E2基因氨基酸的B细胞抗原表位区域(116~126 aa)[21]含有1个N-糖基化位点,且116位氨基酸为疏水性的丙氨酸(A);在T细胞抗原表位区(154~162 aa)的158位和162位氨基酸分别为亲水性的苏氨酸(T)和碱性的精氨酸(R),与美国分离株9231和中国新疆分离株FJ527845一致,故可能存在较高的中和活性和交叉反应性,临床上可导致相似的症状和病理损伤。另外,在148位和196位氨基酸分别出现T→I和K→R的氨基酸突变,其中148位氨基酸的突变导致了氨基酸由亲水性到疏水性的改变,是否会导致毒株的中和抗体敏感性降低还需要进一步的研究。
全基因序列比对分析发现,各地区流行毒株的基因型不同,感染能力和毒力各异。通常,BVDV-1毒株只引发免疫力较低的牛出现轻度腹泻,而BVDV-2毒株可导致严重的急性出血性腹泻、淋巴细胞减少及呼吸道症状,还可造成犊牛持续性感染,引起免疫抑制,犊牛死亡率可达25%以上[8,22]。血清交叉中和试验表明,BVDV-1疫苗与BVDV-2毒株存在较大的抗原差异[23],BVDV-1疫苗对BVDV-2毒株仅具有较低的保护作用,因此,开发新型毒株疫苗防控牛病毒性腹泻已成为亟待解决的问题。
